15.10:
산과 염기로서의 이온
15.10:
산과 염기로서의 이온
산성 이온을 가진 소금
염은 양이온과 음이온으로 구성된 이온 화합물이며, 그 중 하나는 물과 산 또는 기본 이온화 반응을 겪을 수 있습니다. 따라서 수성 염용액은 염 성분 이온의 상대산염 강도에 따라 산성, 기본 또는 중성일 수 있다. 예를 들어, 물에 염산 암모늄을 용해하면 방정식에 의해 설명된 대로 해리가 발생합니다.
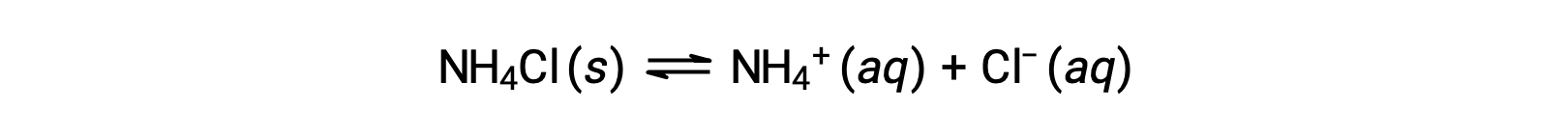
암모늄 이온은 염기 암모니아, NH3의컨쥬게이트 산이다. 그 산 이온화 (또는 산 가수 분해) 반응은
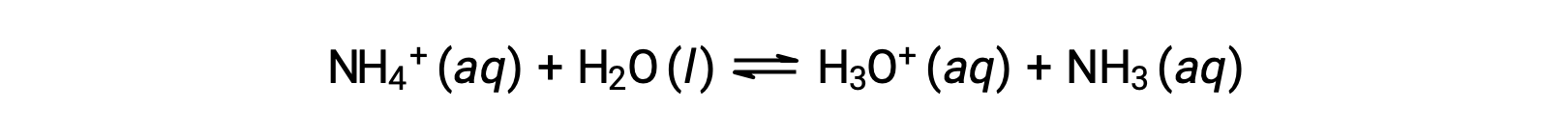
암모니아는 약한 기저이기 때문에,Kb는 측정 가능하고Ka> 0(암모늄 이온은 약한 산입니다).
염화물 이온은 염산의 컨쥬게이트 베이스이므로 염기 이온화(또는 염기 가수분해) 반응으로 표현됩니다.
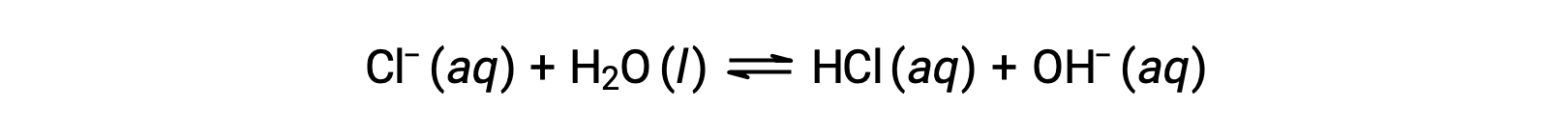
HCl은 강한 산이기 때문에Ka는 헤아릴 수 없을 정도로 크고 Kb ≈ 0(염화물 이온은 상당한 가수분해를 겪지 않습니다). 따라서, 물에 염화암모늄을 용해시키는 것은 산성 용액을 초래하는 약한 산성 양이온(NH4+)및 불활성 음이온(Cl−)의 용액을 산출한다.
기본 이온을 가진 소금
또 다른 예로, 물에 아세테이트 나트륨을 용해시키는 것이 좋습니다.
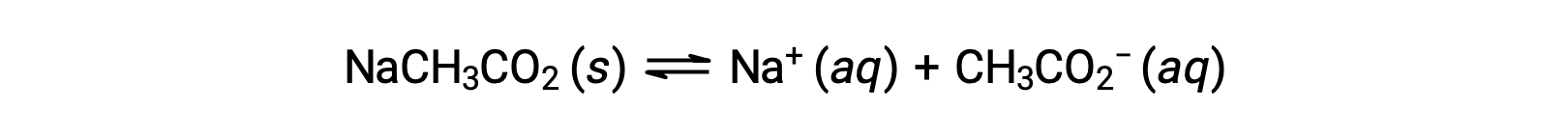
나트륨 이온은 상당한 산 또는 염기 이온화를 거치지 않으며 용액 pH에 영향을 미치지 않습니다. 이것은 수소 또는 산소 원자를 나타내는 이온의 공식에서 명백하게 보일 수 있습니다, 그러나 몇몇 용해된 금속 이온은 약한 산으로 작동합니다, 이 단면도의 나중에 다루듯이. 아세테이트 이온, CH3CO2–– 아세트산, CH3CO2H의 컨쥬게이트 베이스이므로 기본 이온화(또는 염기 가수분해) 반응으로 표현된다.
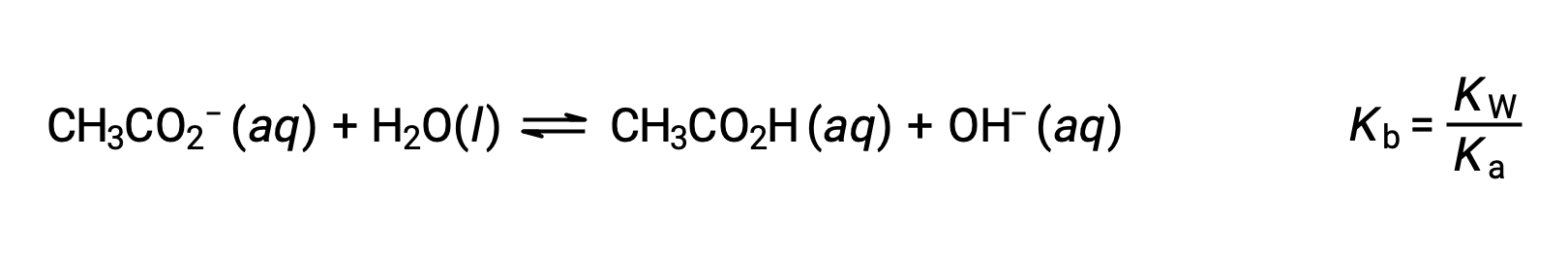
아세트산은 약한 산이기 때문에,그Ka는 측정 할 수 있고 Kb > 0 (아세테이트 이온은 약한 베이스입니다). 물에 아세테이트 나트륨을 용해하면 불활성 양이온(Na+)과약한 염기 음이온(CH3CO2−)의용액을 산출하여 기본 용액을 생성합니다.
산성 및 기본 이온을 가진 소금
일부 염은 산성 및 기본 이온으로 구성되므로 솔루션의 pH는 이 두 종의 상대적 강도에 따라 달라집니다. 이러한 유형의 염의 경우 Ka 및 Kb 값을 비교하여 용액의 산염 기반 상태를 예측할 수 있습니다.
수화 금속 이온의 이온화
이전 예제의 그룹 1 및 2 금속 이온(Na+,Ca2+등)과 달리 일부 금속 이온은 수성 용액에서 산으로 기능합니다. 이 이온은 용해 될 때 물 분자에 의해 느슨하게 솔바드는 것이 아닙니다. 대신 그들은 복잡한 이온을 산출하기 위해 물 분자의 고정 된 수에 공유 결합 (조정 화학에 장 참조). 예를 들어, 물에 알루미늄 질산염의 용해는 일반적으로

그러나, 알루미늄(III) 이온은 실제로 6개의 물 분자와 반응하여 안정적인 복합 이온을 형성하므로 용해 공정의 보다 명시적인 표현은
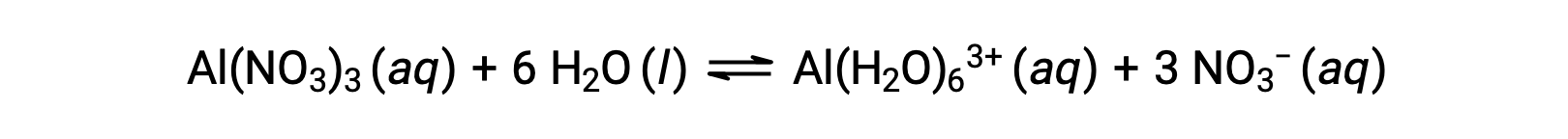
Al(H2O)63+ 이온은 중앙 알 원자와 6개의 물 분자의 O 원자 사이의 결합을 포함한다. 따라서, 결합된 물 분자의 O-H 결합은 비결합수 분자에 있는 보다는 더 극적입니다, 결합된 분자는 수소 이온의 기증에 더 수그립니다:
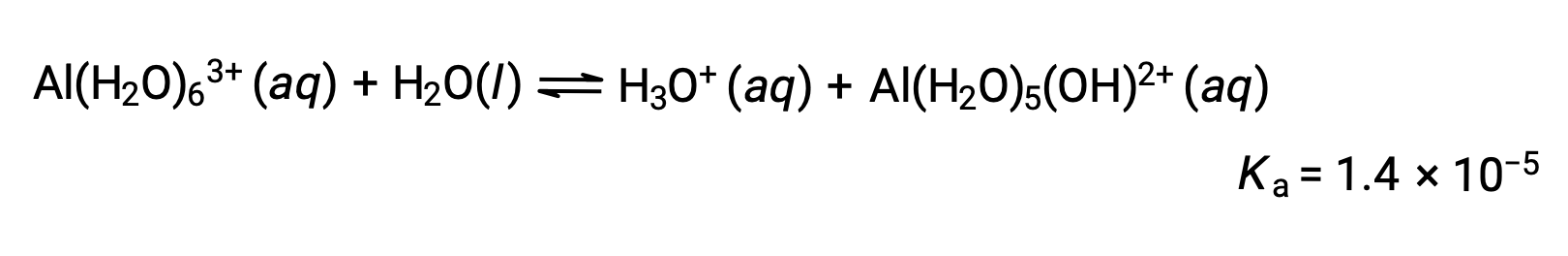
이 공정에 의해 생성된 공주 염기는 산으로 작용할 수 있는 5개의 다른 접재물 분자를 포함하고 있으므로 아래 몇 가지 방정식에서 묘사된 바와 같이 양성자의 순차적 또는 단계별 전달이 가능합니다.
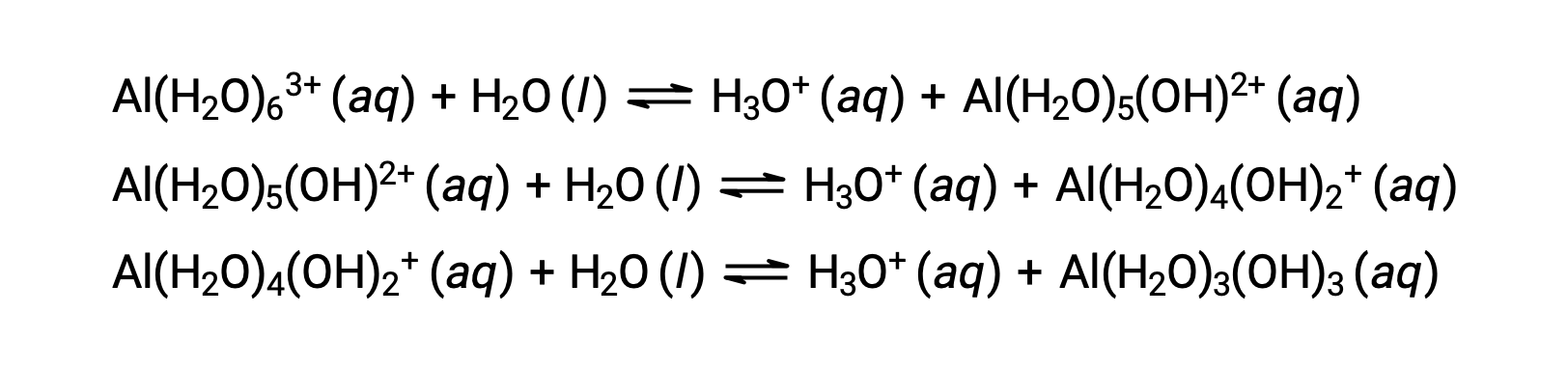
알칼리 금속(group 1) 및 일부 알칼리성 지구 금속(group 2)을 제외하고, 대부분의 다른 금속 이온은 물에 용해될 때 어느 정도 산 이온화를 받게 된다. 이러한 복잡한 이온의 산 강도는 전형적으로 금속 이온의 전하 증가 및 크기 감소로 증가합니다. 몇 가지 다른 산성 금속 이온에 대한 첫 번째 단계 산 이온화 방정식은 다음과 같습니다.
| 첫 번째 단계 이온화 방정식 | pKa |
| Fe (H2O)63 + (aq)+ H2O (l) ⇌ H3O+ (aq)+ Fe (H2O)5(OH)2 + (aq) | 2.74 |
| Cu (H2O)62 + (aq) + H2O (l) ⇌ H3O+ (aq)+ Cu (H2O)5(OH)+ (aq) | ~6.3 |
| Zn (H2O)42 + (aq) + H2O(l)⇌ H3O+ (aq) + Zn (H2O)3(OH) +(aq)+ ( aq) | 9.6 |
