15.10:
Les ions comme acides et bases
15.10:
Les ions comme acides et bases
Sels avec des ions acides
Les sels sont des composés ioniques constitués de cations et d’anions, qui peuvent subir une réaction d’ionisation de l’acide ou de la base avec l’eau. Par conséquent, les solutions aqueuses de sels peuvent être acides, basiques ou neutres, selon les forces acido-basiques relatives des ions qui constituent le sel. Par exemple, la dissolution du chlorure d’ammonium dans l’eau entraîne sa dissociation, comme décrit dans l’équation :
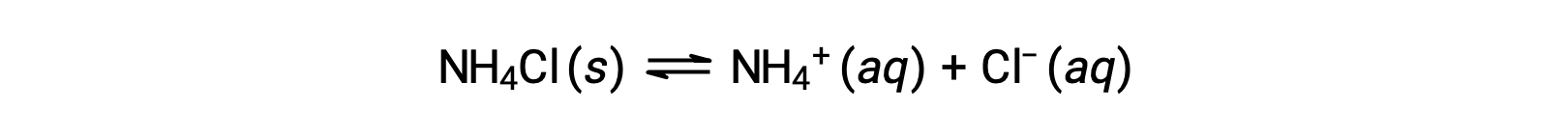
L’ion ammonium est l’acide conjugué de la base ammoniac, NH3 ; sa réaction d’ionisation de l’acide (ou hydrolyse acide) est représentée par
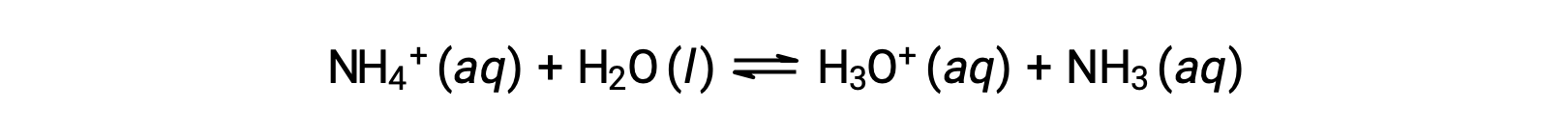
Comme l’ammoniac est une base faible, Kb est mesurable et Ka > 0 (l’ion ammonium est un acide faible).
L’ion chlorure est la base conjuguée de l’acide chlorhydrique, et sa réaction d’ionisation de la base (ou hydrolyse d’une base) est donc représentée par
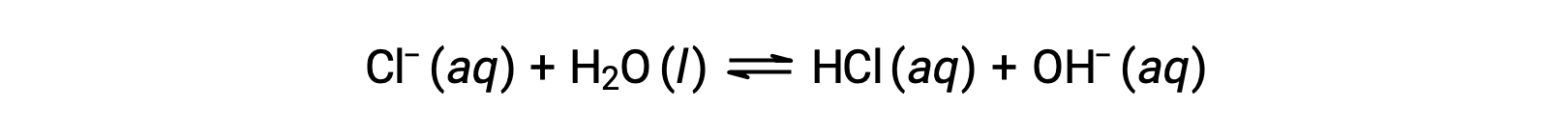
Puisque HCl est un acide fort, Ka est infiniment grand et Kb ≈ 0 (les ions chlorure ne subissent pas d’hydrolyse notable). Ainsi, la dissolution du chlorure d’ammonium dans l’eau donne une solution de cations faiblement acides (NH4+) et d’anions inertes (Cl−), ce qui donne une solution acide.
Sels avec des ions basiques
Comme autre exemple, envisagez la dissolution de l’acétate de sodium dans l’eau :
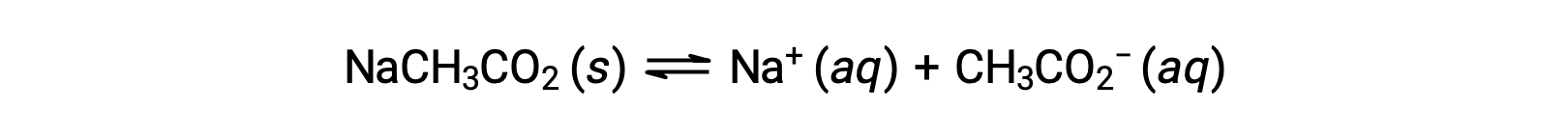
L’ion sodium ne subit pas d’ionisation de l’acide ou de la base notable et n’a aucun effet sur le pH de la solution. Cela peut sembler évident d’après la formule de l’ion, qui n’indique aucun atome d’hydrogène ou d’oxygène, mais certains ions métalliques dissous fonctionnent comme des acides faibles, comme cela sera vu plus loin dans cette section. L’ion acétate, CH3CO2−, est la base conjuguée de l’acide acétique, CH3CO2H, et sa réaction d’ionisation de la base (ou hydrolyse d’une base) est donc représentée par
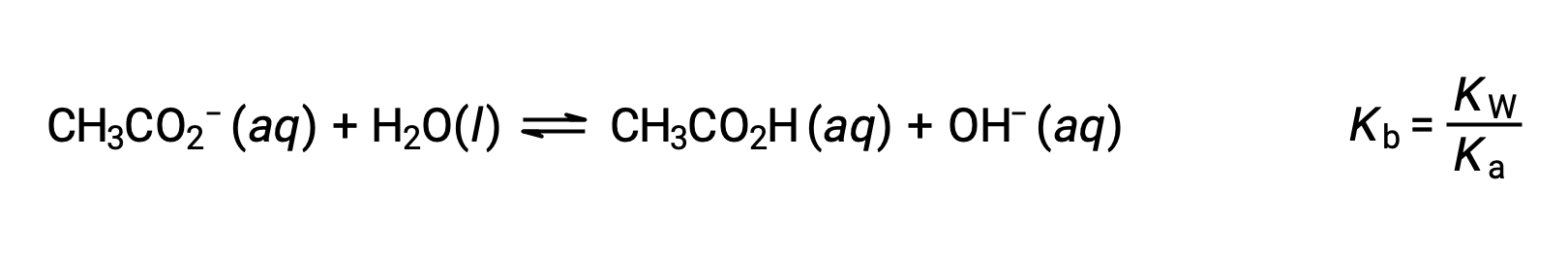
Comme l’acide acétique est un acide faible, son Ka est mesurable et Kb > 0 (l’ion acétate est une base faible). La dissolution de l’acétate de sodium dans l’eau donne une solution de cations inertes (Na+) et d’anions faiblement basiques (CH3CO2−), ce qui donne une solution basique.
Sels avec des ions acides et basiques
Certains sels sont composés d’ions acides et basiques, et le pH de leurs solutions dépendra donc des forces relatives de ces deux espèces. Pour de tels types de sels, une comparaison des valeurs de Ka et Kb permet de prédire l’état acido-basique de la solution.
Ionisation des ions métalliques hydratés
Contrairement aux ions de métaux des groupes 1 et 2 des exemples précédents (Na+, Ca2+, etc.), certains ions métalliques fonctionnent comme des acides en solutions aqueuses. Ces ions ne sont pas juste vaguement solvatés par des molécules d’eau lorsqu’ils sont dissouts ; ils sont plutôt liés de façon covalente à un nombre fixe de molécules d’eau pour produire un ion complexe (voir le chapitre sur la chimie de coordination). Par exemple, la dissolution du nitrate d’aluminium dans l’eau est généralement représentée comme

Cependant, l’ion aluminium(III) réagit en fait avec six molécules d’eau pour former un ion complexe stable, et la représentation plus explicite du processus de dissolution est donc
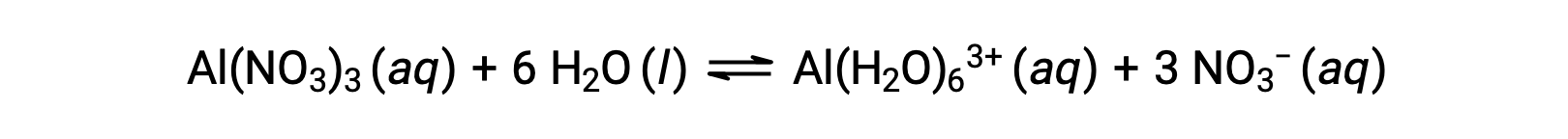
Les ions Al(H2O)63+ impliquent des liaisons entre un atome Al central et les atomes O des six molécules d’eau. Par conséquent, les liaisons O–H des molécules d’eau liées sont plus polarisées que dans les molécules d’eau non liées, ce qui rend les molécules liées plus sujettes au don d’un ion hydrogène :
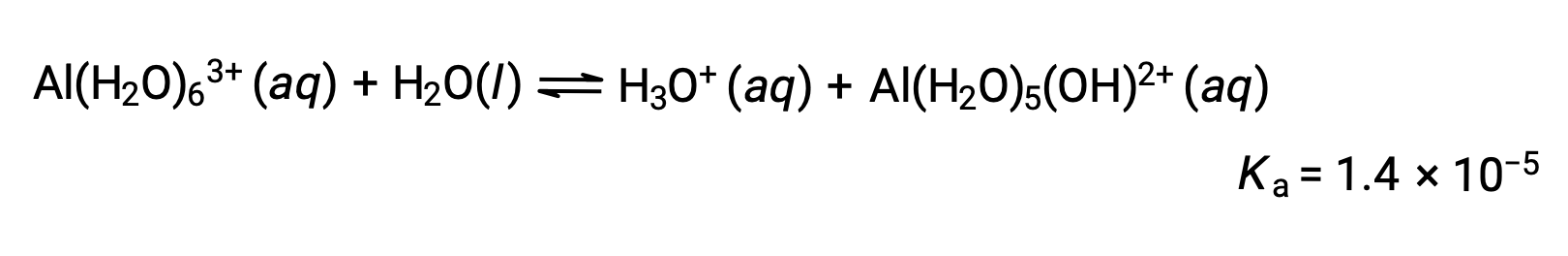
La base conjuguée produite par ce processus contient cinq autres molécules d’eau liées capables d’agir comme des acides, et donc le transfert séquentiel ou par étapes des protons est possible, comme illustré dans quelques équations ci-dessous :
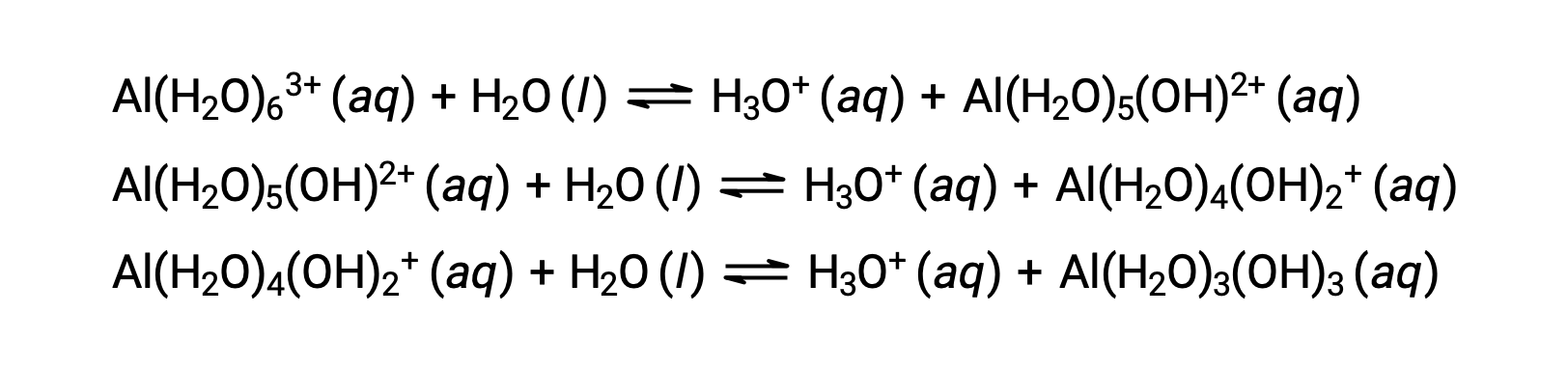 </p
</p
Outre les métaux alcalins (groupe 1) et certains métaux alcalino-terreux (groupe 2), la plupart des autres ions métalliques subissent une ionisation de l’acide dans une certaine mesure lorsqu’ils sont dissous dans l’eau. La force acide de ces ions complexes augmente généralement avec l’augmentation de la charge et la diminution de la taille des ions métalliques. La première étape des équations d’ionisation de l’acide pour quelques autres ions métalliques acides sont présentées ci-dessous :
| Première étape des équations d’ionisation | pKa |
| Fe(H2O)63+ (aq) + H2O (l) ⇌ H3O+ (aq) + Fe(H2O)5(OH)2+ (aq) | 2,74 |
| Cu(H2O)62+ (aq) + H2O (l) ⇌ H3O+ (aq) + Cu(H2O)5(OH)+ (aq) | ~6,3 |
| Zn(H2O)42+ (aq) + H2O (l) ⇌ H3O+ (aq) + Zn(H2O)3(OH)+ (aq) | 9,6 |
Ce texte est adapté de Openstax, Chimie 2e, Section 14.4 : Hydrolyse des sels.
