15.10:
Ioni come acidi e basi
15.10:
Ioni come acidi e basi
Sali con ioni acidi
I sali sono composti ionici composti da formazioni e anioni, uno dei quali può essere in grado di subire una reazione di ionizzazione acida o di base con acqua. Le soluzioni acquose di sale, quindi, possono essere acide, di base o neutre, a seconda delle relative forze acido-base degli ioni costituenti del sale. Ad esempio, sciogliere il cloruro di ammonio nell’acqua provoca la sua dissociazione, come descritto dall’equazione:
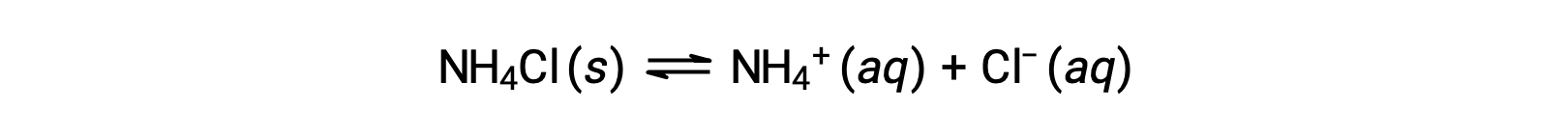
Lo ione ammonio è l’acido coniugato dell’ammoniaca di base, NH3; la sua reazione di ionizzazione acida (o idrolisi acida) è rappresentata da
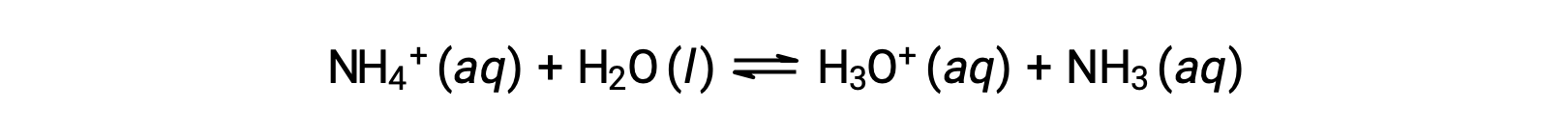
Poiché l’ammoniaca è una base debole, Kb è misurabile e Ka > 0 (lo ione ammonio è un acido debole).
Lo ione cloruro è la base coniugata dell’acido cloridrico, e quindi la sua reazione di ionizzazione di base (o idrolisi di base) è rappresentata da
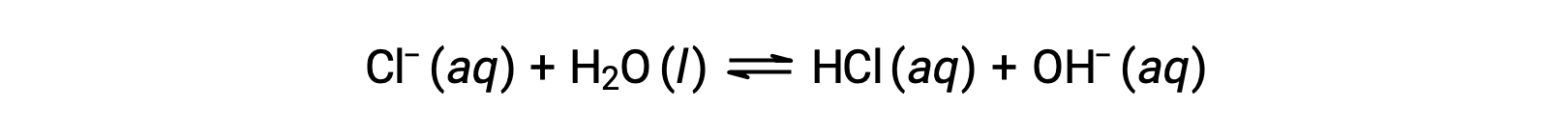
Poiché l’HCl è un acido forte, Ka è incommensurabilmente grande e Kb ≈ 0 (gli ioni cloruro non subiscono un’idrolisi apprezzabile). Pertanto, sciogliere il cloruro di ammonio nell’acqua produce una soluzione di formazioni acide deboli (NH4+) e anioni inerti (Cl−), con conseguente soluzione acida.
Sali con ioni di base
Come altro esempio, considera di sciogliere l’acetato di sodio in acqua:
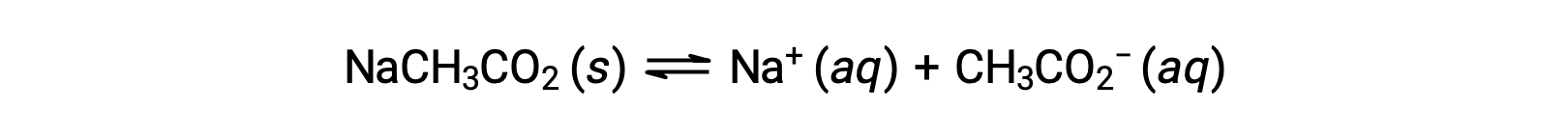
Lo ione sodico non subisce apprezzabili ionizzazione acida o di base e non ha alcun effetto sul pH della soluzione. Questo può sembrare ovvio dalla formula dello ione, che non indica atomi di idrogeno o ossigeno, ma alcuni ioni metallici disciolti funzionano come acidi deboli, come affrontato più avanti in questa sezione. Lo ione acetato, CH3CO2−, è la base coniugata dell’acido acetico, CH3CO2H, e quindi la sua reazione di ionizzazione di base (o idrolisi di base) è rappresentata da
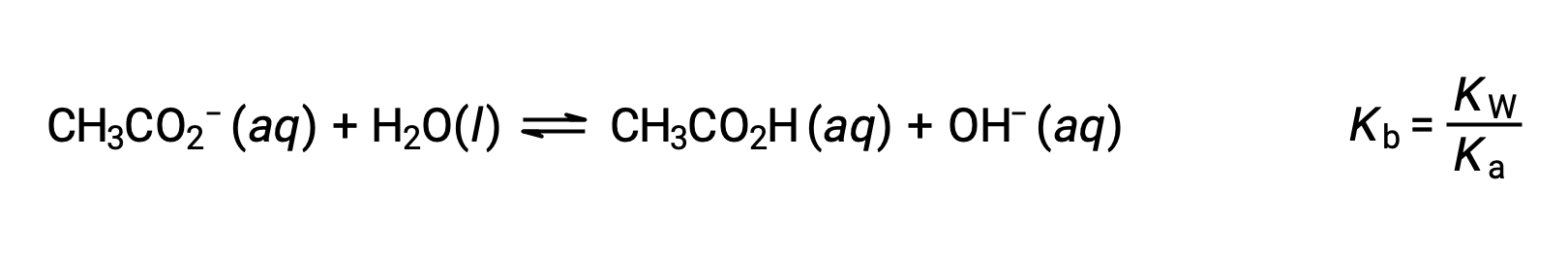
Poiché l’acido acetico è un acido debole, il suo Ka è misurabile e Kb > 0 (lo ione acetato è una base debole). Sciogliere l’acetato di sodio nell’acqua produce una soluzione di formazioni inerti (Na+) e anioni di base deboli (CH3CO 2−), risultando in unasoluzionedi base.
Sali con ioni acidi e di base
Alcuni sali sono composti sia da ioni acidi che da ioni di base, e quindi il pH delle loro soluzioni dipenderà dai punti di forza relativi di queste due specie. Per tali tipi di sali, un confronto dei valori Ka e Kb permette la previsione dello stato acido-base della soluzione.
La ionizzazione degli ioni metallici idrati
A differenza degli ioni metallici del gruppo 1 e 2 degli esempi precedenti (Na+, Ca2+, ecc.), alcuni ioni metallici funzionano come acidi in soluzioni acquose. Questi ioni non vengono solo liberamente solvatati dalle molecole d’acqua quando vengono sciolti; invece sono legati covalentemente ad un numero fisso di molecole d’acqua per produrre uno ione complesso (vedi il capitolo sulla chimica di coordinazione). Ad esempio, la dissoluzione del nitrato di alluminio nell’acqua è tipicamente rappresentata come

Tuttavia, lo ione alluminio(III) reagisce effettivamente con sei molecole d’acqua per formare uno ione complesso stabile, e quindi la rappresentazione più esplicita del processo di dissoluzione è
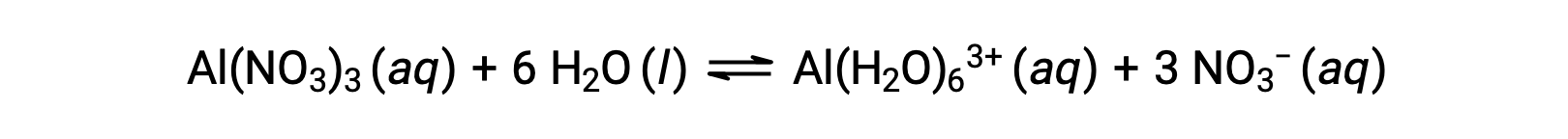
Gli ioni Al(H2O)63+ coinvolgono legami tra un atomo centrale di Al e gli atomi O delle sei molecole d’acqua. Di conseguenza, i legami O-H delle molecole d’acqua legate sono più polari che nelle molecole d’acqua non spinata, rendendo le molecole legate più inclini alla donazione di uno ione idrogeno:
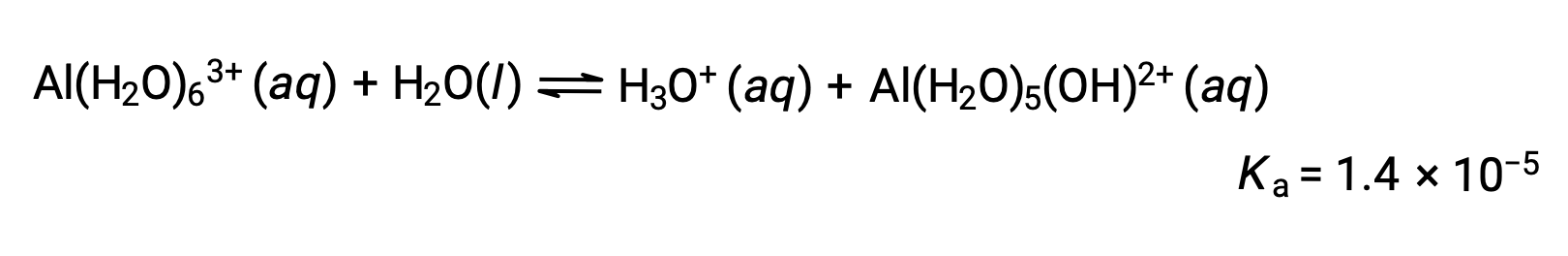
La base coniugata prodotta da questo processo contiene altre cinque molecole d’acqua legate in grado di agire come acidi, e quindi il trasferimento sequenziale o step-wise dei protoni è possibile come descritto in poche equazioni seguenti:
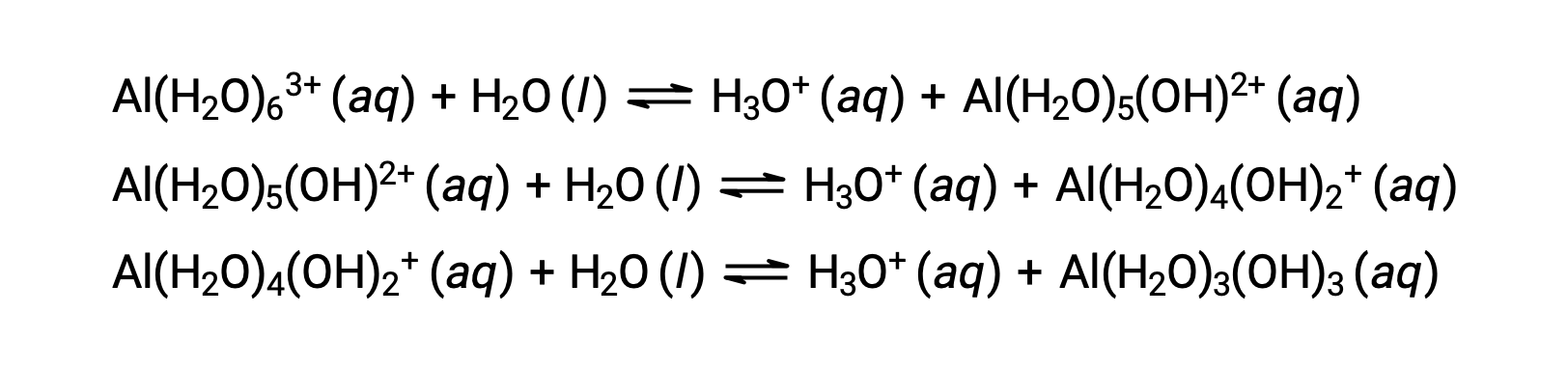
A parte i metalli alcalini (gruppo 1) e alcuni metalli alcalini della terra (gruppo 2), la maggior parte degli altri ioni metallici subirà una certa ionizzazione acida quando viene sciolta in acqua. La forza acida di questi ioni complessi aumenta tipicamente con l’aumento della carica e la diminuzione delle dimensioni degli ioni metallici. Le equazioni di ionizzazione acida del primo passo per alcuni altri ioni metallici acidi sono mostrate di seguito:
| Equazioni di ionizzazione del primo passo | pKa |
| Fe(H2O)63+ (aq) + H2O (l) ⇌ H3O+ (aq) + Fe(H2O)5(OH)2+ (aq) | 2.74 |
| Cu(H2O)62+ (aq) + H2O (l) ⇌ H3O+ (aq) + Cu(H2O)5(OH)+ (aq) | ~6,3 |
| Zn(H2O)42+ (aq) + H2O (l) ⇌ H3O+ (aq) + Zn(H2O)3(OH)+ (aq) | 9.6 |
Questo testo è adattato da Openstax, Chimica 2e, Sezione 14.4: Idrolisi dei Sali.
