16.4:
حساب تغيرات الرقم الهيدروجيني (pH) في محلول منظِّم
16.4:
حساب تغيرات الرقم الهيدروجيني (pH) في محلول منظِّم
يمكن أن يمنع المحلول المنظّم حدوث انخفاض مفاجئ أو زيادة في الرقم الهيدروجيني (pH) لمحلول ما بعد إضافة حمض أو قاعدة قوية إلى قدرته التنظيمية؛ ومع ذلك، فإن إضافة حمض أو قاعدة قوية تؤدي إلى تغيير طفيف في درجة الحموضة في المحلول. يمكن حساب التغير الصغير في الرقم الهيدروجيني عن طريق تحديد التغيير الناتج في تركيز المكونات المنظّمة، أي حمض ضعيف وقاعدته المقترنة أو العكس. يمكن استخدام التركيزات التي تم الحصول عليها باستخدام هذه الحسابات المتكافئة لتحديد الرقم الهيدروجيني النهائي للمحلول’ باستخدام معادلة هندرسون-هاسيلبلاخ أو جدول ICE.
على سبيل المثال، يحتوي المحلول المنظّم على 0.65 مول من حمض الفورميك وفورمات الصوديوم. نظرًا لأن تركيز الحمض الضعيف وقاعدته المترافقة هو نفسه هنا، فإن الأس الهيدروجيني للمحلول’ يساوي pKa للحمض الضعيف ، والذي هو 3.74 في هذه الحالة. إذا تمت إضافة 0.05 مول HNO3 إلى هذا المحلول، فيمكن تحديد التغييرات الناتجة في تركيز حمض الفورميك وفورمات الصوديوم عن طريق الحسابات المتكافئة كما هو موضح في الجدول أدناه.
| H+ (aq) | HCOO− (aq) | HCOOH (aq) | |
| Before addition (M) | ~0.00 mol | 0.65 mol | 0.65 mol |
| Addition (M) | 0.050 mol | – | – |
| بعد الإضافة (M) | ~0.00 mol | 0.60 mol | 0.70 mol |
يمكن بعد ذلك تحديد الرقم الهيدروجيني النهائي للمحلول عن طريق إدخال التركيزات المتغيرة لحمض الفورميك وفورمات الصوديوم في معادلة هندرسون-هاسلبالخ.
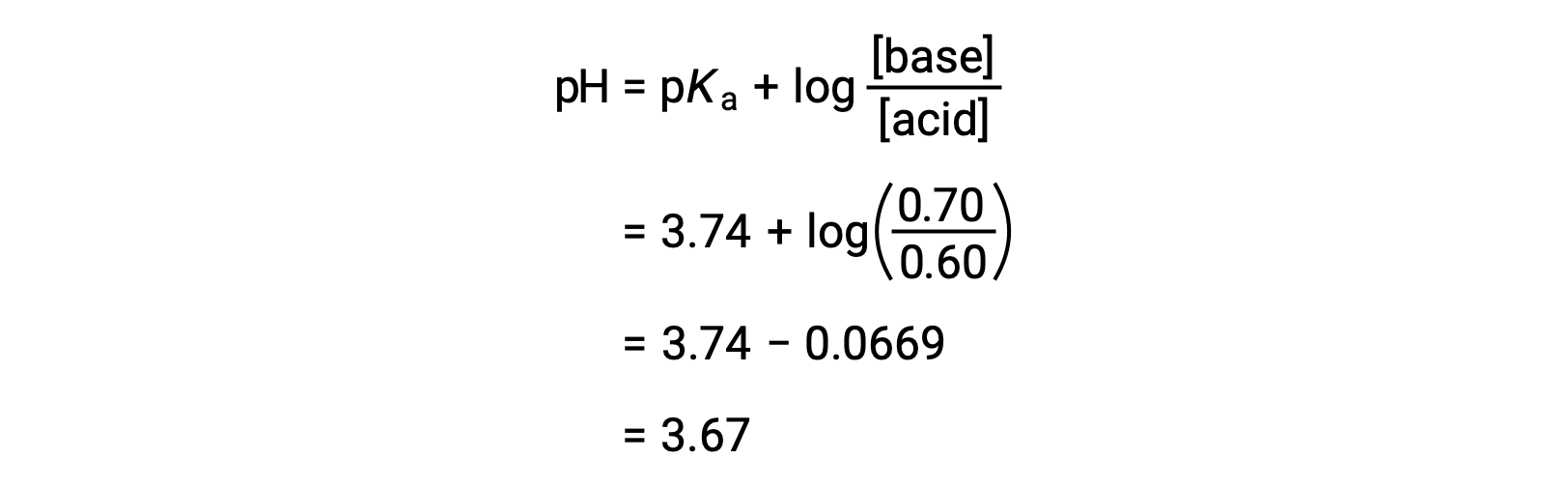
وبالتالي، فإن إضافة 0.05 مول من HNO3 يقلل الرقم الهيدروجيني للمحلول من 3.74 إلى 3.67.
وبالمثل، إذا تمت إضافة 0.10 مول من NaOH إلى نفس المحلول، فيمكن تحديد التغييرات الناتجة في تركيز حمض الفورميك وفورمات الصوديوم عن طريق الحسابات المتكافئة كما هو موضح في الجدول أدناه.
| OH− (aq) | HCOOH (aq) | HCOO− (aq) | H2O (l) | |
| Before addition (M) | ~0.00 mol | 0.65 mol | 0.65 mol | - |
| Addition (M) | 0.10 mol | – | – | - |
| After addition (M) | ~0.00 mol | 0.55 mol | 0.75 mol | - |
يمكن بعد ذلك تحديد الرقم الهيدروجيني النهائي للمحلول عن طريق إدخال التركيزات المتغيرة لحمض الفورميك وفورمات الصوديوم في معادلة هندرسون-هاسلبالخ.
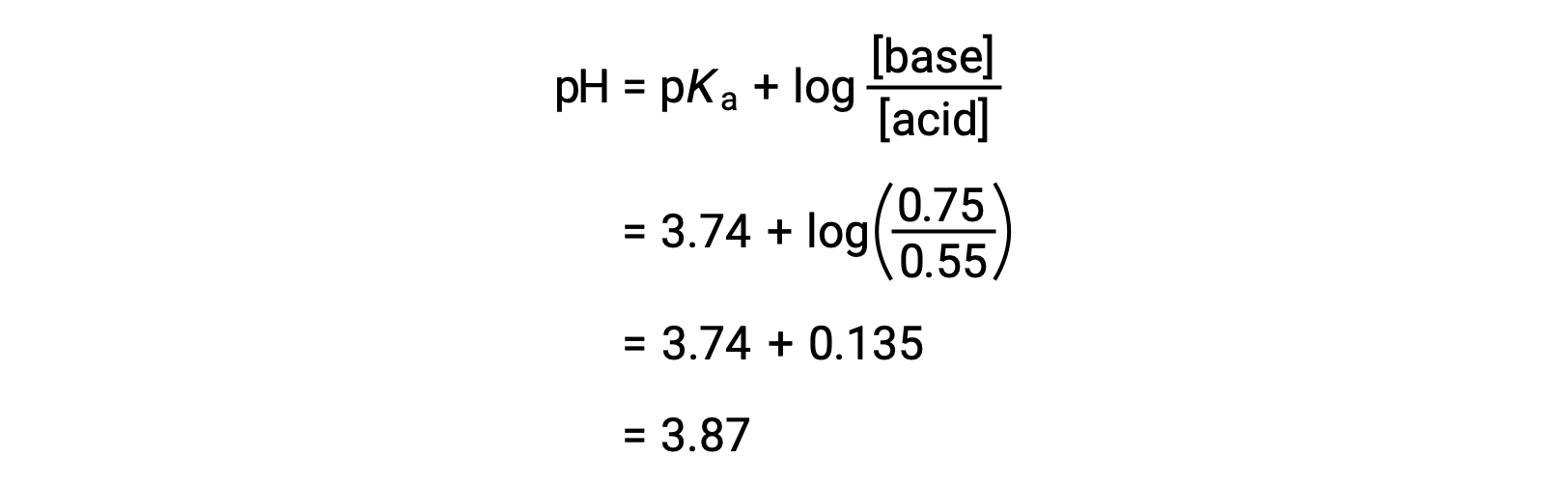
وبالتالي، فإن إضافة 0.10 مول هيدروكسيد الصوديوم تزيد الرقم الهيدروجيني للمحلول من 3.74 إلى 3.87.
