16.4:
Calculando los Cambios de pH en una Solución Amortiguadora
16.4:
Calculando los Cambios de pH en una Solución Amortiguadora
Un tampón puede evitar una caída repentina o un aumento en el pH de una solución después de la adición de un ácido o una base fuerte hasta su capacidad de amortiguación; sin embargo, la adición de un ácido o una base fuerte da lugar a un ligero cambio en el pH de la solución. El pequeño cambio de pH puede calcularse determinando el cambio resultante en la concentración de los componentes del tampón, es decir, un ácido débil y su base conjugada o viceversa. Las concentraciones obtenidas mediante estos cálculos estequiométricos pueden utilizarse para determinar el pH final de la solución mediante la ecuación de Henderson-Hasselbalch o una tabla ICE.
Por ejemplo, una solución tamponada contiene 0,65 mol de ácido fórmico y de formiato de sodio. Como aquí la concentración del ácido débil y su base conjugada es la misma, el pH de la solución es igual al pKa del ácido débil, que es 3,74 en este caso. Si se añaden 0,50 M de HNO3 a esta solución, los cambios resultantes en la concentración del ácido fórmico y del formiato de sodio pueden determinarse mediante cálculos estequiométricos, como se muestra en la siguiente tabla.
| H+ (ac) | HCOO− (ac) | HCOOH (ac) | |
| Antes de la adición (M) | ~0,00 mol | 0,65 mol | 0,65 mol |
| Adición (M) | 0,050 mol | – | – |
| Después de la adición (M) | ~0,00 mol | 0,60 mol | 0,70 mol |
El pH final de la solución puede determinarse introduciendo las concentraciones modificadas de ácido fórmico y de formiato de sodio en la ecuación de Henderson-Hasselbalch.
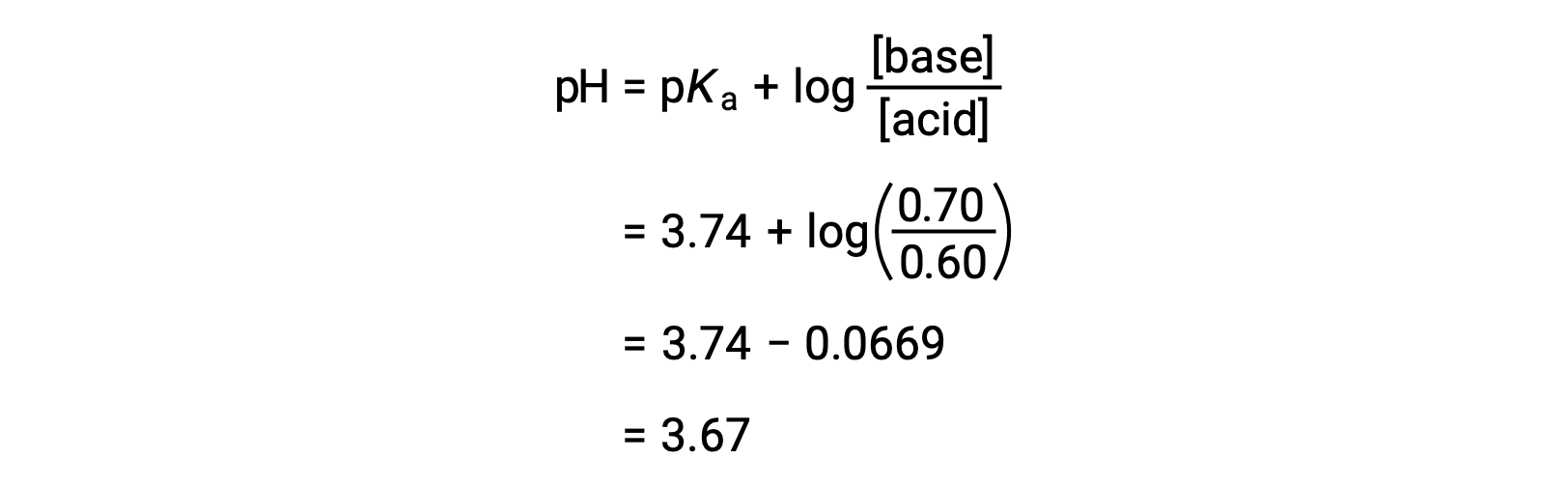
Así, la adición de 0,05 mol de HNO3 reduce el pH de la solución de 3,74 a 3,67.
Asimismo, si se añaden 0,10 mol de NaOH a la misma solución, los cambios resultantes en la concentración del ácido fórmico y del formiato de sodio pueden determinarse mediante cálculos estequiométricos, como se muestra en la tabla siguiente.
| OH− (ac) | HCOOH (ac) | HCOO− (ac) | H2Ol) | |
| Antes de la adición (M) | ~0,00 mol | 0,65 mol | 0,65 mol | - |
| Adición (M) | 0,10 mol | – | – | - |
| Después de la adición (M) | ~0,00 mol | 0,55 mol | 0,75 mol | - |
El pH final de la solución puede determinarse introduciendo las concentraciones cambiadas de ácido fórmico y de formiato de sodio en la ecuación de Henderson-Hasselbalch.
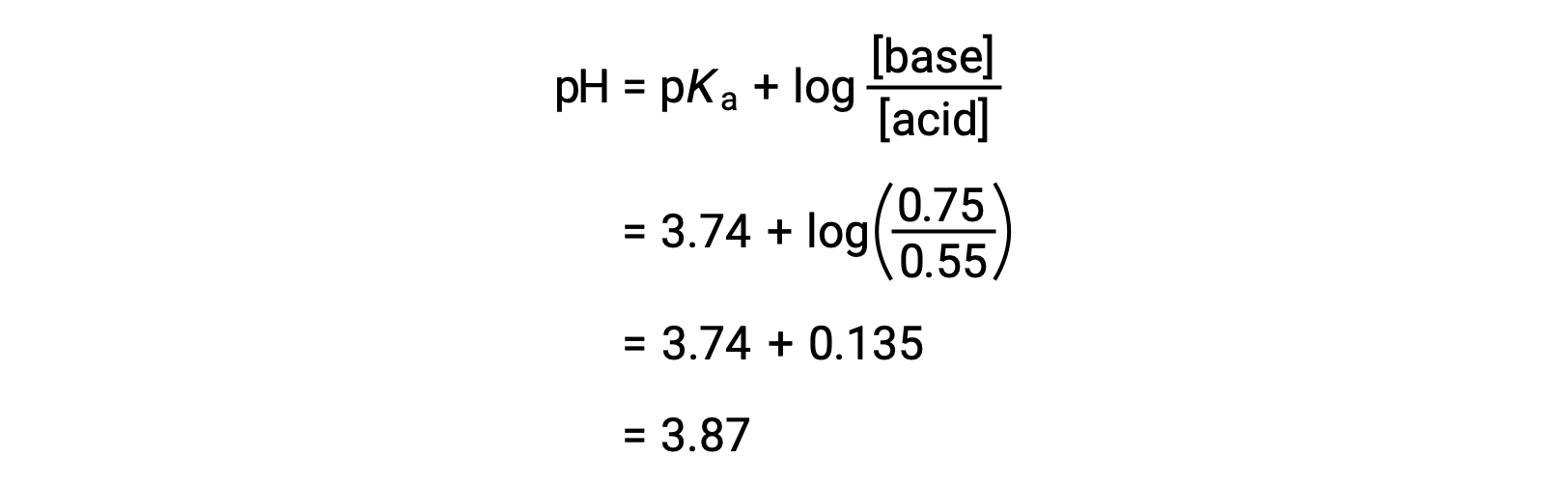
Así, la adición de 0,10 mol de NaOH aumenta el pH de la solución de 3,74 a 3,87.
