16.4:
緩衝液中のpHの変化の計算
A subscription to JoVE is required to view this content. Sign in or start your free trial.
JoVE Core
Chemistry
Calculating pH Changes in a Buffer Solution
A slight pH change occurs in a buffer solution upon the addition of a small amount of strong acid or the addition of a small amount of strong base. This pH change is calculated in two distinct steps. First, a stoichiometric calculation is used to determine the change in the concentrations. Then, an equilibrium calculation is used to determine the new pH of the solution, either using an ICE table or the Henderson-Hasselbalch equation. The pH of a buffer containing 2.0 M of both hydrofluoric acid and sodium fluoride can be calculated before and after adding a strong acid or base. The Henderson-Hasselbalch equation can be used to determine the initial pH of this buffer because the concentrations are high relative to the Ka of the weak acid, and the change in the concentrations is less than 5%. The pKa for hydrofluoric acid can be calculated to be 3.46. When the concentration of weak acid and conjugate base in a solution are equal, the pH is equal to the pKa. Therefore, the initial pH is 3.46. If 0.2 moles of hydrochloric acid is added to one liter of this buffer, with the assumption that it causes a negligible change in volume, the added acid is neutralized by the fluoride ions, producing hydrofluoric acid. This leads to a stoichiometric decrease in the concentration of fluoride ions by 0.2 moles and an equal increase in hydrofluoric acid concentration. The new concentrations can be inserted into the Henderson-Hasselbalch equation. When solved, the new pH is 3.37, less than the initial pH value of 3.46. As strong acid was added, there is a decrease in the pH, but the reduction is small because the solution is buffered. In contrast, if 0.1 moles of sodium hydroxide is added to one liter of the buffer, with the assumption that it causes a negligible change in volume, the added base is neutralized by reacting with hydrofluoric acid. This causes a stoichiometric decrease in hydrofluoric acid concentration by 0.1 moles and an equal increase in fluoride ion. Using the Henderson-Hasselbalch equation, the pH of the solution is 3.50, which is slightly higher than the initial pH value of 3.46 due to the addition of sodium hydroxide.
16.4:
緩衝液中のpHの変化の計算
緩衝剤は、その緩衝能まで強酸または強塩基を加えても溶液pHの急激な低下または上昇を防ぐことができます。しかしながら、そのような強酸または強塩基の添加は、溶液のわずかなpH変化をもたらします。このわずかなpH変化は、結果として生じる緩衝成分、すなわち弱酸とその共役塩基、またはその逆の濃度変化を求めることで算出できます。これらの化学量論的な計算で得られた濃度は、ヘンダーソン-ハッセルバルヒ式またはICE表を使用して、溶液’の最終的なpHを決定するために使用することができます。
例えば、0.65 molのギ酸とギ酸ナトリウムを含む緩衝液を考えます。ここでは弱酸とその共役塩基の濃度が同じなので、溶液のpHは弱酸のpKaに等しく、この場合は3.74となります。この溶液に0.05 molのHNO3を加えた際のギ酸およびギ酸ナトリウムの濃度変化は、化学量論的計算によって下表のように求められます。
| H+ (aq) | HCOO− (aq) | HCOOH (aq) | |
| 添加前 (M) | ~0.00 mol | 0.65 mol | 0.65 mol |
| 添加量 (M) | 0.050 mol | – | – |
| 添加後 (M) | ~0.00 mol | 0.60 mol | 0.70 mol |
その後、ヘンダーソン・ハッセルバルヒ式にギ酸とギ酸ナトリウムの新たな濃度を代入することで、溶液の最終的なpHを求めることができます。
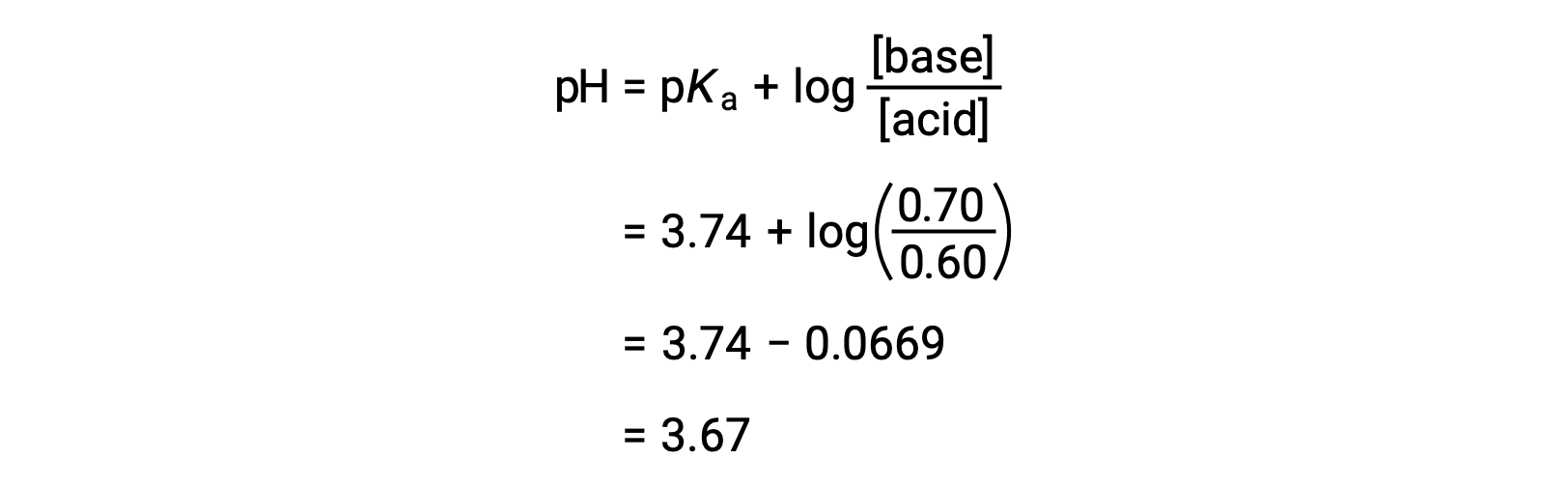
このように、0.05 molのHNO3 を加えることにより、溶液のpHは3.74から3.67に低下します。
同様に、同じ溶液に0.10 molのNaOHを加えた場合、ギ酸とギ酸ナトリウムの濃度の変化は、化学量論的計算によって下表のように求めることができます。
| OH− (aq) | HCOOH (aq) | HCOO− (aq) | H2O (l) | |
| 添加前 (M) | ~0.00 mol | 0.65 mol | 0.65 mol | - |
| 添加量 (M) | 0.10 mol | – | – | - |
| 添加後 (M) | ~0.00 mol | 0.55 mol | 0.75 mol | - |
その後、ヘンダーソン・ハッセルバルヒ式にギ酸とギ酸ナトリウムの新たな濃度を代入することで、溶液の最終的なpHを求めることができます。
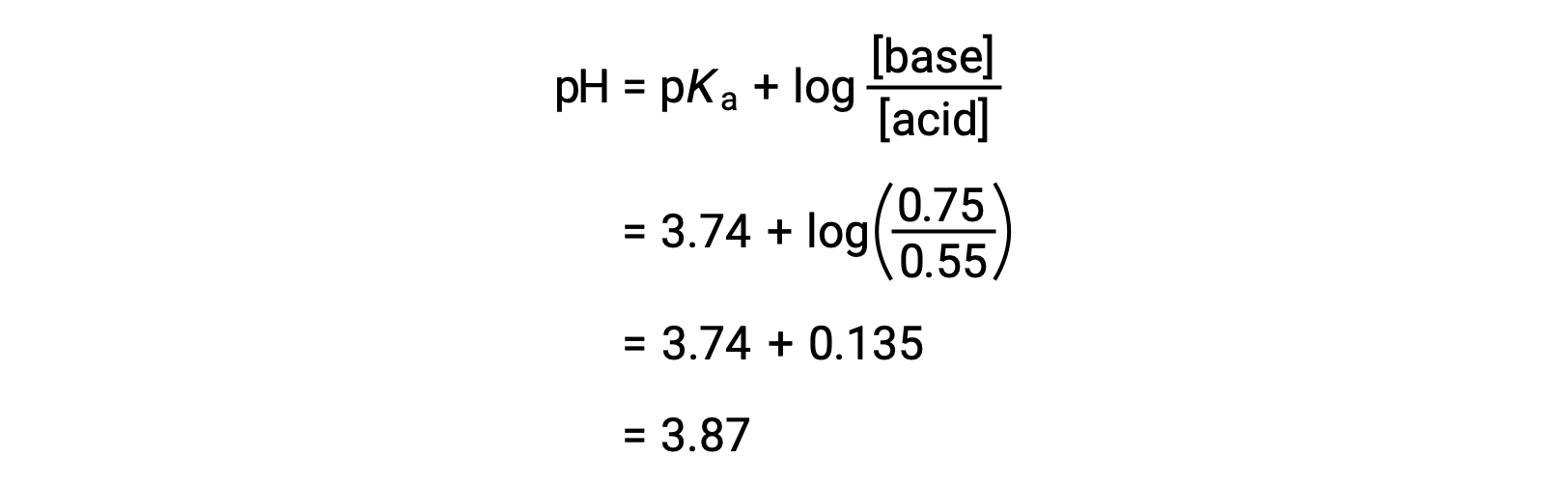
したがって、0.10 molのNaOHを加えると、溶液のpHは3.74から3.87に上昇します。
