16.12:
착이온의 형성
A subscription to JoVE is required to view this content. Sign in or start your free trial.
JoVE Core
Chemistry
Formation of Complex Ions
금속 이온은 항상 수용액에서 수분을 공급받습니다. 물 분자는 루이스 산처럼 작용하는 금속 이온과 유일한 한 개 전자를 공유하면서 루이스 염기로 작용합니다. 물보다 강한 루이스 염기가 첨가되면 이 염기는 물 분자를 대체하고 중심 금속 이온을 둘러싸 착이온을 형성합니다.루이스 염기처럼 작용하는 분자 또는 이온을 리간드라고 합니다. 염화 헥사민 코발트(III)에서 헥사민 코발트는 착이온이며 여기서 여섯 개의 암모니아 분자는 중심 코발트 이온을 8각으로 둘러싸는 리간드입니다. 전이 금속 이온은 높은 전하 밀도와 공유 전자를 수용하기 위한 빈 궤도를 가지기 때문에 특히 착이온을 쉽게 형성합니다.금속 이온과 리간드의 반응에 대한 평형 상수는 형성 상수, Kf라고 불립니다. Kf 값이 클수록 착이온은 더 안정적입니다. 이러한 착이온의 안정성이 형성되는 경우 용해도가 낮은 금속 염의 용해도가 증가하는 경우가 많습니다.수성 이온과 용해되지 않은 고체가 평형 상태에 있는 용액에 존재하는 황화은을 생각해 보십시오. 황화은을 시안화나트륨 용액에 첨가하면 은 이온은 시안화합물과 결합하여 착이온인 디시아노화합물을 형성합니다. 0.90 몰의 시안화나트륨 용액 1리터에 황화은 0.20 몰을 첨가하면 ICE 표로부터 은 이온의 평형 농도 x를 계산할 수 있습니다.은, 시안화물, 다이시아노화합물의 초기 농도는 각각 0.20 몰 0.90 몰, 0입니다. 시안화물은 Kf 값이 크고 농도가 은 이온에 비해 훨씬 높기 때문에 기본적으로 모든 은 이온은 다이시아노화합물로 변환됩니다. 하나의 수성 수은 이온은 2개의 시안화 이온과 반응하여 다이시아노화합물을 생성합니다.S따라서 시안화 이온에서 몰 농도의 변화는 2 곱하기 0.20 또는 0.40이 될 것입니다. 따라서 평형에서 디시아노화합물 이온의 농도는 초기 은의 농도와 동일하다고 가정할 수 있는 반면 시안화 이온 농도는 0.90 빼기 0.40 몰 또는 0.50 몰입니다. 이 값을 Kf의 식에 대입하여 0.2 몰을 x 곱하기 0.5 제곱으로 나눕니다.x에 대한 식을 풀면 그 결과 농도는 8.0 10⁻²² 몰이 됩니다. 은 이온의 평형 농도가 매우 작다는 것은 착이온의 형성에 의해 용액 속의 은 이온이 자유롭게 된다는 것을 나타냅니다. 이로부터 황화은 용해 평형이 이온 쪽으로 이동하여 더 많은 고체가 용해됩니다.
16.12:
착이온의 형성
루이스 산염 기저 화학의 유형은 중앙 원자, 전형적으로 리간드라는 이온 또는 분자에 의해 포위된 전이 금속 양이온을 포함하는 복잡한 이온(또는 조정 복합체)의 형성을 포함한다. 이러한 리간드 H2O 또는 NH3,또는 CN – 또는 OH-와 같은 이온과 같은 중성 분자가 될 수 있습니다. 종종 리간드는 루이스 기지역할을 하며, 한 쌍의 전자를 중앙 원자에 기증합니다. 이러한 유형의 루이스 산염-염기 반응은 조정 화학이라는 광범위한 하위 징계의 예입니다.이 텍스트의 다른 장의 주제입니다.
하나 이상의 리간드를 형성하는 금속 이온의 반응에 대한 평형상수는 형성상수(Kf)라고 불립니다(때로는 안정성 상수라고도 함). 예를 들어, 복잡한 이온 [Cu(CN)2]– 반응에 의해 생성된다
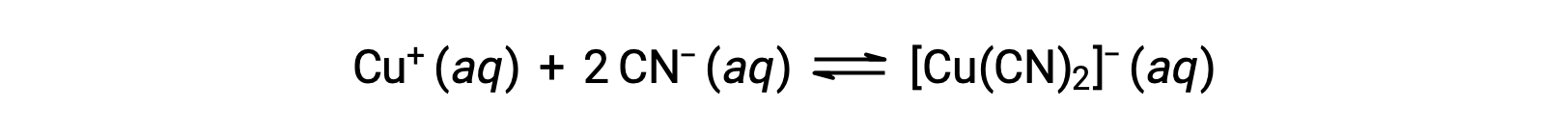
이 반응에 대한 형성 상수는
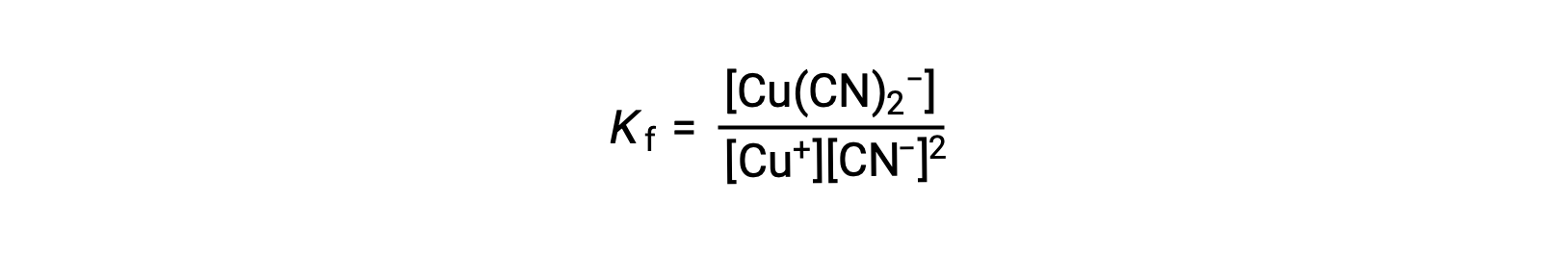
대안적으로, 역반응(복합이온의 분해)을 고려할 수 있으며, 이 경우 평형 상수는 해리상수(Kd)이다. 설명된 상호 반응에 대한 평형 상수 사이의 관계에 따라, 해리 상수는 형성 상수, Kd = Kf-1의수학적 역이다.
복잡한 이온 형성에 의한 용해의 예로, 수성 암모니아가 은 염화및 물의 혼합물에 첨가될 때 어떤 일이 일어나는지 생각해 본다. 은염화물은 물에 약간 용해, Ag+ ([Ag+] = 1.3 × 10-5 M의 작은 농도를 주는:
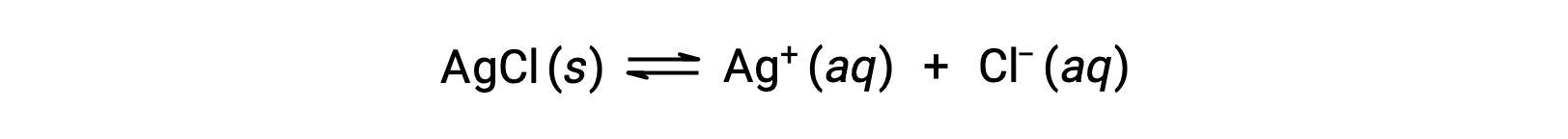
그러나,NH3가 물에 존재하는 경우, 복합 이온, [Ag(NH3)2]+,방정식에 따라 형성될 수 있다:
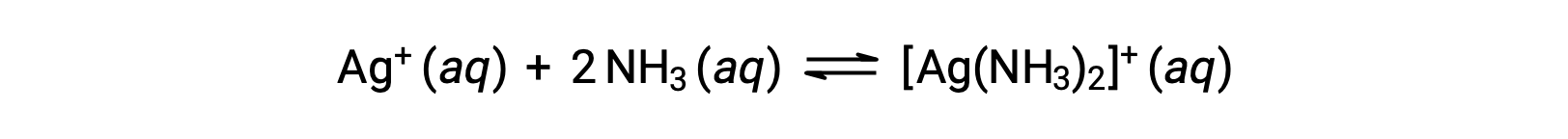
Suggested Reading
- Xie, Feng, and David B. Dreisinger. "Leaching of silver sulfide with ferricyanide–cyanide solution." Hydrometallurgy 88, no. 1-4 (2007): 98-108.
- Glueck, A. R. "Desalination by an ion exchange-precipitation-complex process." Desalination 4, no. 1 (1968): 32-37.
- Shakhashiri, Bassam Z., Glen E. Dirreen, and Fred Juergens. "Solubility and complex ion equilibria of silver (I) species in aqueous solution." Journal of Chemical Education 57, no. 11 (1980): 813.
