16.12:
Образование сложных ионов.
16.12:
Образование сложных ионов.
ТТип кислотно-основной химии Льюиса включает образование сложного иона (или координационного комплекса), содержащего центральный атом, обычно катион переходного металла, окруженный ионами или молекулами, называемыми лигандами. Эти лиганды могут быть нейтральными молекулами, такими как H2О или NH3, или ионами, такими как CN− или OH−. Часто лиганды действуют как основания Льюиса, жертвуя пару электронов центральному атому. Эти типы кислотно-основных реакций Льюиса являются примерами широкой субдисциплины, называемой координационной химией — которая является темой другой главы в этом тексте.
Константа равновесия для реакции иона металла с одной или несколькими лигандами на формирование координационного комплекса называется константой образования (KF) (иногда называется константой стабильности). Например, в результате реакции образуется сложный ион [Cu(CN)2]
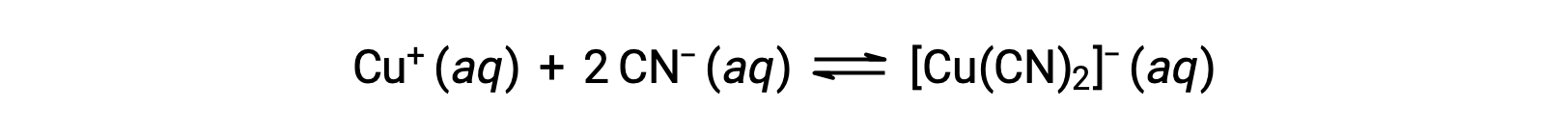
Константа образования для этой реакции составляет
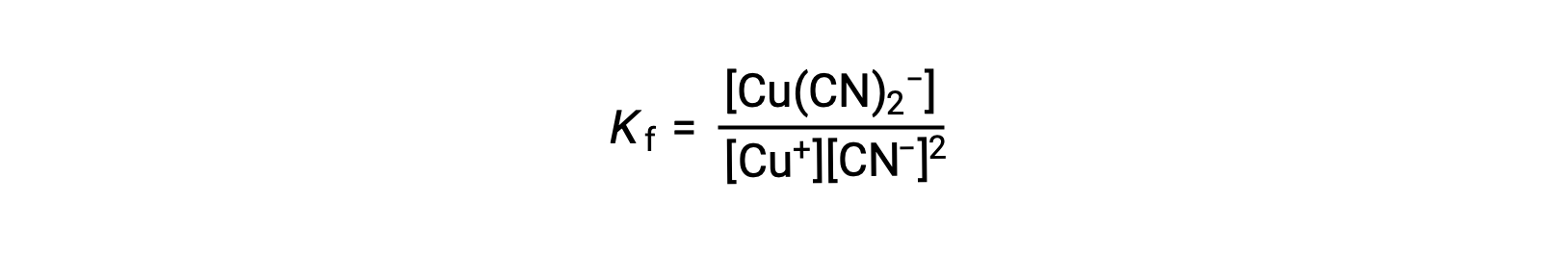
В качестве альтернативы можно рассмотреть обратную реакцию (разложение комплексного иона), в этом случае константа равновесия является константой диссоциации (КД). В соответствии с отношением между константами равновесия для описанных ответных реакций константа диссоциации является математическим инвертом константы образования, KD = KF-1.
В качестве примера растворения при сложном образовании ионов рассмотрим, что происходит, когда водный аммиак добавляется в смесь хлорида серебра и воды. Хлорид серебра немного растворяется в воде, что дает небольшую концентрацию AG+ ([AG+] = 1.3 × 10-5 M):
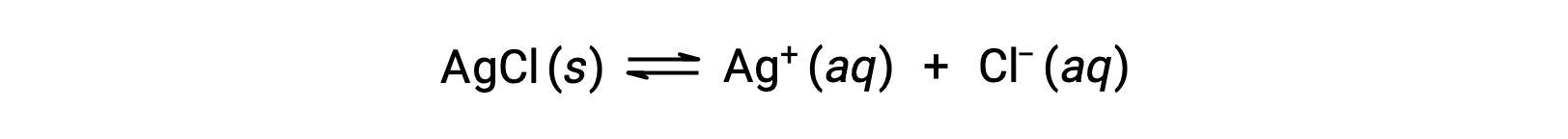
Однако, если в воде присутствует NH3, комплексный ион [AG(NH3)2]+ может образоваться в соответствии с уравнением:
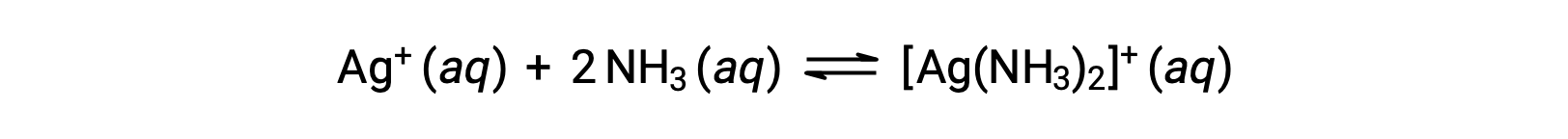
Этот текст адаптирован из Openstax, Химия 2е изд., раздел 15.2: Кислоты и основания Льюиса.
Suggested Reading
- Xie, Feng, and David B. Dreisinger. "Leaching of silver sulfide with ferricyanide–cyanide solution." Hydrometallurgy 88, no. 1-4 (2007): 98-108.
- Glueck, A. R. "Desalination by an ion exchange-precipitation-complex process." Desalination 4, no. 1 (1968): 32-37.
- Shakhashiri, Bassam Z., Glen E. Dirreen, and Fred Juergens. "Solubility and complex ion equilibria of silver (I) species in aqueous solution." Journal of Chemical Education 57, no. 11 (1980): 813.
