16.12:
Formación de Iones Complejos
16.12:
Formación de Iones Complejos
Un tipo de química ácido-base de Lewis implica la formación de un ion complejo (o un complejo de coordinación) que comprende un átomo central, típicamente un catión de metal de transición, rodeado de iones o moléculas llamadas ligandos. Estos ligandos pueden ser moléculas neutras como el H2O o el NH3, o iones como el CN− o el OH−. A menudo, los ligandos actúan como bases de Lewis, donando un par de electrones al átomo central. Este tipo de reacciones ácido-base de Lewis son ejemplos de una amplia subdisciplina llamada química de coordinación—el tema de otro capítulo en este texto.
La constante de equilibrio para la reacción de un ion metálico con uno o más ligandos para formar un complejo de coordinación se denomina constante de formación (Kf) (a veces llamada constante de estabilidad). Por ejemplo, el ion complejo [Cu(CN)2]− es producido por la reacción
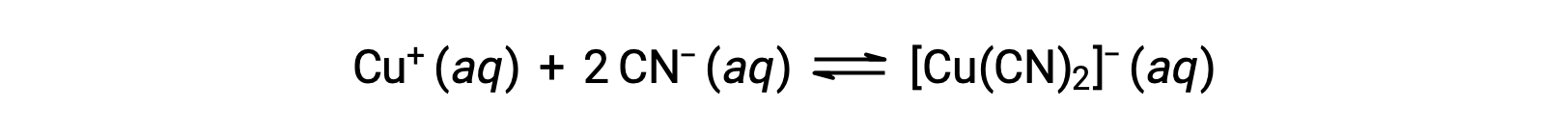
La constante de formación para esta reacción es
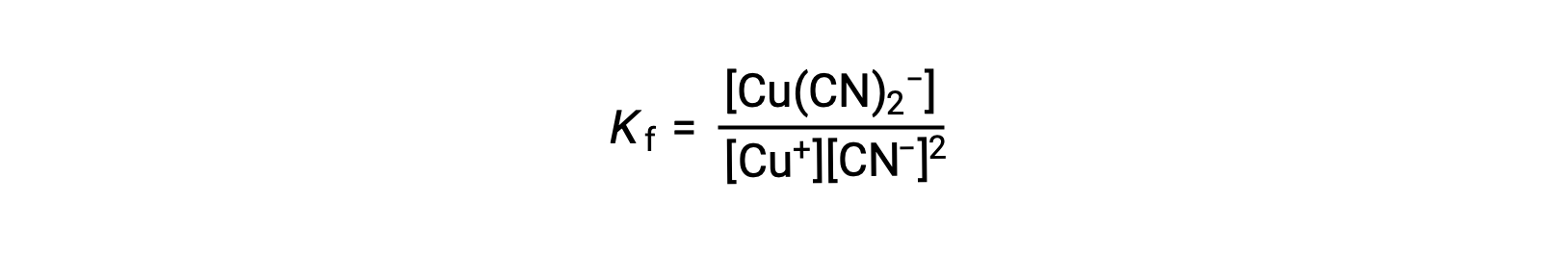
Alternativamente, se puede considerar la reacción inversa (descomposición del ion complejo), en cuyo caso la constante de equilibrio es una constante de disociación (Kd). Según la relación entre las constantes de equilibrio para las reacciones recíprocas descritas, la constante de disociación es la inversa matemática de la constante de formación, Kd = Kf−1.
Como ejemplo de disolución mediante formación de iones complejos, considere lo que sucede cuando se agrega amoníaco acuoso a una mezcla de cloruro de plata y agua. El cloruro de plata se disuelve ligeramente en agua, dando una pequeña concentración de Ag+ ([Ag+] = 1,3 × 10−5 M):
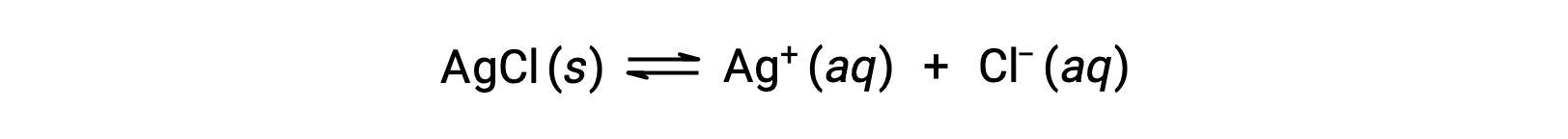
Sin embargo, si NH3 está presente en el agua, el ion complejo, [Ag(NH3)2]+, puede formarse de acuerdo con la ecuación:
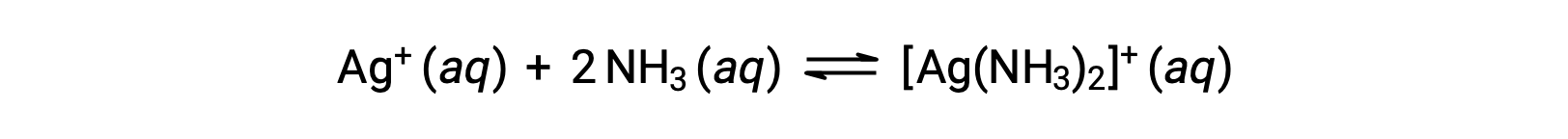
Este texto es adaptado de Openstax, Química 2e, Sección 15.2: Ácidos y bases de Lewis.
Suggested Reading
- Xie, Feng, and David B. Dreisinger. "Leaching of silver sulfide with ferricyanide–cyanide solution." Hydrometallurgy 88, no. 1-4 (2007): 98-108.
- Glueck, A. R. "Desalination by an ion exchange-precipitation-complex process." Desalination 4, no. 1 (1968): 32-37.
- Shakhashiri, Bassam Z., Glen E. Dirreen, and Fred Juergens. "Solubility and complex ion equilibria of silver (I) species in aqueous solution." Journal of Chemical Education 57, no. 11 (1980): 813.
