16.13:
ترسيب الأيونات
16.13:
ترسيب الأيونات
توقع هطول الأمطار
المعادلة التي تصف التوازن بين كربونات الكالسيوم الصلبة وأيوناتها المنحلة هي:
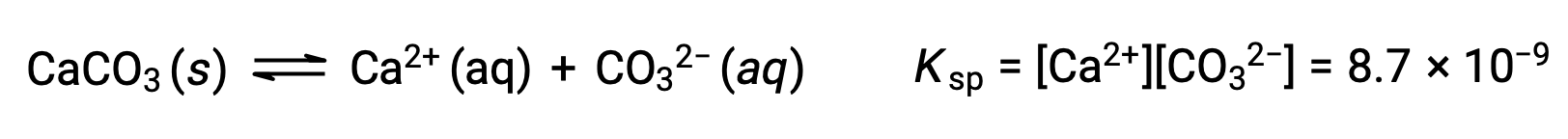
من المهم أن ندرك أن هذا التوازن يتم إنشاؤه في أي محلول مائي يحتوي على أيونات Ca2+ and CO32–، ليس فقط في محلول يتكون من تشبع الماء بكربونات الكالسيوم. ضع في اعتبارك، على سبيل المثال، خلط المحاليل المائية للمركبات القابلة للذوبان كربونات الصوديوم ونترات الكالسيوم. إذا كانت تركيزات أيونات الكالسيوم والكربونات في الخليط لا تنتج حاصل قسمة تفاعل، Q، الذي يتجاوز منتج الذوبان، Ksp، فإذاً لن يحدث ترسيب. إذا أسفرت تركيزات الأيونات عن ناتج تفاعل أكبر من منتج الذوبان، فسيحدث الترسيب، مما يؤدي إلى خفض تلك التركيزات حتى يتحقق التوازن (Q = Ksp). تعد مقارنة Q بـ Ksp للتنبؤ بالترسيب مثالاً على النهج العام لتوقع اتجاه التفاعل. بالنسبة للحالة المحددة لتوازن الذوبان:
Q < Ksp: يستمر التفاعل في الاتجاه الأمامي (المحلول ليس مشبعًا ، لم يحدث ترسيب)
Q > Ksp: يستمر التفاعل في الاتجاه العكسي (المحلول مفرط التشبع؛ سيحدث الترسيب)
في المحاليل التي تحتوي على اثنين أو أكثر من الأيونات التي قد تشكل مركبات غير قابلة للذوبان لها نفس الأيون المضاد، يمكن استخدام استراتيجية تجريبية تسمى الترسيب الانتقائي لإزالة أيونات مفردة من المحلول. عن طريق زيادة تركيز الأيونات المضادة بطريقة مضبوطة، قد تترسب الأيونات في المحلول بشكل فردي، بافتراض أن قابلية ذوبانها المركبة مختلفة بشكل كافٍ. في المحاليل ذات التركيزات المتساوية من الأيونات المستهدفة، فإن الأيون الذي يشكل أقل مركب قابل للذوبان سوف يترسب أولاً (عند أدنى تركيز للأيون المضاد) . تترسب الأيونات الأخرى لاحقًا عند الوصول إلى ذوبان’ مركبها.
ترسيب هاليدات الفضة
يحتوي المحلول على 0.00010 مول من KBr و 0.10 مول من KCl لكل لتر. AgNO3 يضاف تدريجياً إلى هذا المحلول. ما هي الأشكال الأولى، AgBr الصلب أم AgCl الصلب؟
التوازنان المتضمنان هما:
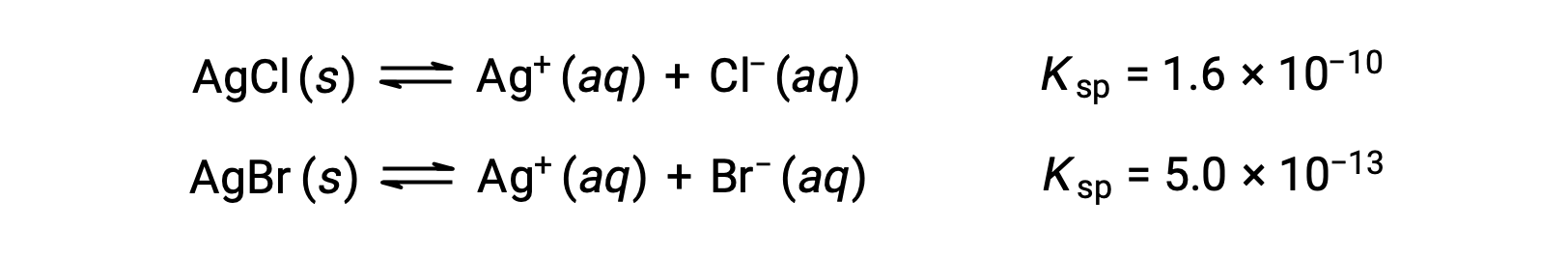
إذا احتوى المحلول على تركيزات متساوية من Cl– و Br–، فإن الملح الفضي الذي يحتوي على أصغر Ksp (AgBr) سيترسب أولاً. لكن التركيزات غير متساوية، لذلك يجب حساب [Ag+] الذي يبدأ عنده AgCl في الترسب وحساب [Ag+] الذي يبدأ عنده AgBr في الترسي. الملح الذي يتكون في المستوى الأقل لـ [Ag+] يترسب أولاً.
يترسب AgBr عندما Q = Ksp لـ AgBr
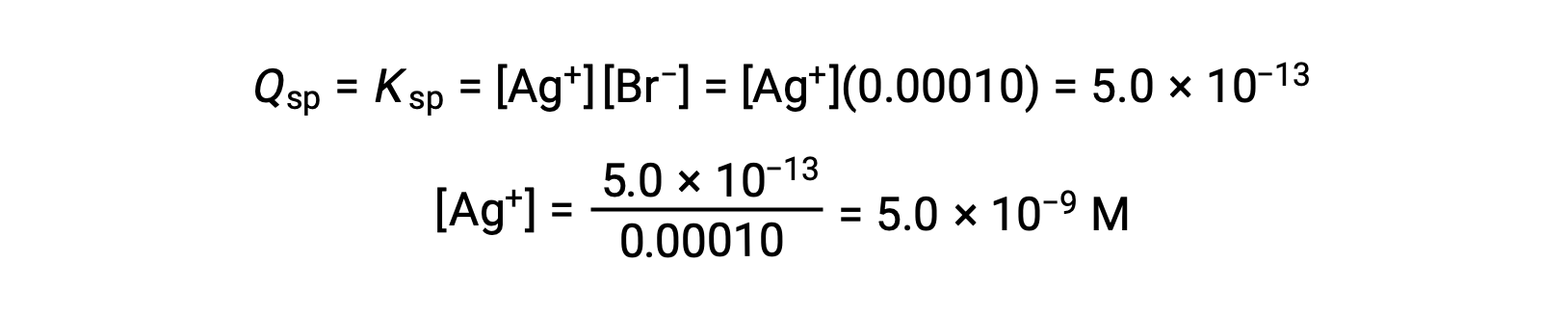
يبدأ AgBr في الترسب عندما يكون [Ag+] 5.0 × 10−9 M.
بالنسبة إلى AgCl:
يترسب AgCl عندما Q يساوي Ksp لـ AgCl (1.6 × 10-10). عندما [Cl–] = 0.10 M:
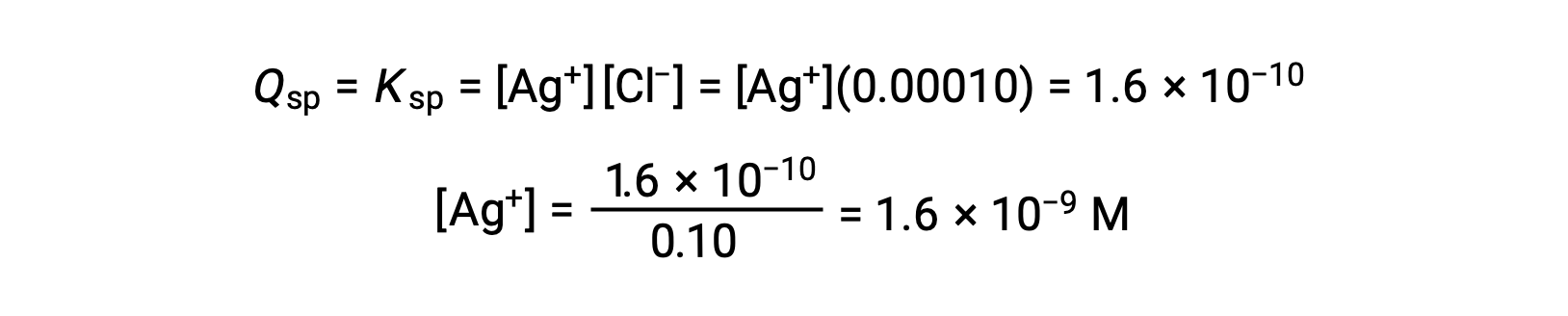
يبدأ AgCl في الترسب عندما يكون [Ag+] هو 1.6 × 10-9 M.
يبدأ AgCl في الترسيب عندما يكون[Ag+] أقل من AgBr، لذلك يبدأ AgCl في الترسب أولاً. لاحظ أن تركيز أيون الكلوريد للخليط الأولي كان أكبر بكثير من تركيز أيون البروميد، ولذا ترسب كلوريد الفضة أولاً على الرغم من احتوائه على Ksp أكبر من تلك الموجودة في بروميد الفضة.
هذا النص مقتبس من Openstax, Chemistry 2e, Chapter 15.1: Precipitation and Dissolution.
Suggested Reading
- Firsching, Ferdinand Henry. "Selective precipitation of silver halides from homogeneous solution. Separation of iodide, bromide, and chloride using volatilization of ammonia." Analytical Chemistry 32, no. 13 (1960): 1876-1878.
- Reynolds, John P. "Ksp experiment: The solubility product for barium hydroxide." Journal of Chemical Education 52, no. 8 (1975): 521.
- Hou, Miaolin, and George L. Baughman. "Predicting the precipitation of acid and direct dyes in natural waters." Dyes and pigments 18, no. 1 (1992): 35-46.
