16.13:
Précipitation d'ions
16.13:
Précipitation d'ions
Prévision de la précipitation
L’équation qui décrit l’équilibre entre le carbonate de calcium solide et ses ions solvatés est la suivante :
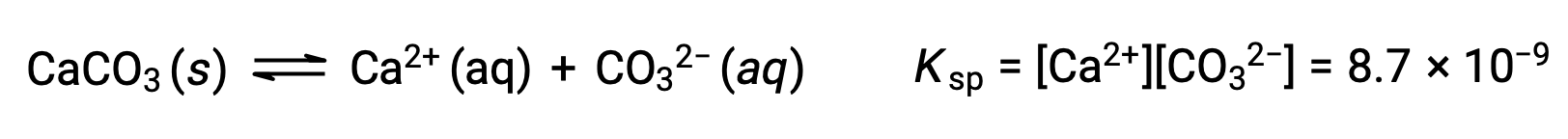
Il est important de se rendre compte que cet équilibre est établi dans toute solution aqueuse contenant des ions Ca2+ et CO32–, et pas seulement dans une solution formée en saturant de l’eau avec du carbonate de calcium. Prenons, par exemple, le mélange de solutions aqueuses des composés solubles carbonate de sodium et nitrate de calcium. Si les concentrations en ions calcium et carbonate dans le mélange ne donnent pas un quotient réactionnel, Q, qui dépasse le produit de solubilité, Kps, alors aucune précipitation ne se produira. Si les concentrations ioniques produisent un quotient réactionnel supérieur au produit de solubilité, une précipitation se produira, ce qui va abaisser ces concentrations jusqu’à que l’équilibre soit établi (Q = Kps). La comparaison entre Q et Kps afin de prédire la précipitation est un exemple de l’approche générale pour prévoir le sens d’une réaction. Dans le cas précis des équilibres de solubilité :
Q < Kps : la réaction se poursuit dans le sens direct (la solution n’est pas saturée ; aucune précipitation n’est observée)
Q > Kps : la réaction se poursuit dans le sens inverse (la solution est sursaturée ; une précipitation se produit)
Dans les solutions contenant deux ions ou plus pouvant former des composés insolubles avec le même contre-ion, une stratégie expérimentale appelée la précipitation sélective peut être utilisée pour éliminer des ions individuels de la solution. En augmentant la concentration des contre-ions de manière contrôlée, on peut faire précipiter les ions en solution individuellement, en supposant que les solubilités de leur composé soient suffisamment différentes. Dans les solutions ayant des concentrations d’ions cibles égales, l’ion formant le composé le moins soluble précipitera d’abord (à la concentration la plus faible du contre-ion). Les autres ions précipitent ensuite lorsque les solubilités de leur composé sont atteintes.
Précipitation des halogénures d’argent
Une solution contient 0,00010 mol de KBr et 0,10 mol de KCl par litre. AgNO3 est ajouté progressivement à cette solution. Lequel se forme en premier, AgBr solide ou AgCl solide ?
Les deux équilibres impliqués sont :
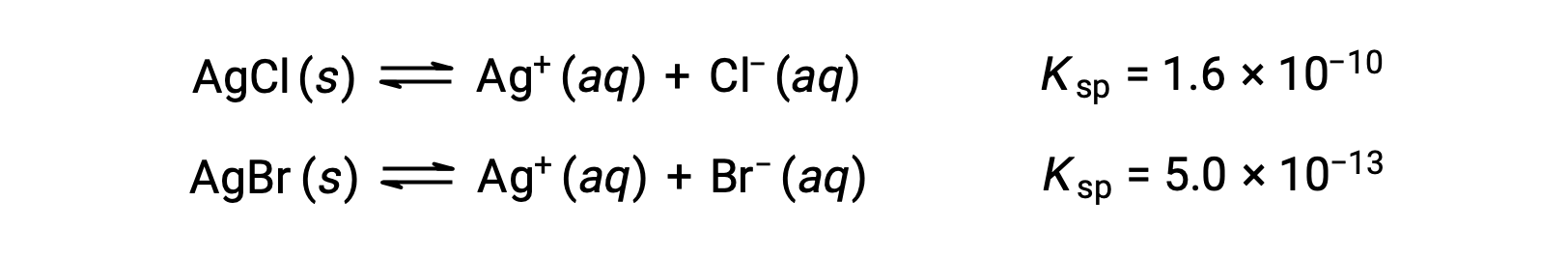
Si la solution contenait des concentrations environ égales de Cl– et Br–, le sel d’argent ayant le plus petit Kps (AgBr) précipiterait d’abord. Toutefois, les concentrations ne sont pas égales, il faut donc calculer [Ag+] à laquelle AgCl commence à précipiter et [Ag+] à laquelle AgBr commence à précipiter. Le sel qui se forme à la plus basse [Ag+] précipite en premier.
AgBr précipite lorsque Q = Kps d’AgBr
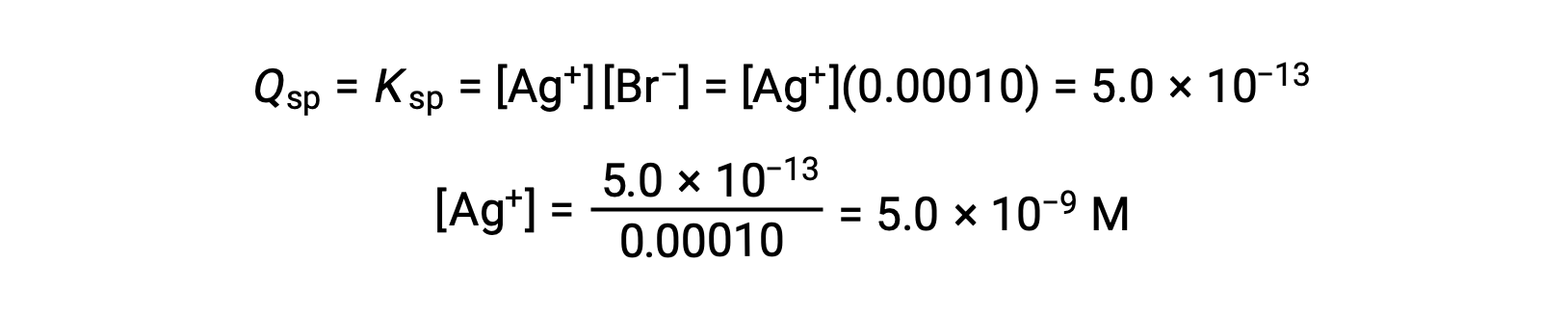
AgBr commence à précipiter lorsque [Ag+] est de 5,0 × 10−9 M.
Pour AgCl :
AgCl précipite lorsque Q est égal au Kps d’AgCl (1,6 × 10-10). Lorsque [Cl–] = 0,10 M :
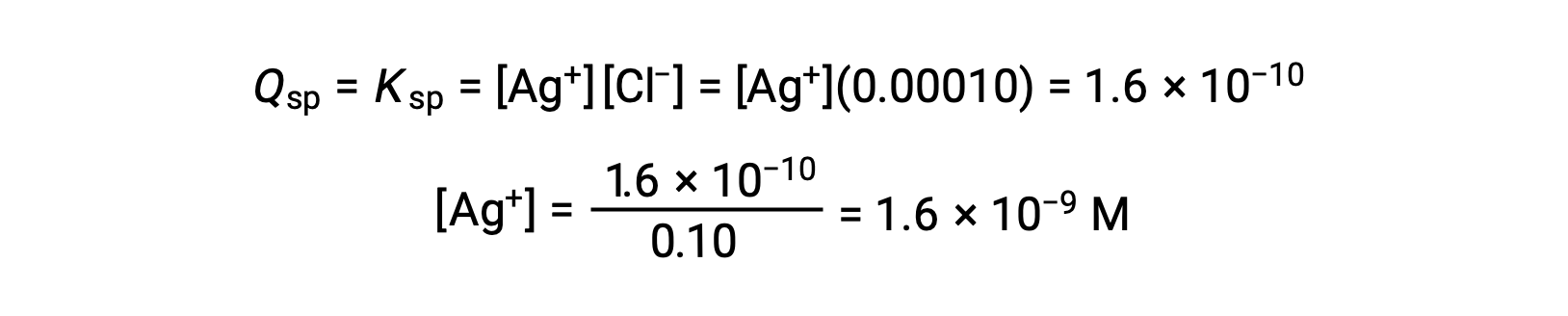
AgCl commence à précipiter lorsque [Ag+] est de 1,6 × 10-9 M.
AgCl commence à précipiter à une [Ag+] plus basse que AgBr, de sorte que AgCl commence à précipiter en premier. On remarque que la concentration en ions chlorure du mélange initial était significativement plus élevée que la concentration en ions bromure, et le chlorure d’argent a donc précipité en premier malgré un Kps supérieur à celui du bromure d’argent.
Ce texte est adapté de Openstax, Chimie 2e, Chapitre 15.1: Précipitation et dissolution.
Suggested Reading
- Firsching, Ferdinand Henry. "Selective precipitation of silver halides from homogeneous solution. Separation of iodide, bromide, and chloride using volatilization of ammonia." Analytical Chemistry 32, no. 13 (1960): 1876-1878.
- Reynolds, John P. "Ksp experiment: The solubility product for barium hydroxide." Journal of Chemical Education 52, no. 8 (1975): 521.
- Hou, Miaolin, and George L. Baughman. "Predicting the precipitation of acid and direct dyes in natural waters." Dyes and pigments 18, no. 1 (1992): 35-46.
