16.13:
离子沉淀
16.13:
离子沉淀
预测沉淀
描述固体碳酸钙及其溶剂化离子之间平衡的方程是:
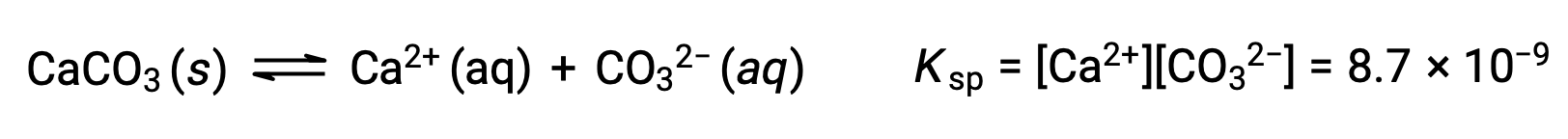
重要的是要认识到,这种平衡是在任何含有 Ca2+ 和 CO32 离子的水溶液中建立的,而不仅仅是在用碳酸钙饱和水形成的溶液中。 例如,考虑混合碳酸钠和硝酸钙的可溶化合物水溶液。 如果混合物中的钙离子和碳酸盐离子浓度未产率 a 反应商, Q ,超过溶度积, KSP ,则不会发生沉淀。 如果离子浓度产率 a 反应商大于 the 溶度积 (离子浓度值为 A) ,则将发生沉淀,降低这些浓度直到建立平衡 (Q = KSP)。 将 Q 与 KSP 进行比较以预测沉淀是预测反应方向的一般方法的一个示例。 对于溶解度平衡的特定情况:
Q < KSP :反应沿前进方向进行 (溶液未饱和;未观察到沉淀)
Q > KSP :反向反应 (溶液已过饱和;将发生沉淀)
在含有两个或更多离子的溶液中,可能会形成具有相同反离子的不溶化合物,可使用称为选择性沉淀的实验策略从溶液中去除单个离子。 通过以受控方式增加反离子浓度,溶液中的离子可能会被单独沉淀,前提是其化合物溶解性完全不同。 在靶离子浓度相等的溶液中,形成最不溶解化合物的离子首先会沉淀 (在反离子的最低浓度下)。 其他离子随后随着其化合物的溶解度而沉淀。
银色卤素沉淀
a 溶液每升含 0.00010 毫升 KBr 和 0.10 毫升 KCl。 AgNO3 逐渐添加到此溶液中。 哪些先打印纸,实心琼脂或实心琼脂?
涉及的两个平衡是:
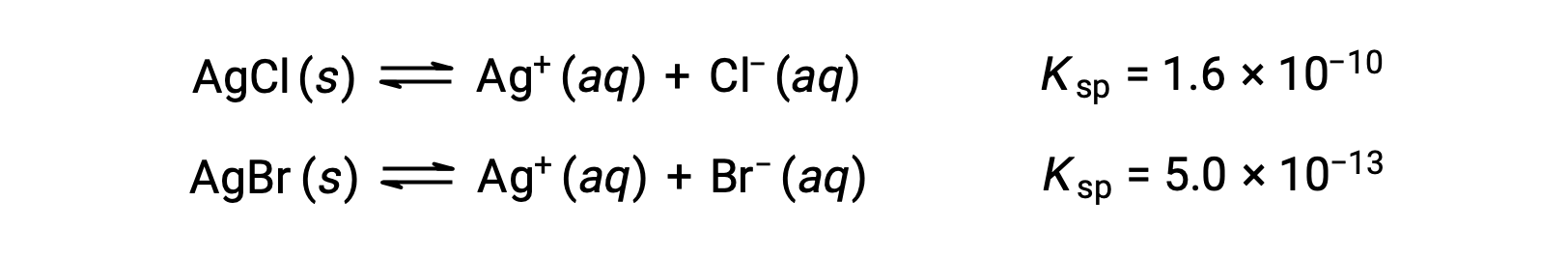
如果溶液含有大约相等浓度的氯化萘和溴化萘,则使用较小的氯化萘 (琼脂) 的银盐首先会沉淀。 但是,浓度不相等,因此必须计算琼脂开始沉淀的 [Ag+] 和琼脂开始沉淀的 [Ag+]。 下部 [A++] 形成的盐首先沉淀。
当 Q = KSP 时, AgBr 会加速 AgBr
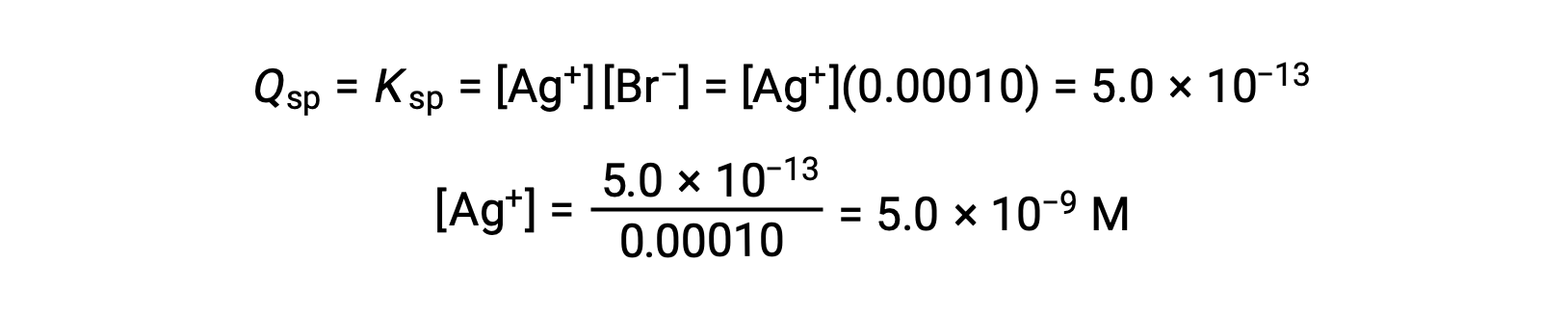
当 [Ag+] 为 5.0 × 10−9 M 时, AgBr 开始加速
对于 AgCl :
当 Q 等于 KSP 时, AGCL 会在 AgCl (1.6 × 10-10) 下沉淀。 当 [CL – ] = 0.10 M 时:
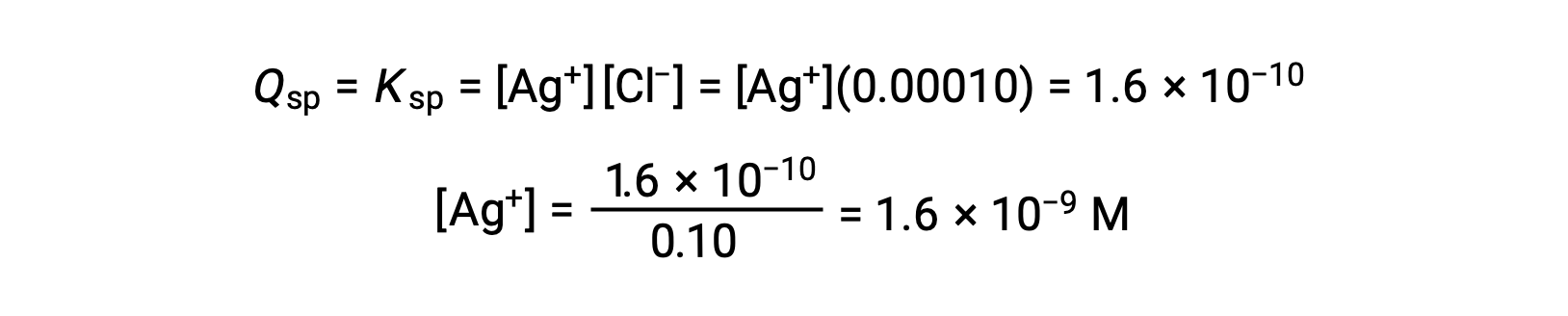
当 [Ag+] 为 1.6 × 10-9 M 时, AGCL 开始加速
AGCL 开始在低于 AgBr 的 [A++] 处沉淀,因此 AgCl 首先开始沉淀。 注意:初始混合物的氯化离子浓度明显是大于 the b溴 化离子浓度,因此,尽管有一个氯化银大于,但氯化银首先沉淀。
Suggested Reading
- Firsching, Ferdinand Henry. "Selective precipitation of silver halides from homogeneous solution. Separation of iodide, bromide, and chloride using volatilization of ammonia." Analytical Chemistry 32, no. 13 (1960): 1876-1878.
- Reynolds, John P. "Ksp experiment: The solubility product for barium hydroxide." Journal of Chemical Education 52, no. 8 (1975): 521.
- Hou, Miaolin, and George L. Baughman. "Predicting the precipitation of acid and direct dyes in natural waters." Dyes and pigments 18, no. 1 (1992): 35-46.
