16.13:
Precipitazione di ioni
16.13:
Precipitazione di ioni
Previsione delle precipitazioni
L’equazione che descrive l’equilibrio tra carbonato di calcio solido e i suoi ioni solvati è:
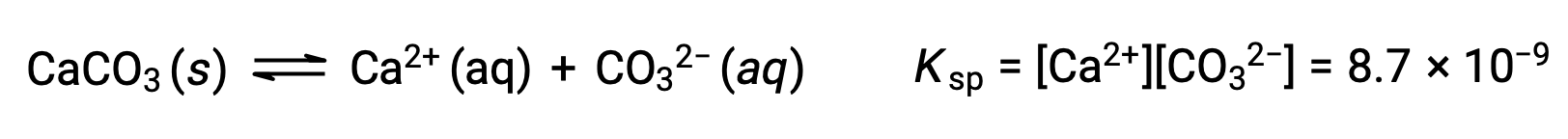
È importante rendersi conto che questo equilibrio è stabilito in qualsiasi soluzione acquosa contenente ioni Ca2+ e CO32, non solo in una soluzione formata da acqua saturante con carbonato di calcio. Si consideri, ad esempio, la miscelazione di soluzioni acquose dei composti solubili carbonato di sodio e nitrato di calcio. Se le concentrazioni di ioni calcio e carbonato nella miscela non producono un quoziente di reazione, Q, che supera il prodotto di solubilità, Ksp, non si verificherà alcuna precipitazione. Se le concentrazioni di ioni producono un quoziente di reazione maggiore del prodotto di solubilità, si verificherà una precipitazione, abbassando tali concentrazioni fino a quando non viene stabilitol’equilibrio ( Q = Ksp). Il confronto tra Q e Ksp per prevedere le precipitazioni è un esempio dell’approccio generale alla previsione della direzione di una reazione. Per il caso specifico degli equilibri di solubilità:
Q < Ksp: la reazione procede nella direzione in avanti (la soluzione non è satura; nessuna precipitazione osservata)
Q > Ksp: la reazione procede nella direzione inversa (la soluzione è supersatura; si verificherà la precipitazione)
In soluzioni contenenti due o più ioni che possono formare composti insolubili con lo stesso contatore, una strategia sperimentale chiamata precipitazione selettiva può essere utilizzata per rimuovere singoli ioni dalla soluzione. Aumentando la concentrazione di contro ioni in modo controllato, gli ioni in soluzione possono essere precipitati individualmente, supponendo che le loro solubilità composte siano adeguatamente diverse. In soluzioni con concentrazioni uguali di ioni bersaglio, lo ione che forma il composto meno solubile precipiterà per primo (alla più bassa concentrazione di controione). Gli altri ioni precipitano successivamente man mano che si raggiunge la solubilità del loro composto.
Precipitazione di alogenuri d’argento
Una soluzione contiene 0,00010 mol di KBr e 0,10 mol di KCl per litro. AgNO3 viene gradualmente aggiunto a questa soluzione. Quali forme per prime, AgBr solido o AgCl solido?
I due equilibri in questione sono:
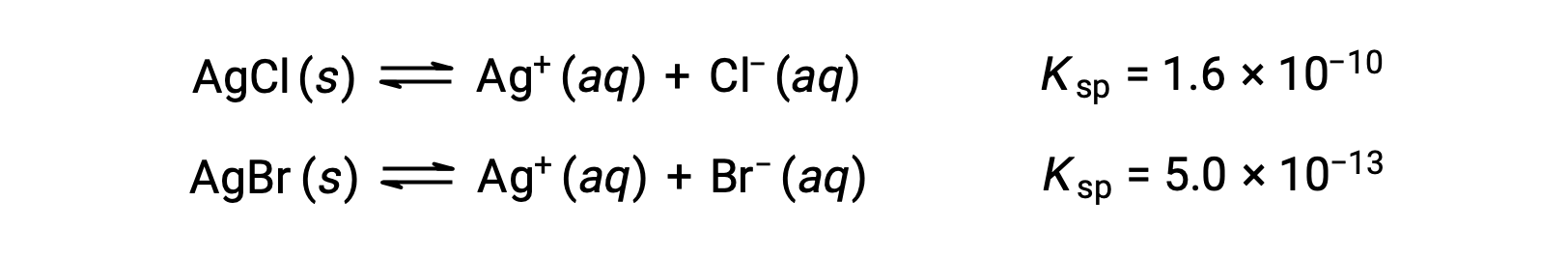
Se la soluzione conteneva circa concentrazioni uguali di Cl– e Br–, allora il sale d’argento con il Ksp piùpiccolo (AgBr) precipiterebbe per primo. Le concentrazioni non sono uguali, tuttavia, quindi deve essere calcolatol'[Ag +] in cui l’AgCl inizia a precipitare e [Ag+] in cui l’AgBr inizia a precipitare. Il sale che si forma in basso [Ag+] precipita per primo.
AgBr precipita quando Q = Ksp per AgBr
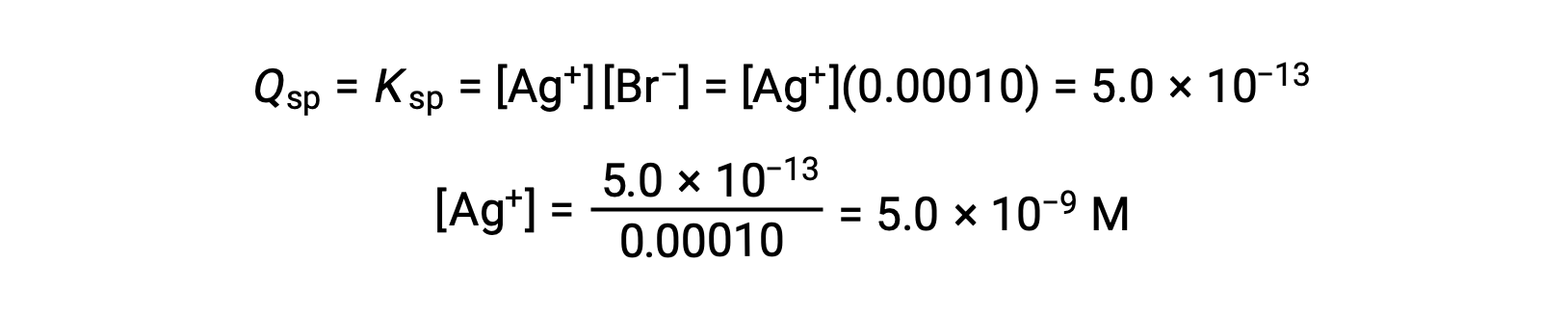
AgBr inizia a precipitare quando [Ag+] è 5,0 × 10−9 M.
Per AgCl:
AgCl precipita quando Q è uguale a Ksp per AgCl (1,6 × 10-10). Quando [Cl–] = 0,10 M:
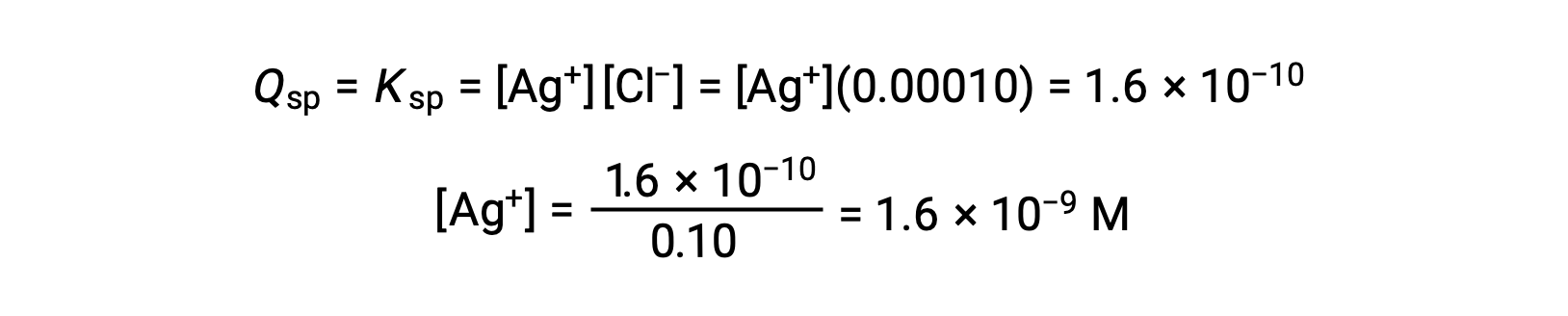
AgCl inizia a precipitare quando [Ag+] è 1,6 × 10-9 M.
AgCl inizia a precipitare ad un [Ag + ]inferiorea AgBr, quindi AgCl inizia a precipitare per primo. Si noti che la concentrazione di ioni cloruro della miscela iniziale era significativamente maggiore della concentrazione di ioni bromuro, e quindi il cloruro d’argento precipitò per primo nonostante avesse una Ksp superiore a quella del bromuro d’argento.
Questo testo è adattato da Openstax, Chimica 2e, Capitolo 15.1: Precipitazione e Dissoluzione.
Suggested Reading
- Firsching, Ferdinand Henry. "Selective precipitation of silver halides from homogeneous solution. Separation of iodide, bromide, and chloride using volatilization of ammonia." Analytical Chemistry 32, no. 13 (1960): 1876-1878.
- Reynolds, John P. "Ksp experiment: The solubility product for barium hydroxide." Journal of Chemical Education 52, no. 8 (1975): 521.
- Hou, Miaolin, and George L. Baughman. "Predicting the precipitation of acid and direct dyes in natural waters." Dyes and pigments 18, no. 1 (1992): 35-46.
