17.4:
熱力学の第三法則
17.4:
熱力学の第三法則
運動エネルギーを持たない純粋な完全結晶性固体(つまり、温度が絶対零度(0 K)の場合)は、その純粋さ、完全な結晶性、完全に運動しないことから、結晶を構成する同一の原子や分子の位置は1つしかない(W = 1)ため、単一の微視的状態で記述することができます。ボルツマン方程式によれば、この系のエントロピーはゼロです。
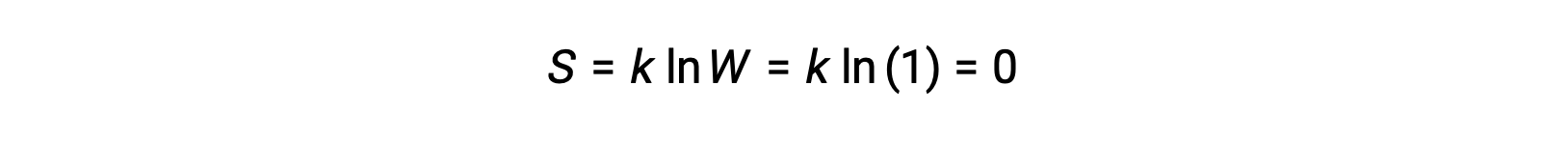
このエントロピーの限界条件は、熱力学の第3法則を表しています。0 Kにおける純粋で完全な結晶のエントロピーはゼロです。
注意深く熱量測定を行うことで、物質のエントロピーの温度依存性を決定し、特定の条件下における絶対的なエントロピー値を導き出すことができます。標準エントロピー(S°)は、標準的な条件下での1 molの物質のエントロピーです。物質の物理的状態、モル質量、同素体、分子の複雑さ、溶解の程度などにより、物質によって標準モルエントロピー値は異なります。
気相では粒子間のエネルギー分散が大きいため、気体状の物質は液体状の物質よりも標準モルエンタルピーが大きくなる傾向です。同様の理由で、液体の物質は固体の物質よりも大きな値を持つ傾向です。例えば、S°H2O(l) = 70 J/mol·KやS°H2O(g) = 188.8 J/mol·Kです。
同じ状態の元素でも、重い元素(モル質量が大きい)の方が、軽い元素よりも標準モルエントロピーの値が大きくなります。例えば、S°Ar(g) = 154.8 J/mol·K、S°Xe(g) = 159.4J/mol·Kです。
同様に、同じ状態の物質でも、複雑な分子の方が単純な分子よりも標準モルエンタルピーの値が大きいです。これは、より大きく複雑な分子では、原子の可能な配置が増え、可能な微視的状態の数が増えるためです。例えば、S°Ar (g) = 154.8 J/mol·KとS°NO (g) = 210.8 J/mol·Kでは、アルゴンの方がモル質量が大きいにもかかわらず、モルエントロピーの値が小さいです。これは、ガス状のアルゴンでは、エネルギーは原子の並進運動の形をとるのに対し、ガス状の一酸化窒素(NO)では、エネルギーは分子の並進運動、回転運動、(十分に高い温度では)振動運動の形をとるからです。
物質の標準モルエントロピーは、温度の上昇とともに増加します。固体から液体、液体から気体などの相転移の際には、エントロピーが大きく変化します。
上記の文章は以下から引用しました。Openstax, Chemistry 2e, Chapter 16.2: The Second and Third Law of Thermodynamics.
