17.4:
Tercera Ley de la Termodinámica
17.4:
Tercera Ley de la Termodinámica
Un sólido puro, perfectamente cristalino que no posee energía cinética (es decir, a una temperatura de cero absoluto, 0 K) puede ser descrito por un solo microestado, ya que su pureza, la cristalinidad perfecta, y la completa falta de movimiento significa que hay sólo una posible ubicación para cada átomo o molécula idéntica que comprende el cristal (W = 1). Según la ecuación de Boltzmann, la entropía de este sistema es cero.
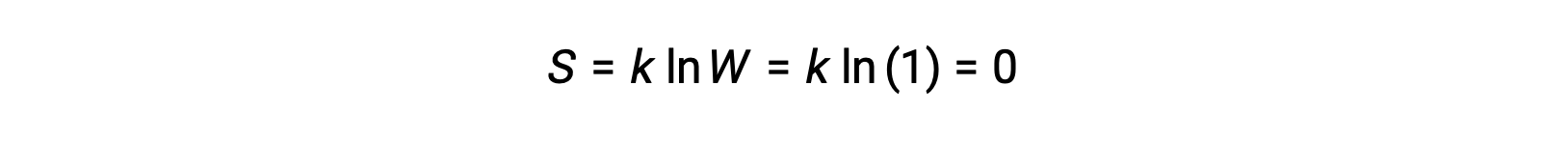
Esta condición limitante para la entropía de un sistema representa la tercera ley de la termodinámica: La entropía de una sustancia cristalina pura y perfecta a 0 K es cero.
Se pueden realizar mediciones calorimétricas cuidadosas para determinar la dependencia de la temperatura de la entropía de una sustancia y para obtener valores de entropía absoluta en condiciones específicas. Las entropías estándar (S°) son para un mol de una sustancia bajo condiciones estándar. Diferentes sustancias tienen diferentes valores de entropía molar estándar dependiendo del estado físico de la sustancia, la masa molar, las formas alotrópicas, la complejidad molecular y el grado de disolución.
Debido a la mayor dispersión de la energía entre las partículas dispersas en la fase gaseosa, las formas gaseosas de sustancias tienden a tener entalpías molares estándar mucho más grandes que sus formas líquidas. Por razones similares, las formas líquidas de las sustancias tienden a tener valores mayores que sus formas sólidas. Por ejemplo, S°H2O (l) = 70 J/mol·K y S°H2O (g) = 188,8 J/mol·K.
Entre elementos en el mismo estado, el elemento más pesado (mayor masa molar) tiene un valor de entropía molar estándar más alto que el elemento más ligero. Por ejemplo, S°Ar (g) = 154,8 J/mol·K y S°Xe (g) = 159,4 J/mol·K.
Del mismo modo, entre las sustancias en el mismo estado, las moléculas más complejas tienen valores más altos de entalpía molar estándar que las más simples. Hay más arreglos posibles de átomos en moléculas más grandes y complejas, lo que aumenta el número de microestados posibles. Por ejemplo, S°Ar (g) = 154,8 J/mol·K y S°NO (g) = 210,8 J/mol·K a pesar de la mayor masa molar del argón. Esto es porque en el argón gaseoso, la energía toma la forma de movimiento traslacional de los átomos, mientras que en el óxido nítrico gaseoso (NO), la energía toma la forma de movimiento traslacional, movimiento rotacional y (a temperaturas suficientemente altas) movimientos vibracionales de las moléculas.
La entropía molar estándar de cualquier sustancia aumenta con el aumento de la temperatura. En las transiciones de fase, como de sólido a líquido y de líquido a gas, se producen grandes saltos en la entropía, lo que se debe al aumento repentino de la movilidad molecular y a mayores volúmenes disponibles asociados con los cambios de fase.
Este texto es adaptado de Openstax, Química 2e, Capítulo 16.2: La Segunda y Tercera Ley de Termodinámica.
