17.4:
Troisième loi de la thermodynamique
17.4:
Troisième loi de la thermodynamique
Un solide pur, parfaitement cristallin, ne possédant aucune énergie cinétique (c’est-à-dire, à la température du zéro absolu, 0 K) peut être décrit par un seul micro-état, puisque sa pureté, sa cristallinité parfaite et son absence complète de mouvement signifie qu’il n’y a qu’un emplacement possible pour chaque atome ou molécule identique constituant le cristal (W = 1). D’après l’équation de Boltzmann, l’entropie de ce système est nulle.
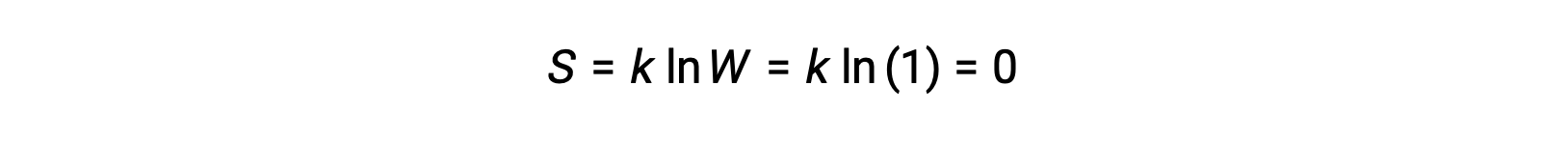
Cette condition limitante de l’entropie d’un système représente le troisième principe de la thermodynamique : l’entropie d’une substance cristalline pure et parfaite à 0 K est zéro.
Des mesures calorimétriques consciencieuses peuvent être effectuées afin de déterminer la façon dont l’entropie d’une substance dépend de la température et pour déduire des valeurs d’entropie absolue dans des conditions spécifiques. Les entropies standard (S°) sont pour une mole d’une substance dans des conditions standard. Des substances différentes ont des valeurs d’entropie molaire standard différentes selon l’état physique de la substance, sa masse molaire, ses formes allotropes, sa complexité moléculaire et l’étendue de sa dissolution.
En raison de la plus grande dispersion de l’énergie parmi les particules dispersées dans la phase gazeuse, les formes gazeuses de substances ont tendance à avoir des enthalpies molaires standard beaucoup plus grandes que leurs formes liquides. Pour des raisons similaires, les formes liquides des substances ont tendance à avoir des valeurs plus élevées que leurs formes solides. Par exemple, S°HH2O (l) = 70 J/mol·K et S°H2O (g) = 188,8 J/mol·K.
Parmi des éléments dans le même état, l’élément plus lourd (masse molaire plus grande) a une valeur d’entropie molaire standard plus élevée que l’élément plus léger. Par exemple, S°Ar (g) = 154,8 J/mol·K et S°Xe (g) = 159,4 J/mol·K.
De même, parmi des substances qui sont dans le même état, les molécules plus complexes ont des valeurs d’enthalpie molaire standard plus élevées que les molécules plus simples. Il y a plus de dispositions d’atomes possibles dans des molécules plus grandes et plus complexes, ce qui augmente le nombre de micro-états possibles. Par exemple, S°Ar (g) = 154,8 J/mol·K et S°NO (g) = 210,8 J/mol·K malgré la masse molaire plus élevée de l’argon. En effet, dans l’argon gazeux, l’énergie prend la forme d’un mouvement de translation des atomes, alors que dans l’oxyde nitrique gazeux (NO), l’énergie prend la forme d’un mouvement translationnel, d’un mouvement rotationnel et (à des températures suffisamment élevées) de mouvements vibrationnels des molécules.
L’entropie molaire standard de toute substance augmente avec l’augmentation de la température. Lors des transitions de phase, comme de solide à liquide et de liquide à gaz, de grands sauts d’entropie se produisent, ce qui est dû à la mobilité moléculaire accrue soudaine et aux volumes disponibles plus importants associés aux changements de phase.
Ce texte est adapté de Openstax, Chimie 2e, Chapitre 16.2 : Le deuxième et troisième principe de la thermodynamique.
