17.4: Terceira Lei da Termodinâmica
Um sólido puro, perfeitamente cristalino, sem energia cinética (isto é, a uma temperatura absoluta de zero, 0 K) pode ser descrito por um único microestado, uma vez que a sua pureza, cristalinidade perfeita, e total falta de movimento significam que existe apenas uma localização possível para cada átomo ou molécula idêntica que compõem o cristal (W = 1). De acordo com a equação de Boltzmann, a entropia deste sistema é zero.
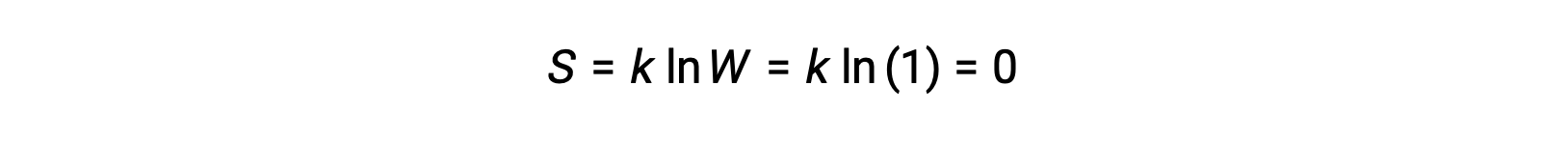
Esta condição limitante para a entropia de um sistema representa a terceira lei da termodinâmica: a entropia de uma substância cristalina pura e perfeita a 0 K é zero.
Podem ser feitas medições calorimétricas cuidadosas para determinar a dependência térmica da entropia de uma substância e para obter valores absolutos de entropia em condições específicas. As entropias padrão (S°) destinam-se a um mole de uma substância em condições normais. As diferentes substâncias têm diferentes valores de entropia molar padrão, dependendo do estado físico da substância, da massa molar, das formas alotrópicas, da complexidade molecular, e da extensão da dissolução.
Devido à maior dispersão de energia entre as partículas dispersas na fase gasosa, as formas gasosas de substâncias tendem a ter muito maiores entalpias molares padrão do que as suas formas líquidas. Por razões semelhantes, as formas líquidas de substâncias tendem a ter valores maiores do que as suas formas sólidas. Por exemplo, S°H2O (l) = 70 J/mol·K e S°H2O (g) = 188,8 J/mol·K.
Entre elementos no mesmo estado, o elemento mais pesado (massa molar maior) tem um valor de entropia molar padrão maior do que o elemento mais leve. Por exemplo, S°Ar (g) = 154,8 J/mol·K e S°Xe (g) = 159,4 J/mol·K.
Da mesma forma, entre substâncias no mesmo estado, as moléculas mais complexas têm valores de entalpia molar padrão mais elevados do que as mais simples. Existem mais arranjos possíveis de átomos em moléculas maiores e mais complexas, o que aumenta o número de microestados possíveis. Por exemplo, S°Ar (g) = 154,8 J/mol·K e S°NO (g) = 210,8 J/mol·K, apesar da massa molar mais elevada do árgon. Isto porque no árgon gasoso, a energia assume a forma de movimento translacional dos átomos, enquanto que no óxido nítrico gasoso (NO), a energia assume a forma de movimento translacional, movimento rotacional, e (a temperaturas elevadas o suficiente) movimentos vibracionais das moléculas.
A entropia molar padrão de qualquer substância aumenta com o aumento da temperatura. Nas transições de fase, como do sólido para o líquido e do líquido para o gás, ocorrem grandes saltos na entropia, o que se deve ao aumento súbito da mobilidade molecular e aos maiores volumes disponíveis associados às mudanças de fase.
Este texto é adaptado de Openstax, Chemistry 2e, Chapter 16.2: The Second and Third Law of Thermodynamics.


