17.10:
الطاقة الحرة والتوازن
17.10:
الطاقة الحرة والتوازن
يمكن النظر إلى تغيير الطاقة الحرة لعملية ما كمقياس لقوتها الدافعة. تمثل القيمة السالبة لـ & # 916 ؛ G قوة دافعة للعملية في الاتجاه الأمامي ، بينما تمثل القيمة الموجبة قوة دافعة للعملية في الاتجاه العكسي. عندما تكون & # 916؛ G rxn صفرًا ، تكون القوى الدافعة للأمام والخلف متساوية ، و تحدث العملية في كلا الاتجاهين بنفس المعدل (النظام في حالة توازن).
تذكر أن Q هي القيمة العددية لتعبير الفعل الجماعي للنظام ، ويمكن استخدام قيمتها لتحديد الاتجاه الذي سيستمر فيه التفاعل لتحقيق التوازن. عندما يكون Q أقل من ثابت التوازن ، K ، سيستمر التفاعل في الاتجاه الأمامي حتى يتم الوصول إلى التوازن و Q = ك . بالمقابل ، إذا Q & # 62 ؛ ك ، ستستمر العملية في الاتجاه العكسي حتى يتحقق التوازن.
يرتبط تغيير الطاقة الحرة لعملية تحدث مع المواد المتفاعلة والمنتجات الموجودة في ظروف غير قياسية (ضغوط بخلاف 1 بار ؛ التركيزات بخلاف 1 متر) بالتغير القياسي في الطاقة الحرة وفقًا لـ هذه المعادلة:
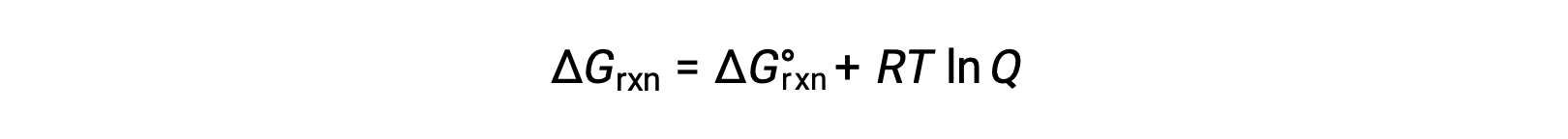
R هو ثابت الغاز (8.314 J/K mol) ، و T هو كلفن أو درجة الحرارة المطلقة ، و Q هو التفاعل حاصل القسمة. بالنسبة لتوازن الطور الغازي ، يتم استخدام حاصل التفاعل المعتمد على الضغط ، Q p . حاصل التفاعل المعتمد على التركيز ، Q c ، يستخدم لتوازن الطور المكثف. يمكن استخدام هذه المعادلة للتنبؤ بعفوية العملية تحت أي مجموعة معينة من الشروط
بالنسبة إلى نظام في حالة توازن، Q = K و ΔGrxn = 0، ويمكن كتابة المعادلة السابقة كـ
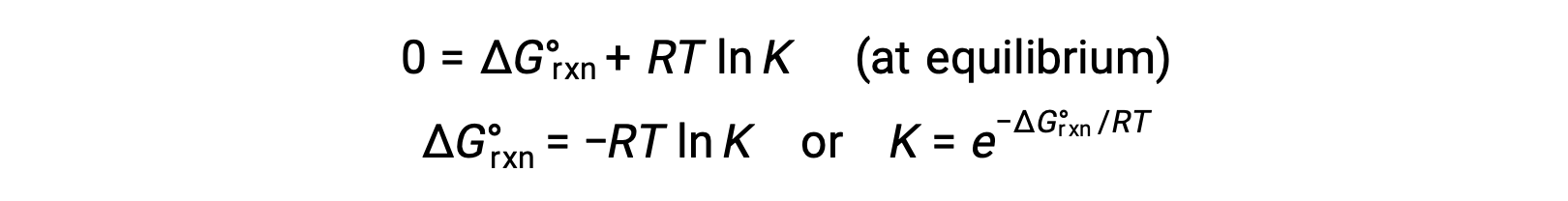
يوفر هذا الشكل من المعادلة رابطًا مفيدًا بين هاتين الخاصيتين الديناميكا الحرارية الأساسيتين ، ويمكن استخدامه لاشتقاق ثوابت التوازن من التغييرات القياسية في الطاقة الحرة والعكس صحيح. العلاقات بين التغيرات القياسية في الطاقة الحرة وثوابت التوازن ملخصة أدناه.
إذا K & # 62؛ 1، & # 916؛ G & # 186؛ rxn & # 60؛ 0 والمنتجات أكثر وفرة في خليط التفاعل.
إذا K & # 60؛ 1، & # 916؛ G & # 186؛ rxn & # 62؛ 0 والمواد المتفاعلة أكثر وفرة في خليط التفاعل.
& # 160 ؛ K = 1، & # 916؛ G & # 186؛ rxn = 0 والمواد المتفاعلة والمنتجات وفيرة نسبيًا في خليط التفاعل.
الطاقة الحرة القياسية لتغيير التفاعل تعتمد على درجة الحرارة:
يرتبط التغير القياسي في الطاقة الحرة للتفاعل بثابت التوازن للتفاعل:
الجمع بين التعبيرين:
ينتج عن تقسيم كلا الجانبين بواسطة RT
إعادة ترتيب العطاء
تأخذ المعادلة شكل خط مستقيم y = mx + b . مؤامرة من ln K تم رسمها مقابل 1 / T & # 160 ؛ تنتج خطًا مستقيمًا بميل & # 8722 ؛ & # 916 ؛ H & # 186؛ rxn / R وتقاطع y لـ & # 916؛ S & # 186؛ rxn / R . يمكن أيضًا التعبير عن المعادلة بصيغة من نقطتين:
هذا النص مقتبس من Openstax, Chemistry 2e, Chapter 16.4: Free Energy.
