17.10:
자유에너지와 평형
17.10:
자유에너지와 평형
공정에 대한 자유로운 에너지 변화는 추진력의 척도로 간주될 수 있다. ΔG에 대한 음수 값은 전방 방향의 공정에 대한 원동력을 나타내며 양수 값은 역방향 공정의 원동력을 나타냅니다. ΔGrxn이 0이면 전방 및 역 주행 힘이 같으며 프로세스가 동일한 속도로 양방향으로 발생합니다(시스템은 평형에 있음).
Q는 시스템에 대한 질량 행동 표현식의 수치값이며, 그 값은 평형을 달성하기 위해 반응이 진행되는 방향을 식별하는 데 사용될 수 있음을 기억한다. Q가 평형 상수보다 작으면 K,평형에 도달할 때까지 반응이 전진 방향으로 진행되고 Q = K. 반대로, Q> K의경우 평형이 달성될 때까지 프로세스가 역방향으로 진행됩니다.
비표준 조건(1bar 이외의 압력, 1M 이외의 농도)에 존재하는 반응제 및 제품과 함께 일어나는 공정에 대한 무료 에너지 변화는 이 방정식에 따른 표준 자유 에너지 변화와 관련이 있습니다.
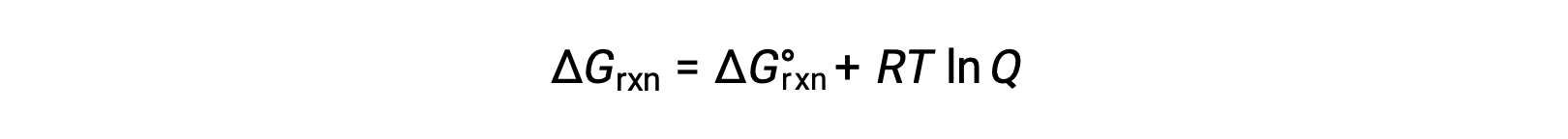
R은 가스 상수(8.314 J/K 몰), T는 켈빈 또는 절대 온도이며, Q는 반응 지수이다. 가스상 평형의 경우 압력 계 반응 지수Qp가사용됩니다. 농도 계 반응 지수, Qc는응축된 위상 평형증에 사용된다. 이 방정식은 주어진 조건 집합에서 프로세스의 자발성을 예측하는 데 사용될 수 있습니다.
평형시스템에서의 시스템의 경우 Q = K 및 ΔGrxn = 0, 이전 방정식은
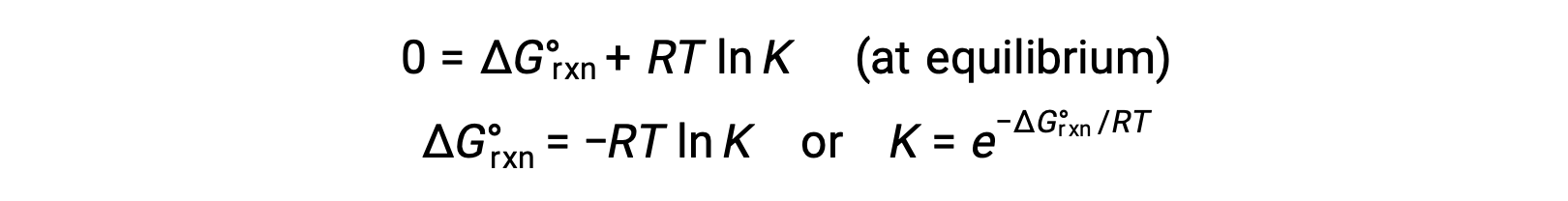
방정식의이 형태는 이러한 두 가지 필수 열역학 특성 사이의 유용한 링크를 제공하고, 표준 무료 에너지 변화에서 평형 상수를 파생하는 데 사용할 수 있으며, 그 반대의 경우도 마찬가지입니다. 표준 자유 에너지 변화와 평형 상수 간의 관계는 아래 요약되어 있습니다.
K> 1, ΔGºrxn & 0 및 제품이 반응 혼합물에 더 풍부하다.
K&1, ΔGºrxn > 0 및 반응제는 반응 혼합물에 더 풍부하다.
K = 1, ΔGºrxn = 0 및 반응제 및 제품은 반응 혼합물에 비교적 풍부하다.
반응 변화에 대한 표준 무료 에너지는 온도에 따라 달라집니다:
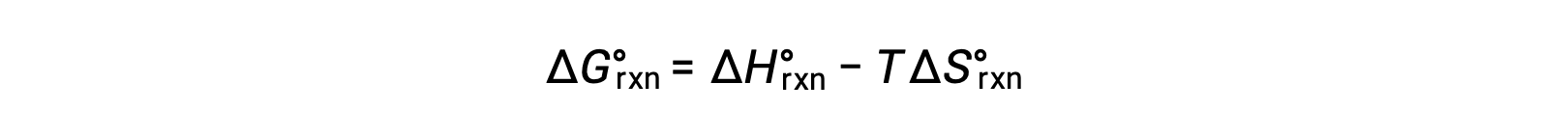
반응에 대한 표준 자유 에너지 변화는 반응을 위한 평형 상수와 관련이 있습니다.
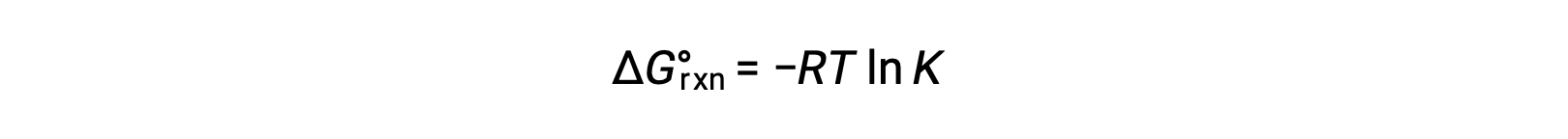
두 식을 결합합니다.
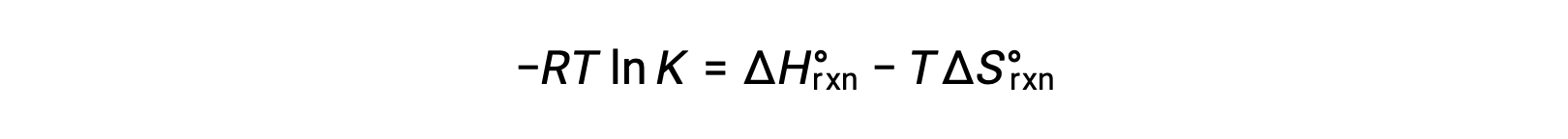
RT로 양쪽을 나누는 것은

재배열은
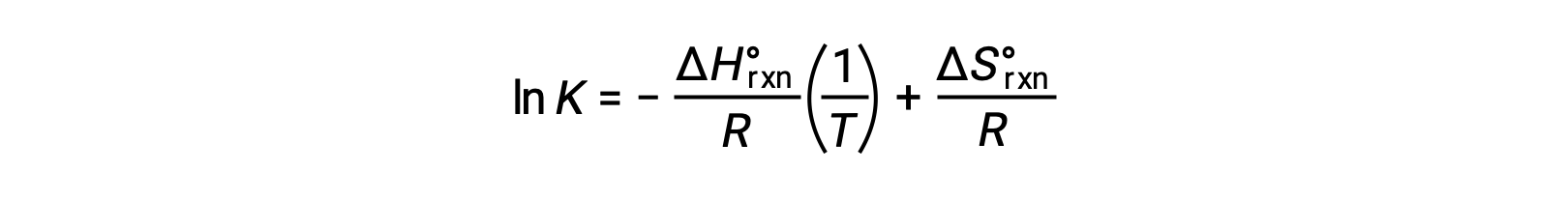
방정식은 직선 y = mx + b의형태를 취한다. ln K의 플롯은 1 /T에 대해 플롯 – ΔHºrxn/R의 경사와 ΔSºrxn/R의y-intercept와 직선을 산출한다. 방정식은 2점 형식으로 표현될 수도 있습니다.
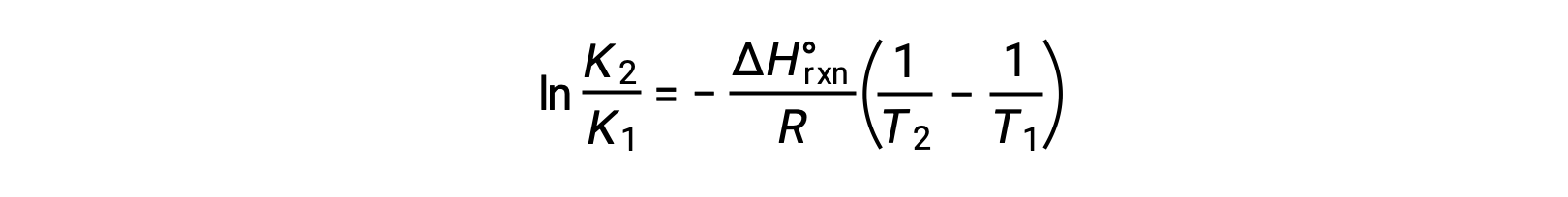
이 텍스트는 오픈 탁스, 화학 2e, 장 16.4에서 적응 : 무료 에너지.
