17.10:
Energia libera ed equilibrio
17.10:
Energia libera ed equilibrio
Il cambiamento di energia libera per un processo può essere visto come una misura della sua forza trainante. Un valore negativo per ΔG rappresenta una forza trainante per il processo nella direzione in avanti, mentre un valore positivo rappresenta una forza trainante per il processo nella direzione inversa. Quando ΔGrxn è zero, le forze motrici avanti e indietro sono uguali, e il processo avviene in entrambe le direzioni alla stessa velocità (il sistema è in equilibrio).
Ricordiamo che Q è il valore numerico dell’espressione di azione di massa per il sistema, e il suo valore può essere usato per identificare la direzione in cui una reazione procederà al fine di raggiungere l’equilibrio. Quando Q è minore della costante di equilibrio, K, la reazione procederà nella direzione in avanti fino a raggiungere l’equilibrio e Q = K. Al contrario, se Q > K, il processo procederà nella direzione inversa fino al raggiungere l’equilibrio.
Il cambiamento di energia libera per un processo in corso con reagenti e prodotti presenti in condizioni non standard (pressioni diverse da 1 bar; concentrazioni diverse da 1 M) è correlato al cambiamento di energia libera standard secondo questa equazione:
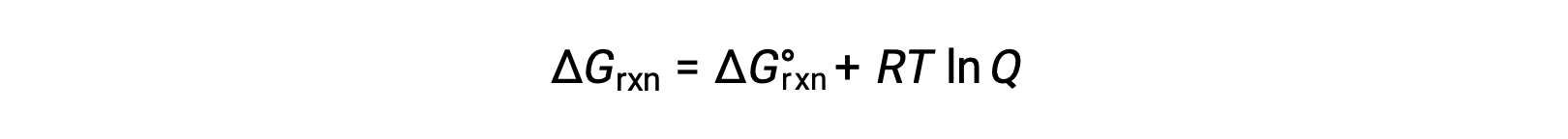
R è la costante di gas (8,314 J/K mol), T è la temperatura kelvin o assoluta, e Q è il quoziente di reazione. Per gli equilibri della fase gassosa viene utilizzato il quoziente di reazione basato sulla pressione, Qp. Il quoziente di reazione basato sulla concentrazione, Qc, è usato per gli equilibri di fase condensati. Questa equazione può essere usata per prevedere la spontaneità di un processo in un dato insieme di condizioni
Per un sistema in equilibrio, Q = K e ΔGrxn = 0, e l’equazione precedente può essere scritta come
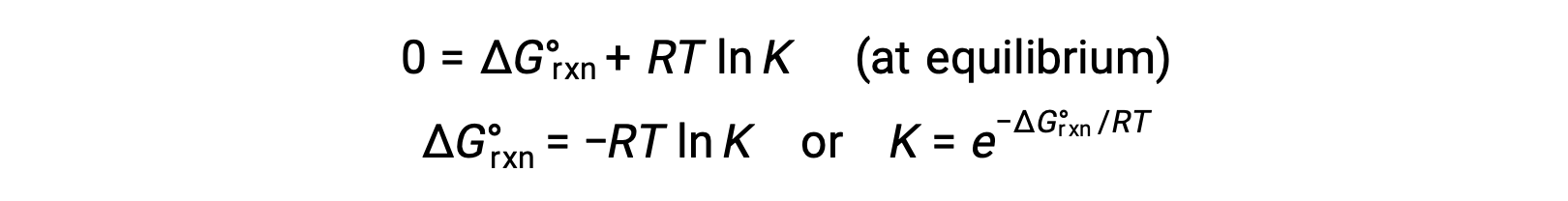
Questa forma dell’equazione fornisce un collegamento utile tra queste due proprietà termodinamiche essenziali, e può essere usata per derivare costanti di equilibrio dai cambiamenti di energia libera standard e viceversa. Le relazioni tra i cambiamenti di energia libera standard e le costanti di equilibrio sono riassunte di seguito.
Se K > 1, ΔGºrxn < 0 e i prodotti sono più abbondanti nella miscela di reazione.
Se K < 1, ΔGºrxn > 0 e i reagenti sono più abbondanti nella miscela di reazione.
K = 1, ΔGºrxn = 0 e i reagenti e i prodotti sono comparabilmente abbondanti nella miscela di reazione.
L’energia libera standard per un cambiamento di reazione dipende dalla temperatura:
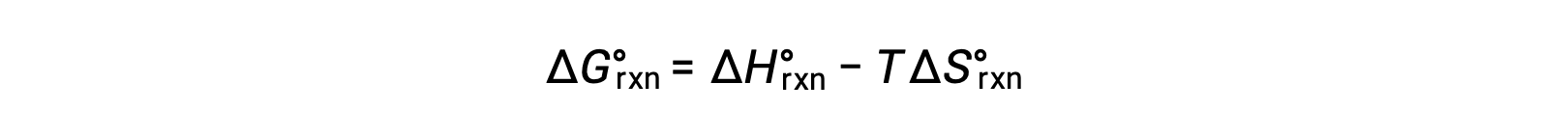
Il cambiamento di energia libera standard per una reazione è correlato alla costante di equilibrio per una reazione:
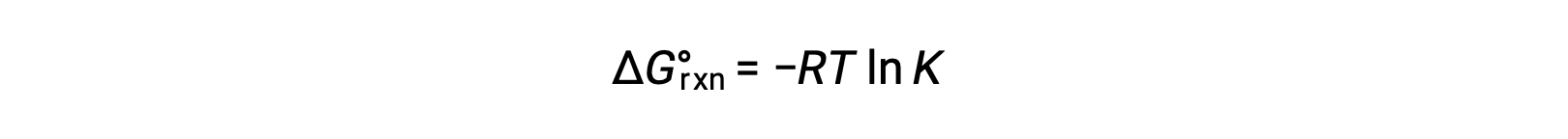
Combinazione delle due espressioni:
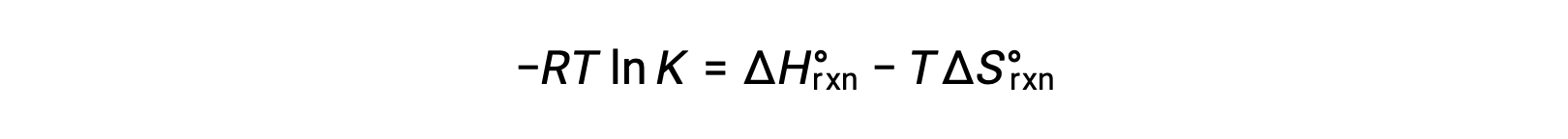
Dividere entrambi i lati per RT dà

Riorganizzare dà
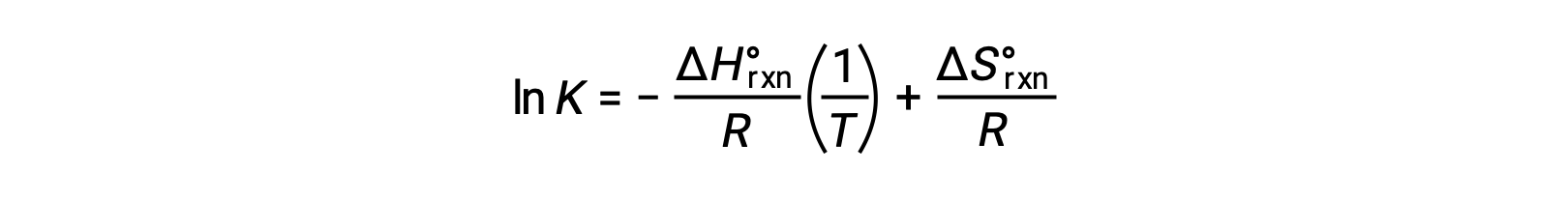
L’equazione assume la forma di una retta y = mx + b. Un grafico di ln K tracciato contro 1/T produce una linea retta con una pendenza di −ΔHºrxn/R e un’intercetta y di ΔSºrxn/R. L’equazione può anche essere espressa in una forma a due punti:
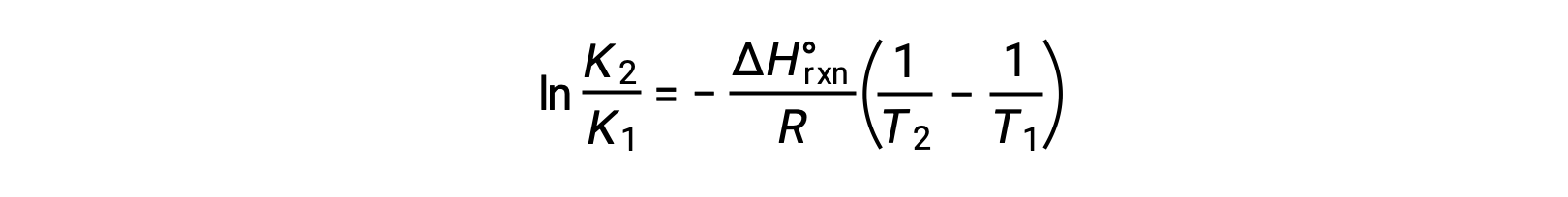
Questo testo è adattato da Openstax, Chimica 2e, Capitolo 16.4: Energia Libera.
