17.10:
Свободная энергия и равновесие
17.10:
Свободная энергия и равновесие
изменение свободной энергии для процесса можно рассматривать как меру его движущей силы. Отрицательное значение для ΔG представляет движущую силу для процесса в прямом направлении, а положительное значение представляет движущую силу для процесса в обратном направлении. Когда ΔGrxn равно нулю, силы движения вперед и назад равны, и процесс происходит в обоих направлениях с одинаковой скоростью (система находится в равновесии).
Помните, что Q — это числовое значение выражения массового действия системы, и его значение может использоваться для определения направления, в котором будет протекать реакция для достижения равновесия. Если значение Q меньше константы равновесия, K, реакция будет продолжаться в прямом направлении до тех пор, пока не будет достигнуто равновесие и Q = K. наоборот, если Q > K, процесс будет продолжаться в обратном направлении до тех пор, пока не будет достигнуто равновесие.
изменение свободной энергии для процесса, проходческого с реагенты, и продуктов, находящихся в нестандартных условиях (давления, отличные от 1 бар; концентрации, отличные от 1 м), относится к стандартному изменение свободной энергии в соответствии с этим уравнением:
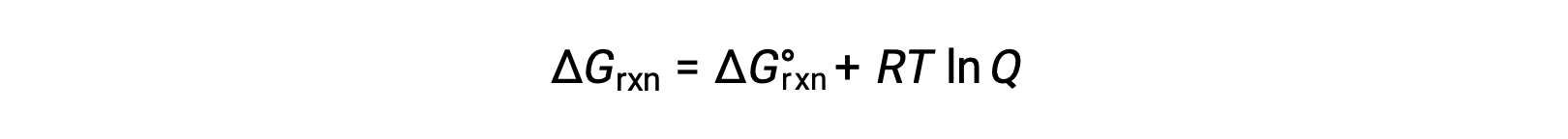
R — это постоянная газа (8.314 Дж/K моль), T — это кельвин или абсолютная температура, а Q — коэффициент реакции. Для газфазного равновесия используется коэффициент реакции на основе давления Qp. Коэффициент реакции на основе концентрации, КК, используется для сгущенного фазового равновесия. Это уравнение можно использовать для прогнозирования спонтанности процесса при любом заданном наборе условий
Для системы с равновесием Q = K и ΔGrxn = 0, и предыдущее уравнение может быть записано как
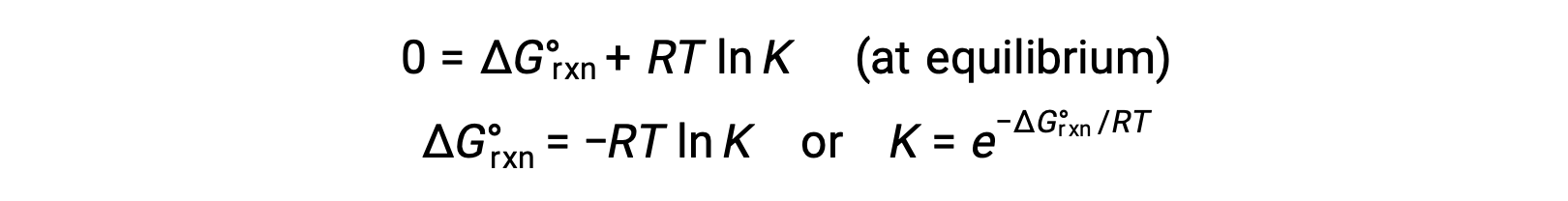
Эта форма уравнения обеспечивает полезную связь между этими двумя существительными термодинамическими свойствами, и она может использоваться для получения констант равновесия из изменений стандартной свободной энергии и наоборот. Ниже кратко описаны взаимосвязи между стандартными изменениями свободной энергии и константами равновесия.
Если K > 1, ΔGºrxn < 0 и продукты более богаты в реакционной смеси.
Если K < 1, ΔGºrxn > 0 и реагенты больше в реакционной смеси.
K = 1, ΔGºrxn = 0, а реагенты и продукты имеют сравнительно много реакционной смеси.
Стандартная свободная энергия для изменения реакции зависит от температуры:
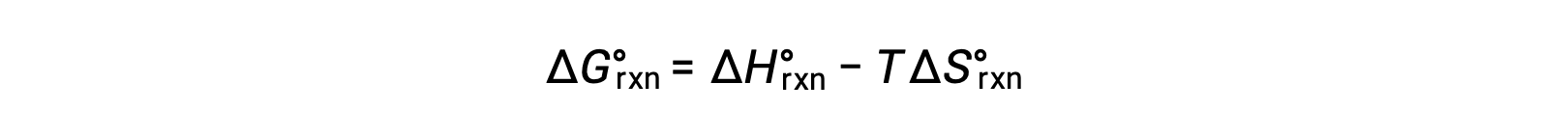
Стандартный изменение свободной энергии для реакции связан с константой равновесия для реакции:
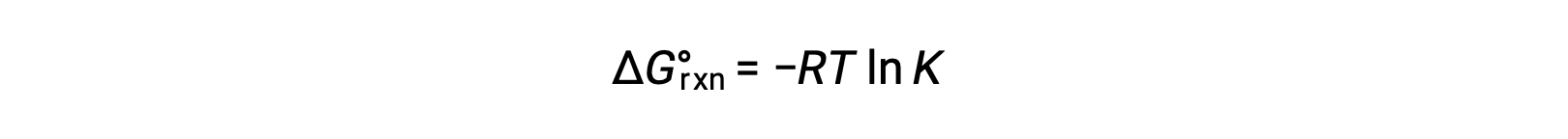
Объединение двух выражений:
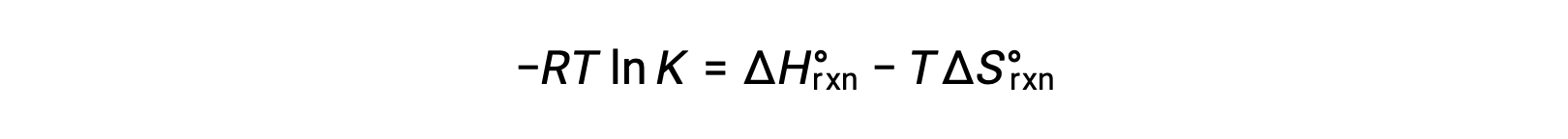
Разделение обеих сторон на RT дает

Переупорядочивание дает
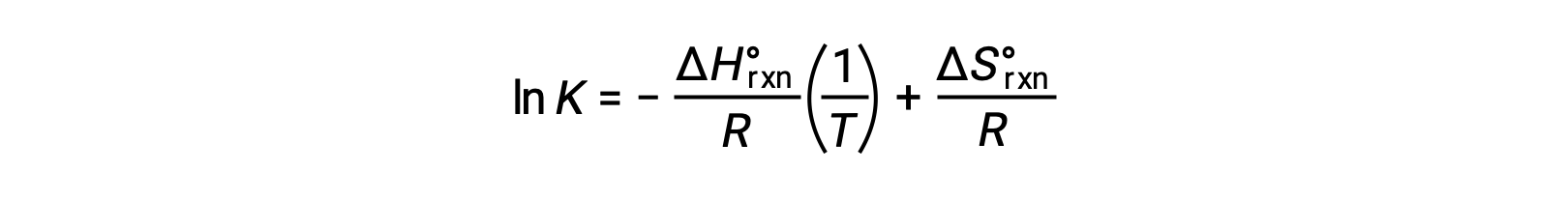
Уравнение принимает форму прямой линии y = mx + b Эпюра ln K, построенного на основе 1/T , дает прямую линию с уклоном ΔHºrxn/R и Y-отсекаемый отрезок ΔSºrxn/R. Уравнение также может быть выражено в двухточечной форме:
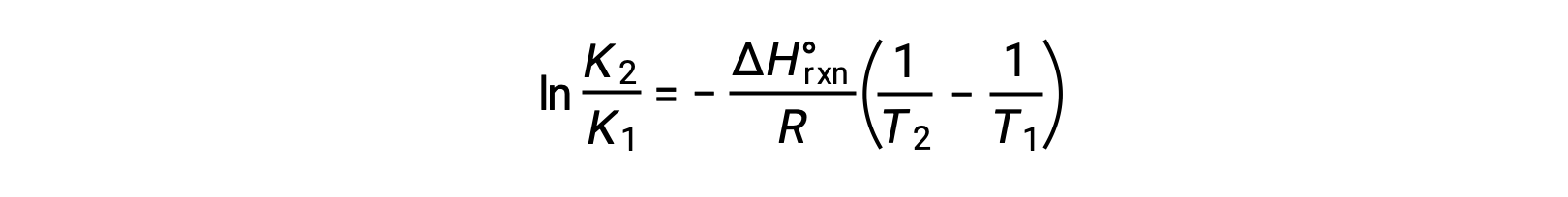
Этот текст адаптирован из Openstax, Химия 2е изд., Глава 16.4: Свободная энергия.
