17.10:
Energía Libre y Equilibrio
17.10:
Energía Libre y Equilibrio
El cambio de energía libre para un proceso puede ser visto como una medida de su fuerza impulsora. Un valor negativo para ΔG representa una fuerza impulsora del proceso hacia la dirección de avance, mientras que un valor positivo representa una fuerza impulsora del proceso hacia la dirección de retroceso. Cuando ΔGrxn es cero, las fuerzas impulsoras de avance y retroceso son iguales y el proceso se produce en ambas direcciones a la misma velocidad (el sistema está en equilibrio).
Recuerde que Q es el valor numérico de la expresión de acción de masa para el sistema, y su valor se puede utilizar para identificar la dirección en la que se procederá una reacción para lograr el equilibrio. Cuando Q es menor que la constante de equilibrio, K, la reacción continuará en la dirección de avance hasta que se alcance el equilibrio y Q = K. De forma inversa, si Q > K, el proceso procederá en la dirección de retroceso hasta que se logre el equilibrio.
El cambio de energía libre para un proceso que tiene lugar con reactivos y productos presentes en condiciones no estándar (presiones distintas de 1 bar; concentraciones distintas de 1 M) está relacionado con el cambio de energía libre estándar de acuerdo con esta ecuación:
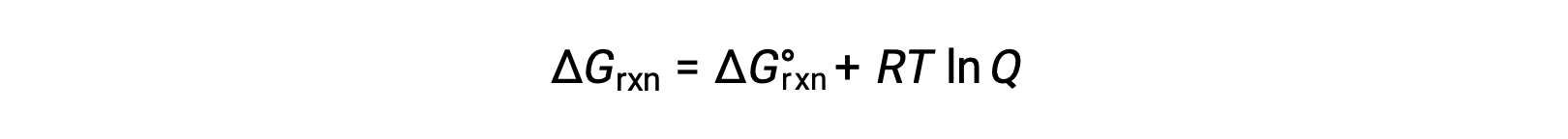
R es la constante de gas (8,314 J/K·mol), T es la temperatura kelvin o absoluta y Q es el cociente de reacción. Para los equilibrios de fase gaseosa, se utiliza el cociente de reacción basado en la presión, Qp. El cociente de reacción basado en la concentración, Qc, se utiliza para los equilibrios de fase condensada. Esta ecuación puede ser usada para predecir la espontaneidad de un proceso bajo cualquier conjunto de condiciones
Para un sistema en equilibrio, Q = K y ΔGrxn = 0, entonces la ecuación anterior se puede escribir como
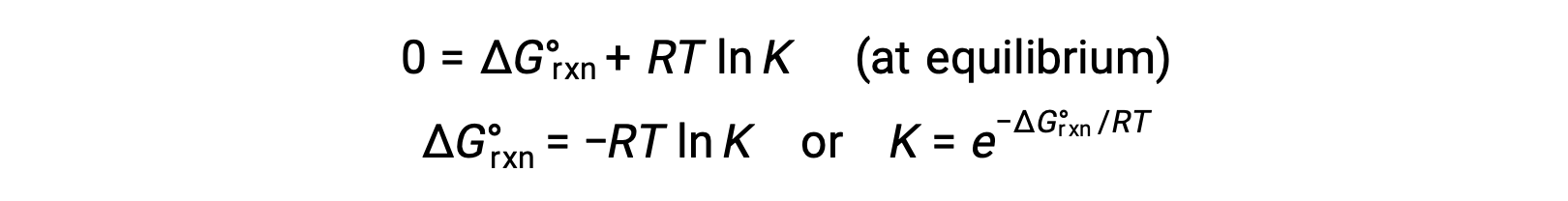
Esta forma de la ecuación proporciona un vínculo útil entre estas dos propiedades termodinámicas esenciales, y se puede utilizar para obtener constantes de equilibrio a partir de los cambios de energía libre estándar y viceversa. A continuación se resumen las relaciones entre los cambios de energía libre estándar y las constantes de equilibrio.
Si K > 1, ΔG°rxn < 0 y los productos son más abundantes en la mezcla de reacción.
Si K < 1, ΔG°rxn > 0 y los reactivos son más abundantes en la mezcla de reacción.
K = 1, ΔG°rxn = 0 y los reactivos y productos son comparablemente abundantes en la mezcla de reacción.
La energía libre estándar para un cambio de reacción depende de la temperatura:
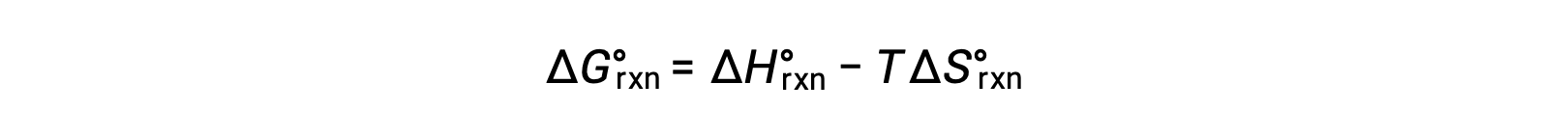
El cambio de energía libre estándar para una reacción está relacionado con la constante de equilibrio para una reacción:
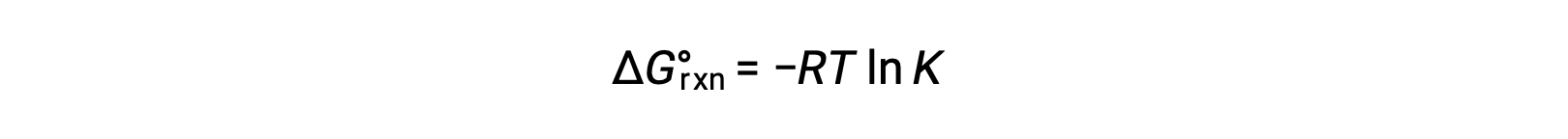
Al combinar las dos expresiones se obtiene:
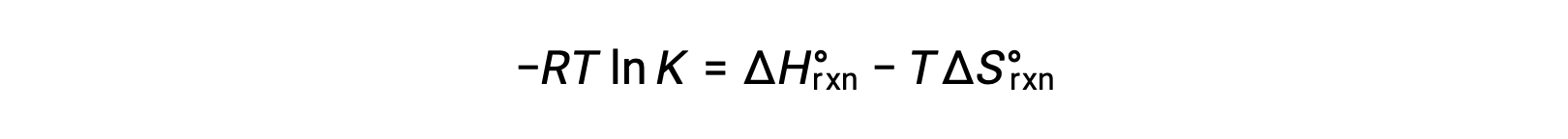
Dividiendo ambos lados por RT se obtiene

Al reorganizar queda
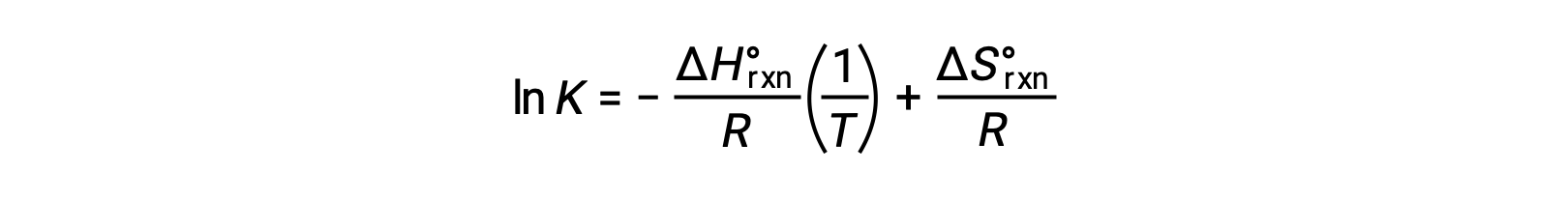
La ecuación toma la forma de una línea recta y = mx + b. Un gráfico de lnK trazado contra 1/T produce una línea recta con una pendiente de −ΔH°rxn/R y una intersección y de ΔS°rxn/R. La ecuación también se puede expresar en una forma de dos puntos:
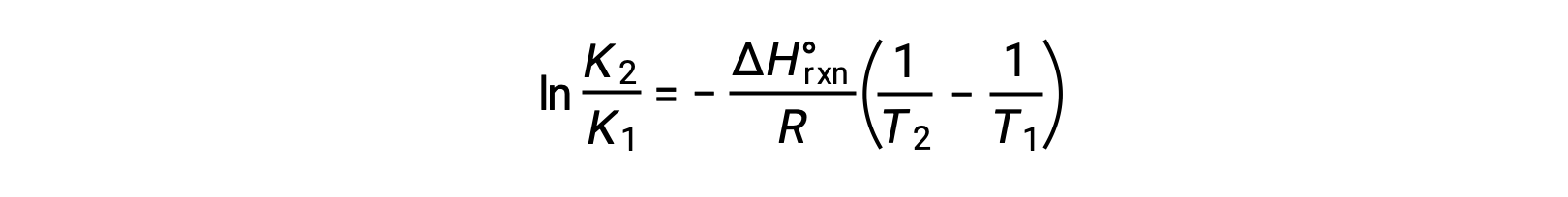
Este texto está adaptado de Openstax, Química 2e, Capítulo 16.4: Energía Libre.
