17.10:
Energia Livre e Equilíbrio
17.10:
Energia Livre e Equilíbrio
A alteração de energia livre para um processo pode ser vista como uma medida da sua força motriz. Um valor negativo para ΔG representa uma força motriz para o processo na direção direta, enquanto que um valor positivo representa uma força motriz para o processo na direção inversa. Quando ΔGrxn é zero, as forças no sentido direto e inverso são iguais, e o processo ocorre em ambas as direções à mesma velocidade (o sistema está em equilíbrio).
Lembre-se que Q é o valor numérico da expressão da ação das massas para o sistema, e o seu valor pode ser usado para identificar a direção na qual uma reação irá prosseguir para alcançar o equilíbrio. Quando Q é menor do que a constante de equilíbrio, K, a reação irá avançar na direção direta até que o equilíbrio seja alcançado e Q = K. Inversamente, se Q > K, o processo irá prosseguir na direção inversa até que o equilíbrio seja alcançado.
A alteração de energia livre para um processo que ocorre com reagentes e produtos presentes em condições não padrão (pressões diferentes de 1 bar; concentrações diferentes de 1 M) está relacionada com a alteração de energia livre padrão de acordo com esta equação:
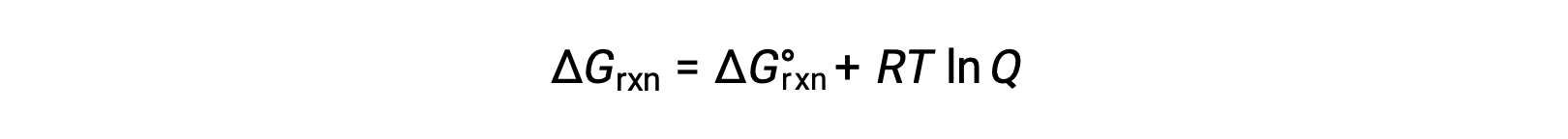
R é a constante de gás (8,314 J/K mol), T é a temperatura em kelvin ou absoluta, e Q é o quociente de reação. Para os equilíbrios de fase gasosa, é utilizado o quociente de reação baseado na pressão, Qp. O quociente de reação baseado na concentração, Qc, é utilizado para os equilíbrios de fase condensada. Esta equação pode ser usada para prever a espontaneidade de um processo sob qualquer conjunto de condições
Para um sistema em equilíbrio, Q = K e ΔGrxn = 0, e a equação anterior pode ser escrita como
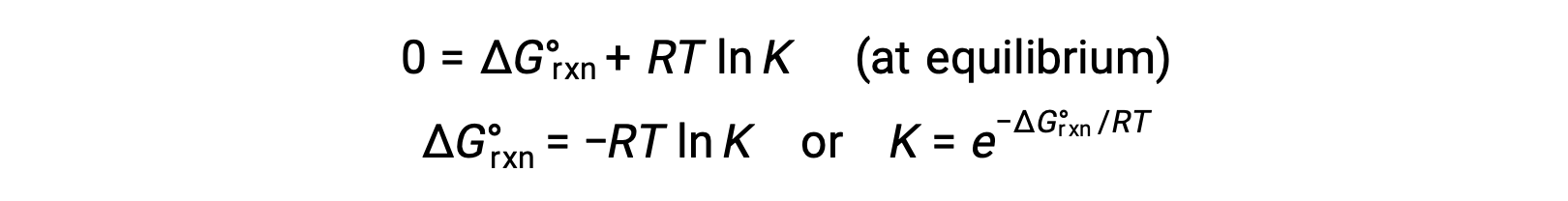
Esta forma da equação fornece uma ligação útil entre estas duas propriedades termodinâmicas essenciais, e pode ser usada para derivar constantes de equilíbrio de alterações de energia livre padrão e vice-versa. As relações entre as alterações de energia livre padrão e as constantes de equilíbrio estão resumidas abaixo.
Se K > 1, ΔGºrxn < 0 e os produtos são mais abundantes na mistura da reação.
Se K < 1, ΔGºrxn > 0 e os reagentes são mais abundantes na mistura da reação.
K = 1, ΔGºrxn = 0 e os reagentes e produtos são comparativamente abundantes na mistura da reacção.
A energia livre padrão para uma alteração da reação depende da temperatura:
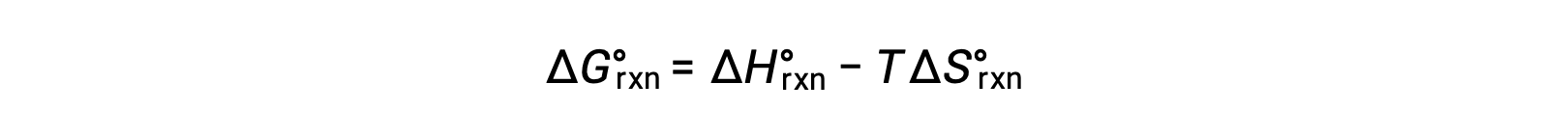
A alteração de energia livre padrão para uma reação está relacionada com a constante de equilíbrio para uma reação:
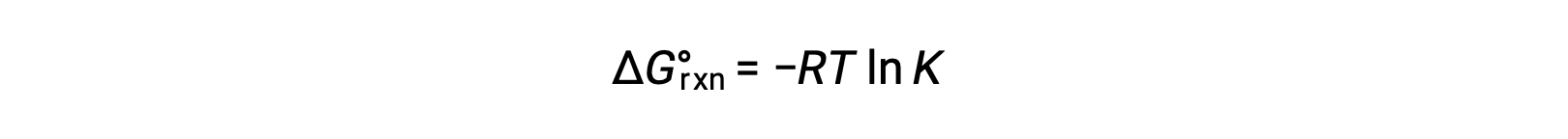
Combinando as duas expressões:
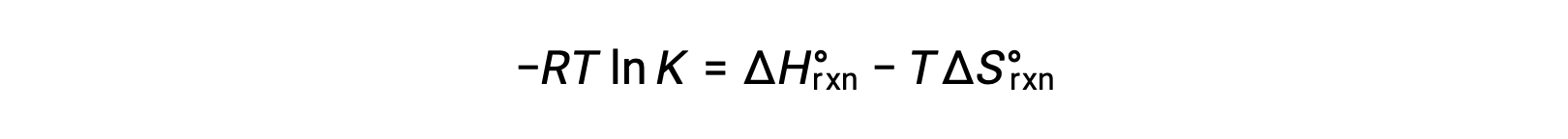
Dividindo ambos os lados por RT obtemos

Reorganizando obtemos
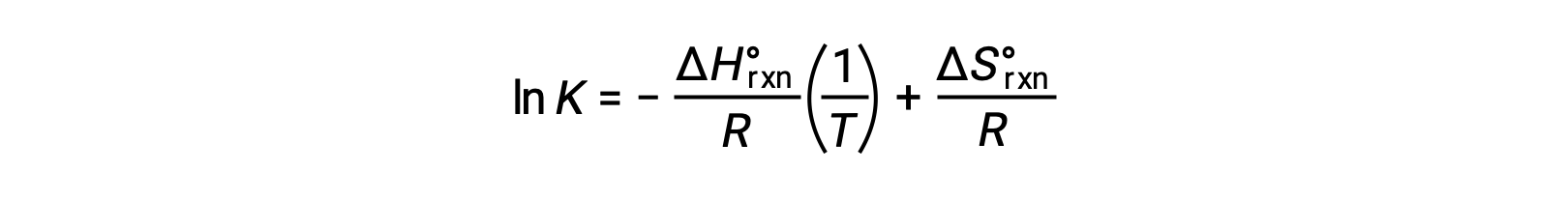
A equação assume a forma de uma linha recta y = mx + b. Um gráfico de ln K contra 1/T produz uma linha recta com um declive de −ΔHºrxn/R e uma intercepção y de ΔSºrxn/R. A equação também pode ser expressa em uma forma de dois pontos:
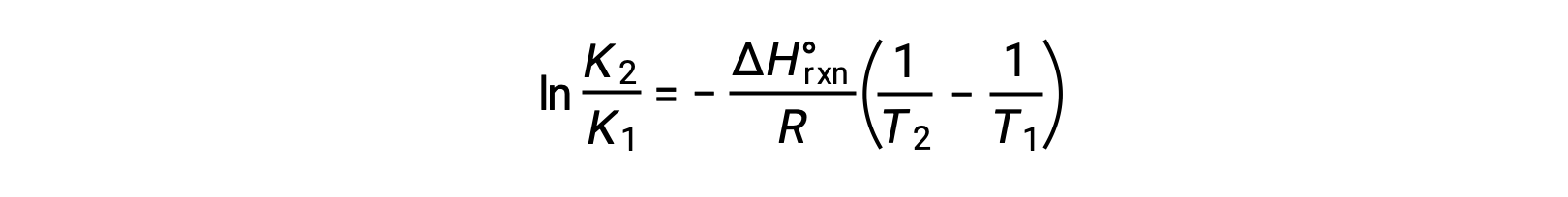
Este texto é adaptado de Openstax, Chemistry 2e, Chapter 16.4: Free Energy.
