17.10:
Serbest Enerji ve Denge
17.10:
Serbest Enerji ve Denge
Bir işlemin serbest enerji değişimi, itici gücünün bir ölçüsü olarak görülebilir. ΔG için negatif bir değer, ileri yönde işlem için bir itici gücü temsil ederken, pozitif bir değer ters yönde işlem için bir itici gücü temsil eder. ΔGrxn sıfır olduğunda, ileri ve geri itici kuvvetler eşittir ve işlem her iki yönde de aynı oranda gerçekleşir (sistem dengededir).
Q‘nun sistem için kütle eylem ifadesinin sayısal değeri olduğunu ve değerinin dengeyi sağlamak için bir reaksiyonun ilerleyeceği yönü tanımlamak için kullanılabileceğini hatırlayın. Q denge sabitinden daha küçük olduğunda, K, reaksiyon dengeye ulaşılana ve Q = K olana kadar ileri yönde devam edecektir. Tersine, eğer Q > K ise, denge sağlanana kadar süreç ters yönde ilerleyecektir.
Reaktanlarla ve standart olmayan koşullar altında bulunan ürünlerle (1 bar dışındaki basınçlar; 1 M dışındaki konsantrasyonlar) gerçekleşen bir işlem için serbest enerji değişimi, bu denkleme göre standart serbest enerji değişimi ile ilgilidir:
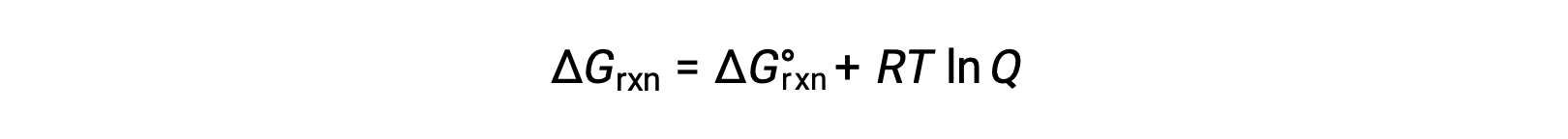
R gaz sabitidir (8.314 J/K mol), T kelvin veya mutlak sıcaklıktır ve Q reaksiyon katsayısıdır. Gaz fazı dengeleri için, basınca dayalı reaksiyon katsayısı Qp kullanılır. Konsantrasyona dayalı reaksiyon katsayısı, Qc, yoğunlaştırılmış faz dengesi için kullanılır. Bu denklem, herhangi bir koşul kümesi altında bir sürecin spontanlığını tahmin etmek için kullanılabilir
Dengede bir sistem için, Q = K ve ΔGrxn = 0 ve önceki denklem şu şekilde yazılabilir
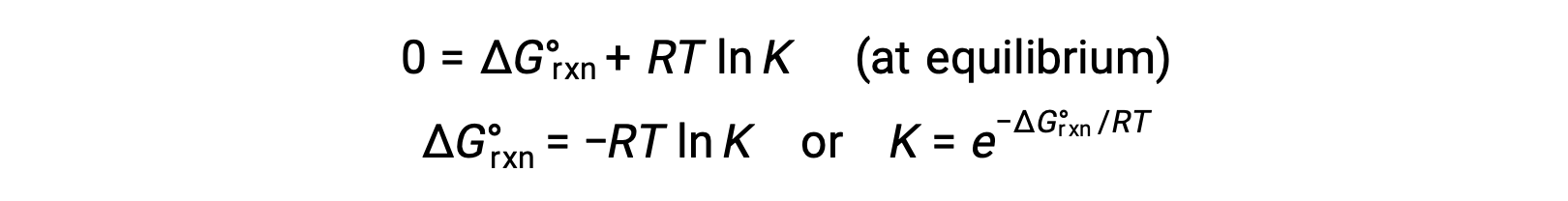
Denklemin bu formu, bu iki temel termodinamik özellik arasında yararlı bir bağlantı sağlar ve denge sabitlerini standart serbest enerji değişimlerinden elde etmek için kullanılabilir ve bunun tersi de geçerlidir. Standart serbest enerji değişimleri ve denge sabitleri arasındaki ilişkiler aşağıda özetlenmiştir.
K > 1 ise, ΔGºrxn < < 0 ve ürünler reaksiyon karışımında daha bol miktarda bulunur.
K < < 1 ise, ΔGºrxn > > 0 ve reaktifler reaksiyon karışımında daha bol miktarda bulunur.
K = 1,ΔGºrxn = 0 ve reaktifler ve ürünler reaksiyon karışımında nispeten bol miktarda bulunur.
Bir reaksiyon değişimi için standart serbest enerji sıcaklığa bağlıdır:
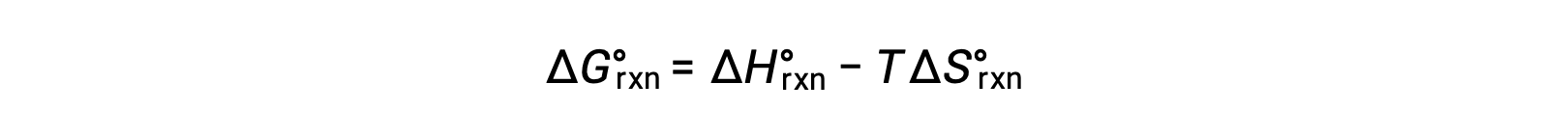
Bir reaksiyonun standart serbest enerji değişimi, reaksiyonun denge sabiti ile ilgilidir:
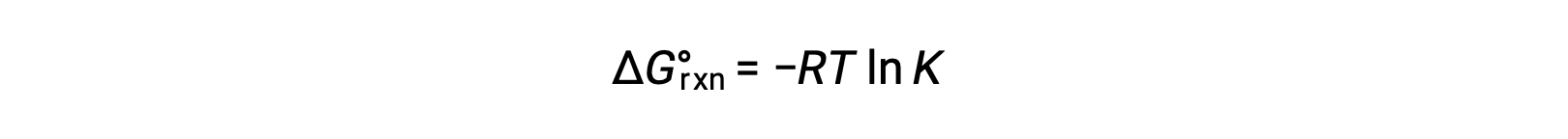
Bu iki ifadeyi birleştirsek:
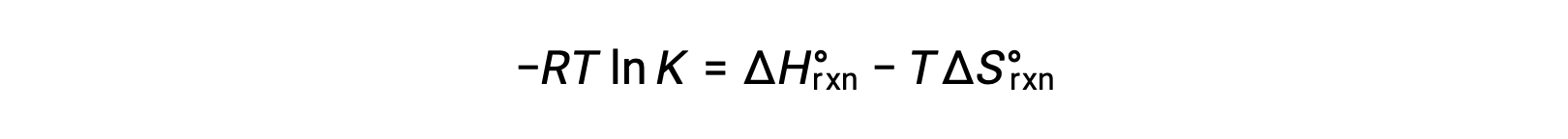
Her iki tarafı da RT‘ye bölersek

Yeniden düzenleme şunu verir
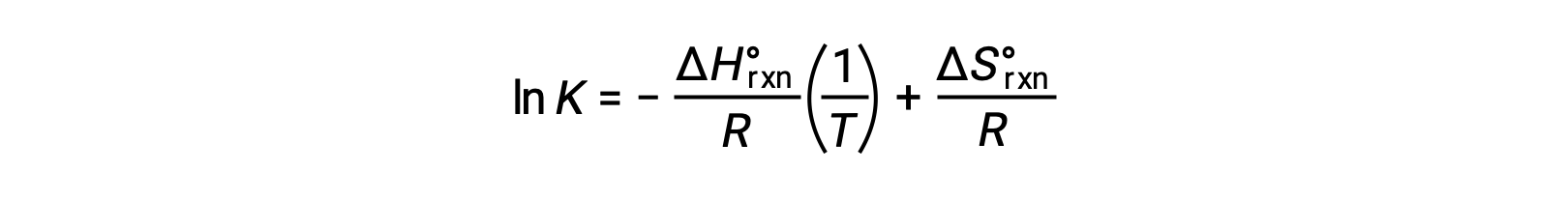
Denklem düz bir çizgi y = mx + b şeklini alır. 1/T ‘ye karşı çizilen bir ln K grafiği, −ΔHºrxn/R eğimi ve ΔSºrxn/R‘nin y kesişimi ile düz bir çizgi verir. Denklem ayrıca iki noktalı bir biçimde ifade edilebilir:
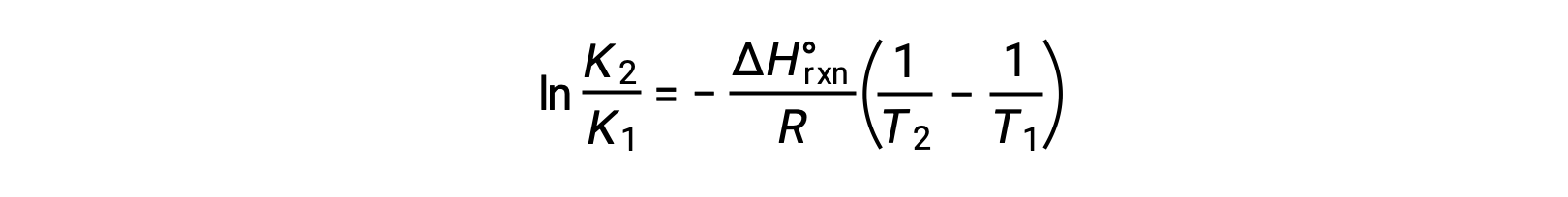
Bu metin bu kaynaktan uyarlanmıştır: Openstax, Chemistry 2e, Chapter 16.4: Free Energy.
