16.15:
منحنيات معايرة القاعدة الحمضية
16.15:
منحنيات معايرة القاعدة الحمضية
يعتبر منحنى المعايرة بالتحليل الحجمي مخططًا لبعض خصائص المحلول مقابل كمية المعايرة المضافة. بالنسبة لمعايرة حمض-قاعدة، يعتبر الرقم الهيدروجيني للمحلول خاصية مفيدة للمراقبة لأنها تختلف بشكل متوقع مع تركيبة المحلول، وبالتالي، يمكن استخدامها لرصد تقدم المعايرة’ واكتشاف نقطة نهايتها. يمكن إجراء معايرة القاعدة الحمضية بحمض قوي وقاعدة قوية، وحمض قوي وقاعدة ضعيفة، أو قاعدة قوية وحمض ضعيف.
بالنسبة للمعايرة التي تم إجراؤها لـ 25.00 مل من 0.100 مول HCl (حمض قوي) مع 0.100 مول من NaOH قاعدة قوية، يمكن رؤية منحنى المعايرة باللون الأحمر في الشكل 1 أ. بالنسبة للمعايرة التي تم إجراؤها لـ 25.00 مل من 0.100 مول CH3COOH (حمض ضعيف) مع 0.100 مول NaOH، يمكن رؤية منحنى المعايرة باللون الأصفر في الشكل 1 ب.
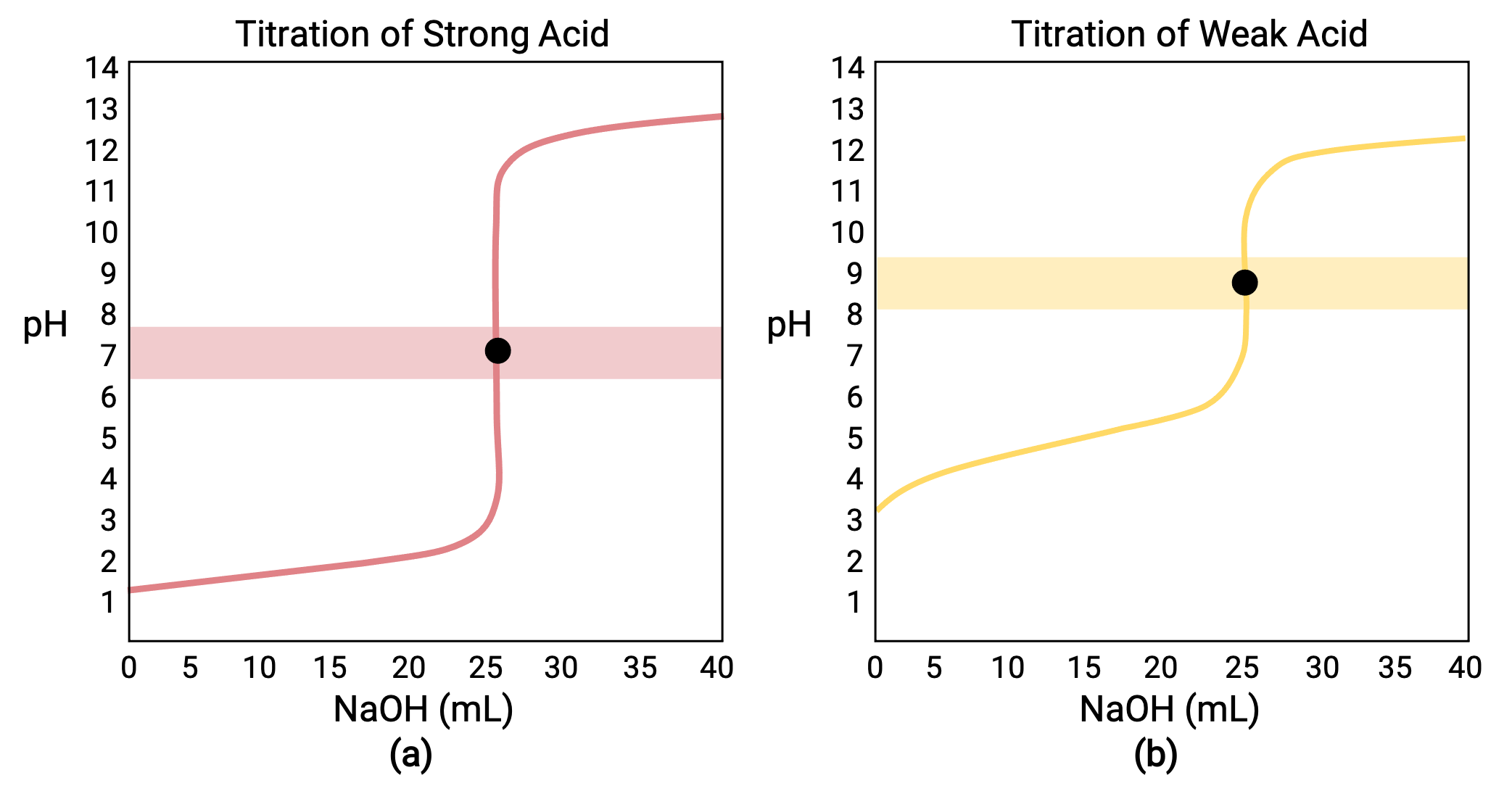
الشكل 1 (أ) يحتوي منحنى المعايرة للمعايرة بمقدار 25.00 مل من 0.100 مول HCl (حمض قوي) مع 0.100 مول NaOH (قاعدة قوية) على نقطة تكافؤ قدرها 7.00 رقم هيدروجيني (pH). (ب) يحتوي منحنى المعايرة للمعايرة بمقدار 25.00 مل من حمض أسيتيك 0.100 مول (حمض ضعيف) مع 0.100 مول هيدروكسيد الصوديوم (قاعدة قوية) على نقطة تكافؤ تبلغ 8.72 رقم هيدروجيني (pH).
المعايرة لقاعدة قوية أو ضعيفة بحمض قوي لها منحنى مماثل على شكل حرف S؛ ومع ذلك، ينقلب المنحنى حيث يبدأ الأس الهيدروجيني في المنطقة الأساسية وينخفض مع إضافة الحمض القوي. يمكن أيضًا استخدام معايرة الحمض الضعيف أو القاعدة لتحديد Ka أو Kb، على التوالي.
المراحل الأربع للمعايرة بالتحليل الحجمي:
- الحالة الأولية (حجم المعايرة المضافة = 0 مل): يتم تحديد الأس الهيدروجيني بواسطة الحمض الذي يتم معايرته ؛ نظرًا لأن العينات الحمضية مركزة بشكل متساوٍ، فإن الحمض الضعيف سيُظهر درجة حموضة أولية أكبر
- نقطة التكافؤ المسبق (0 مل < V < 25 مل): يزداد الرقم الهيدروجيني للمحلول تدريجيًا ويستهلك الحمض بالتفاعل مع محلول معاير مضاف؛ تشتمل التركيبة على حمض غير متفاعل ومنتج التفاعل وقاعدته المترافقة
- نقطة التكافؤ (V = 25 مل): لوحظ ارتفاع حاد في الرقم الهيدروجيني عندما ينتقل تكوين المحلول من حامضي إلى محايد (لعينة الحمض القوية) أو قاعدي (لعينة الحمض الضعيف)، مع تحديد الرقم الهيدروجيني بواسطة تأين القاعدة المترافقة للحمض
- نقطة ما بعد التكافؤ (V>؛ 25 مل): يتم تحديد الرقم الهيدروجيني من خلال مقدار الزيادة في المعايرة الأساسية القوية المضافة ؛ نظرًا لأن كلا العينتين تمت معايرتهما بنفس المعاير، فإن كلا منحني المعايرة يظهران متشابهين في هذه المرحلة.
هذا النص مقتبس من Openstax, Chemistry 2e, Section 14.7: Acid-base Titrations.
Suggested Reading
- Ramette, Richard W. "TITRATE: A Learning Tool for Acid-Base Titrations." (1994): 238. https://pubs.acs.org/doi/pdf/10.1021/ed071p238.2
