16.15:
Curvas de Titulación Ácido-Base
16.15:
Curvas de Titulación Ácido-Base
Una curva de titulación es un gráfico de alguna propiedad de solución frente a la cantidad de titulante añadido. Para las titulaciones ácido-base, el pH de la solución es una propiedad útil de monitorizar porque varía de forma predecible con la composición de la solución y, por lo tanto, puede utilizarse para controlar el progreso de la titulación y detectar su punto final. La titulación ácido-base se puede realizar con un ácido fuerte y una base fuerte, un ácido fuerte y una base débil, o una base fuerte y un ácido débil.
Para una titulación realizada para 25,00 ml de HCl 0,100 M (ácido fuerte) con 0,100 M de base fuerte NaOH, su curva de titulación puede verse en rojo en la Figura 1a. Para una titulación realizada para 25,00 ml de CH3COOH 0,100 M (ácido débil) con NaOH 0,100 M, su curva de titulación puede verse en amarillo en la Figura 1b.
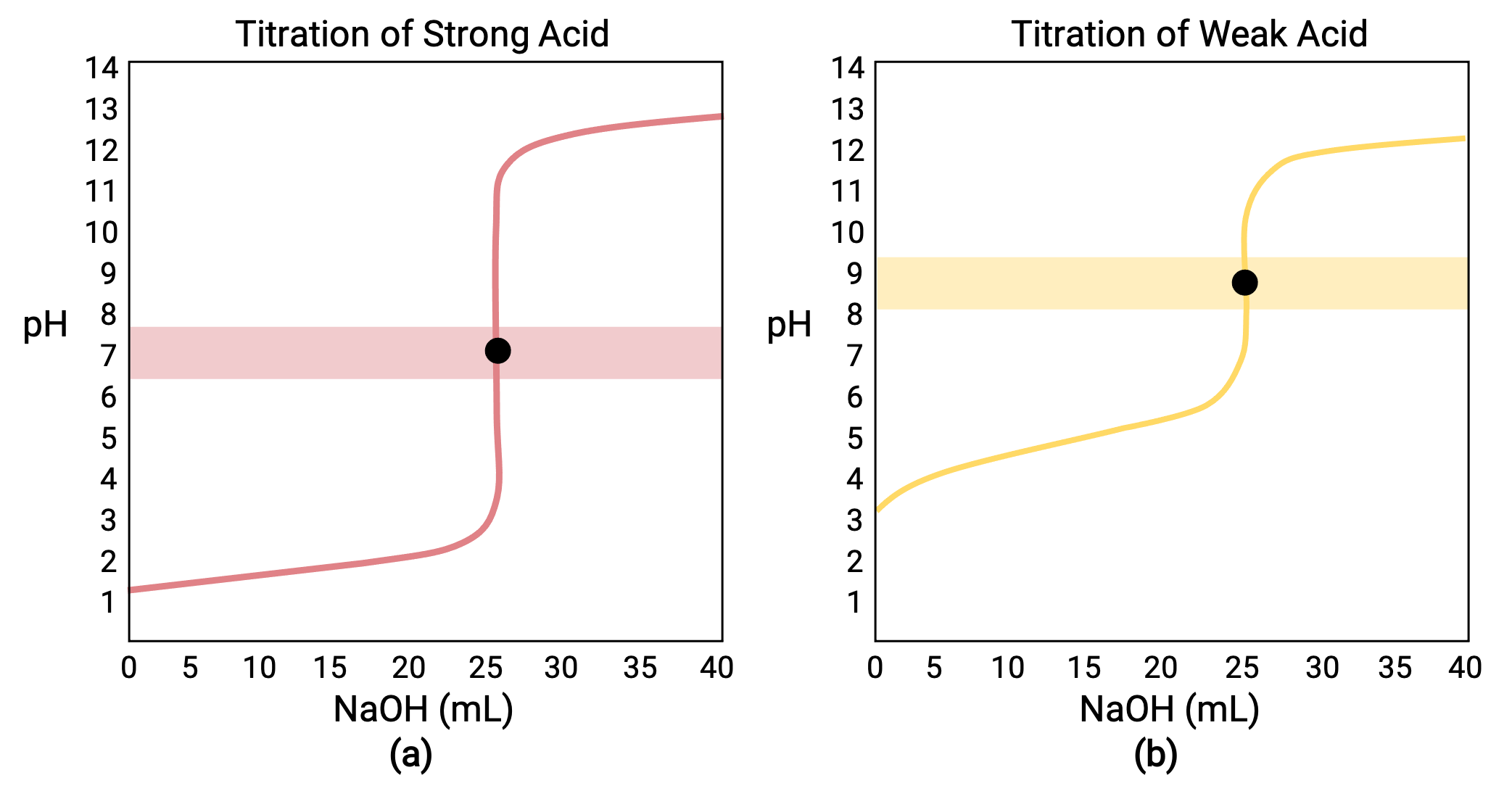
Figura 1 a) La curva de titulación para la titulación de 25,00 ml de HCl 0,100 M (ácido fuerte) con NaOH 0,100 M (base fuerte) tiene un punto de equivalencia de pH 7,00. b) La curva de titulación para la titulación de 25,00 ml de ácido acético 0,100 M (ácido débil) con NaOH 0,100 M (base fuerte) tiene un punto de equivalencia de pH 8,72.
La titulación de una base fuerte o débil con un ácido fuerte tiene una curva similar en forma de S; sin embargo, la curva se invierte ya que el pH comienza en la región básica y disminuye con la adición del ácido fuerte. La titulación del ácido débil o de la base también se puede utilizar para determinar el Ka o el Kb, respectivamente.
Las cuatro etapas de una titulación:
- Estado inicial (volumen de titulante añadido = 0 ml): El pH se determina por el ácido que se está titulando; dado que las dos muestras de ácido están igualmente concentradas, el ácido débil mostrará un pH inicial mayor
- Punto de pre equivalencia (0 ml < V < 25 ml): El pH de la solución aumenta gradualmente y el ácido se consume por reacción con el titulante añadido; la composición incluye el ácido no reaccionado y el producto de reacción, su base conjugada
- Punto de equivalencia (V = 25 ml): Se observa un aumento drástico del pH cuando la composición de la solución pasa de ácido a neutro (para la muestra de ácido fuerte) o a básico (para la muestra de ácido débil), con pH determinado por ionización de la base conjugada del ácido
- Punto de post-equivalencia (V > 25 ml): El pH se determina por la cantidad de exceso de base fuerte titulante añadido; dado que ambas muestras se titulan con el mismo titulante, ambas curvas de titulación parecen similares en esta fase.
Este texto es adaptado de Openstax, Química 2e, Sección 14.7: Titulaciones ácido-base.
Suggested Reading
- Ramette, Richard W. "TITRATE: A Learning Tool for Acid-Base Titrations." (1994): 238. https://pubs.acs.org/doi/pdf/10.1021/ed071p238.2
