16.6: Asit-Baz Titrasyon Eğrileri
Bir titrasyon eğrisi, eklenen titrant miktarına karşı bazı çözelti özelliklerinin bir grafiğidir. Asit-baz titrasyonları için, çözelti pH'ı izlemek için yararlı bir özelliktir, çünkü çözelti bileşimi ile tahmin edilebilir şekilde değişir ve bu nedenle titrasyonun ilerlemesini izlemek ve son noktasını tespit etmek için kullanılabilir. Asit-baz titrasyonu, güçlü bir asit ve güçlü bir baz, güçlü bir asit ve zayıf bir baz veya güçlü bir baz ve zayıf bir asit ile gerçekleştirilebilir.
0,100 M güçlü bir baz NaOH ile 25,00 mL 0,100 M HCl (güçlü asit) için yapılan bir titrasyon için, titrasyon eğrisi Şekil 1a'da kırmızı olarak görülebilir. 0,100 M NaOH ile 25,00 mL 0,100 M CH3COOH (zayıf asit) için yapılan bir titrasyon için, titrasyon eğrisi Şekil 1b'de sarı renkte görülebilir.
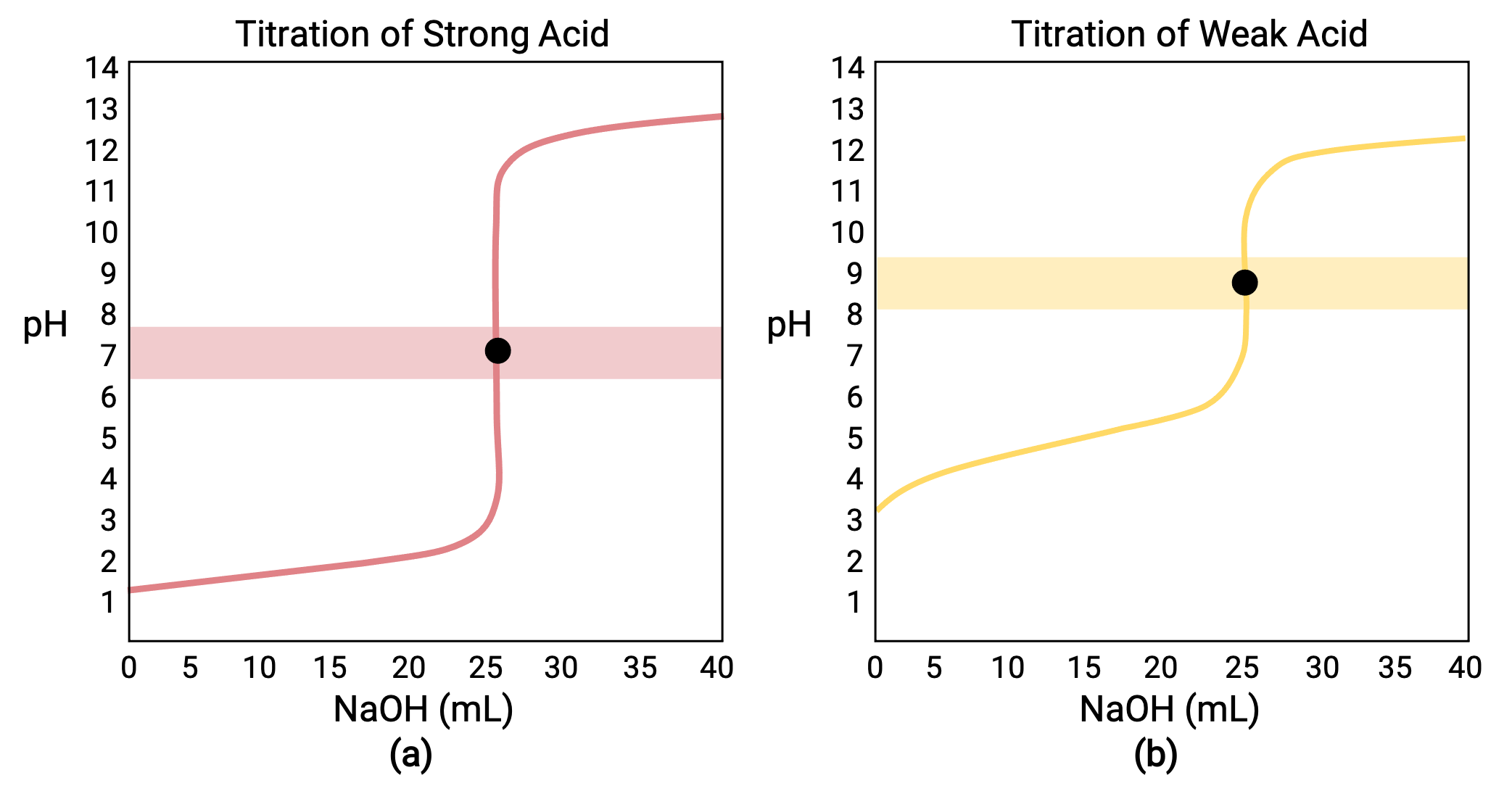
Şekil 1 (a) 0,100 M NaOH (güçlü baz) ile 25,00 mL 0,100 M HCl (güçlü asit) titrasyonu için titrasyon eğrisi 7,00 pH eşdeğerlik noktasına sahiptir. (b) 0,100 M NaOH (güçlü baz) ile 25,00 mL 0,100 m asetik asit (zayıf asit) titrasyonu için titrasyon eğrisi 8,72 pH eşdeğerlik noktasına sahiptir.
Güçlü veya zayıf bir bazın güçlü bir asitle titrasyonu benzer bir s-şekilli eğriye sahiptir; bununla birlikte, pH bazik bölgede başlayacağından ve güçlü asit ilavesiyle azalacağından eğri ters çevrilir. Zayıf asit veya baz titrasyonu, sırasıyla Ka veya Kb'yi belirlemek için de kullanılabilir.
Bir titrasyonun dört aşaması:
- Başlangıç durumu (eklenen titrant hacmi = 0 mL): pH, titre edilen asit tarafından belirlenir; iki asit örneği eşit derecede konsantre olduğundan, zayıf asit daha büyük bir başlangıç pH'ı gösterecektir
- Ön denklik noktası (0 mL < V < 25 mL): çözelti pH'ı kademeli olarak artar ve asit, ilave titrant ile reaksiyona girerek tüketilir; bileşim, reaksiyona girmemiş asit ve reaksiyon ürünü olan konjugat bazını içerir
- Denklik noktası (V = 25 mL): çözelti bileşimi asidikten nötr (güçlü asit numunesi için) veya bazik (zayıf asit numunesi için) geçiş yaparken pH'da keskin bir artış gözlenir ve pH, asidin konjugat bazının iyonizasyonu ile belirlenir
- Denklik sonrası nokta (V > 25 mL): pH, eklenen fazla güçlü baz titrant miktarı ile belirlenir; her iki örnek de aynı titrant ile titre edildiğinden, her iki titrasyon eğrisi de bu aşamada benzer görünür.
Bu metin bu kaynaktan uyarlanmıştır: Openstax, Chemistry 2e, Section 14.7: Acid-base Titrations.


