16.15:
산-염기 적정곡선
A subscription to JoVE is required to view this content. Sign in or start your free trial.
JoVE Core
Chemistry
Acid-Base Titration Curves
산-염기 적정은 알려진 염기 농도를 사용하여 미지의 산 농도를 결정하기 위해 수행될 수 있으며 그 반대의 경우도 마찬가지입니다. 산을 염기로 적정할 때 적정제가 점차 산에 첨가되어 pH를 상승시킵니다. pH 변화가 베이스의 볼륨에 대해 플로팅되여 적정 또는 pH 곡선을 생성합니다.적정 곡선은 S형이지만 산의 농도에 따라 차이가 있습니다. 적정 시작 시 pH는 산성이지만 초기 산의 농도가 동일하다고 가정할 때 약한 산의 경우 더 높습니다. 당량점은 염기의 몰이 용액의 산의 몰과 같아지는 적정 곡선의 점입니다.강한 산의 경우 강한 염기가 강한 산에서 생성된 모든 하이드로늄 이온을 중화시킬 때 당량점에 도달합니다. 결국 항상 pH 7에서 발생합니다. 반대로 약한 산의 당량점은 7보다 큰 pH에서 발생하며 모든 약한 산이 짝염기로 전환될 때 도달합니다.당량점 근처에서 용액의 pH가 갑자기 증가합니다. 그러나 약산 적정에서 이러한 급격한 pH 변화는 강산 적정만큼 가파르지 않습니다. 약산과 강산 모두에 대해 적정곡선의 당량점 이후의 pH는 과도한 강염기로 인해 점차 증가합니다.약산 적정 곡선의 다른 특징으로는 강하지 않은 완충 영역과 반 등가점이 있습니다. 강염기가 첨가되면 약산은 짝염기를 생성하여 완충액을 만듭니다. 이 완충 영역 내에 반등가점이 있습니다.이 점은 당량점에 도달하기 위해 필요한 염기 볼륨의 절반이 추가된 경우입니다. 여기서 약산의 농도는 그것의 짝염기와 같고 용액의 pH는 pKa와 같습니다 적정제로 강산을 사용하는 강염기 또는 약염기의 적정 곡선은 역 S자형이며 pH가 처음에는 높고 강산을 첨가하면 감소합니다.
16.15:
산-염기 적정곡선
적정 곡선은 추가 된 적의 양에 비해 일부 솔루션 속성의 플롯입니다. 산염-염기 적층의 경우, 용액 pH는 용액 조성에 따라 예측 가능하기 때문에 모니터링하는 데 유용한 특성이므로 적정의 진행 상황을 모니터링하고 종점을 감지하는 데 사용될 수 있다. 산염-염기 적층은 강한 산과 강한 염기, 강한 산 및 약한 염기, 또는 강한 염기 및 약한 산으로 수행될 수 있다.
0.100M HCl(강한산)의 25.00mL에 대해 0.100MHCl(강한 산)을 탑재한 적정의 경우, 그 적정 곡선은 도 1a에서빨간색으로 볼 수 있다. 0.100 M NAOH가 있는 0.100 M CH3COOH(약한 산)의 25.00 mL에 대해 수행된 적정의 경우, 그 적정 곡선은 도 1b에서노란색으로 볼 수 있다.
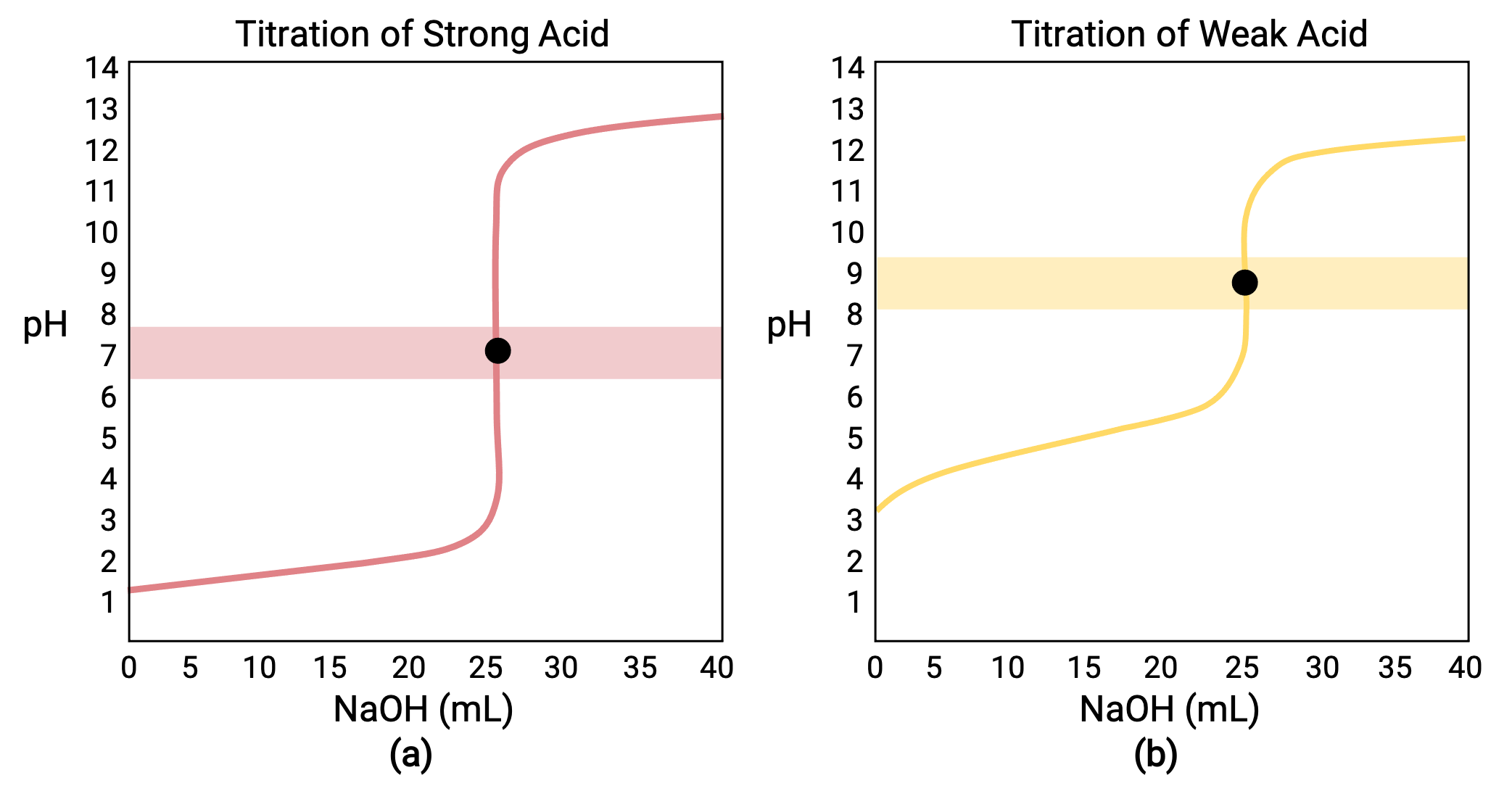
도 1 (a) 0.100 M HCl(강한 산)의 25.00 mL의 적정곡선은 0.100M NaOH(강한 염기)를 7.00pH의 등가점을 가한다. (b) 0.100M 의 적정곡선은 0.100M 의 적정(약한 산)을 0.100M NaOH(강한 염기)로 8.72pH의 등가점을 가지고 있다.
강한 산을 가진 강하거나 약한 염기의 적정은 유사한 S 자형 곡선을 가지고; 그러나, pH가 기본 영역에서 시작하여 강한 산의 첨가와 함께 감소함에 따라 곡선이 반전된다. 약한 산 또는 염기의 적정은 또한 Ka 또는 Kb를각각 결정하기 위하여 이용될 수 있다.
적정의 네 단계:
- 초기 상태(추가 된 적부피 = 0 mL): pH는 적정되는 산에 의해 결정됩니다. 2개의 산 시료가 동등하게 농축되기 때문에, 약한 산은 더 큰 초기 pH를 나타낼 것입니다
- 사전 동등점(0mL & V&25 mL): 용액 pH가 점차 증가하고 산은 첨가된 적성과 반응에 의해 소모됩니다. 조성물은 비반응산 및 반응 제품, 그 컨쥬게이트 베이스를 포함한다.
- 등가점(V =25mL): pH의 급격한 상승은 산성에서 중성(강한 산 시료의 경우) 또는 기본(약한 산 시료의 경우)으로 전환됨에 따라 pH의 급격한 상승이 관찰되며, pH는 산의 컨쥬게이트 베이스의 이온화에 의해 결정됩니다.
- 포스트 등가 점(V> 25 mL): pH는 과도한 강한 베이스 티트란트의 양에 의해 결정됩니다. 두 샘플 모두 동일한 적판으로 적정되어 있기 때문에 두 적정 곡선이 이 단계에서 유사하게 나타납니다.
Suggested Reading
- Ramette, Richard W. "TITRATE: A Learning Tool for Acid-Base Titrations." (1994): 238. https://pubs.acs.org/doi/pdf/10.1021/ed071p238.2
