16.15:
Curve di titolazione acido-base
16.15:
Curve di titolazione acido-base
Una curva di titolazione è un grafico di alcune proprietà della soluzione rispetto alla quantità di titolazione aggiunta. Per le titolazioni acido-base, il pH della soluzione è una proprietà utile da monitorare perché varia prevedibilmente con la composizione della soluzione e, quindi, può essere utilizzato per monitorare lo stato di avanzamento della titolazione e rilevarne l’endpoint. La titolazione acido-base può essere eseguita con un acido forte e una base forte, un acido forte e una base debole, o una base forte e un acido debole.
Per una titolazione effettuata per 25,00 mL di 0,100 M HCl (acido forte) con 0,100 M di una base forte NaOH, la sua curva di titolazione può essere vista in rosso nella figura 1a. Per una titolazione effettuata per 25,00 mL di 0,100 M CH3COOH (acido debole) con 0,100 M NaOH, la sua curva di titolazione può essere vista in giallo nella figura 1b.
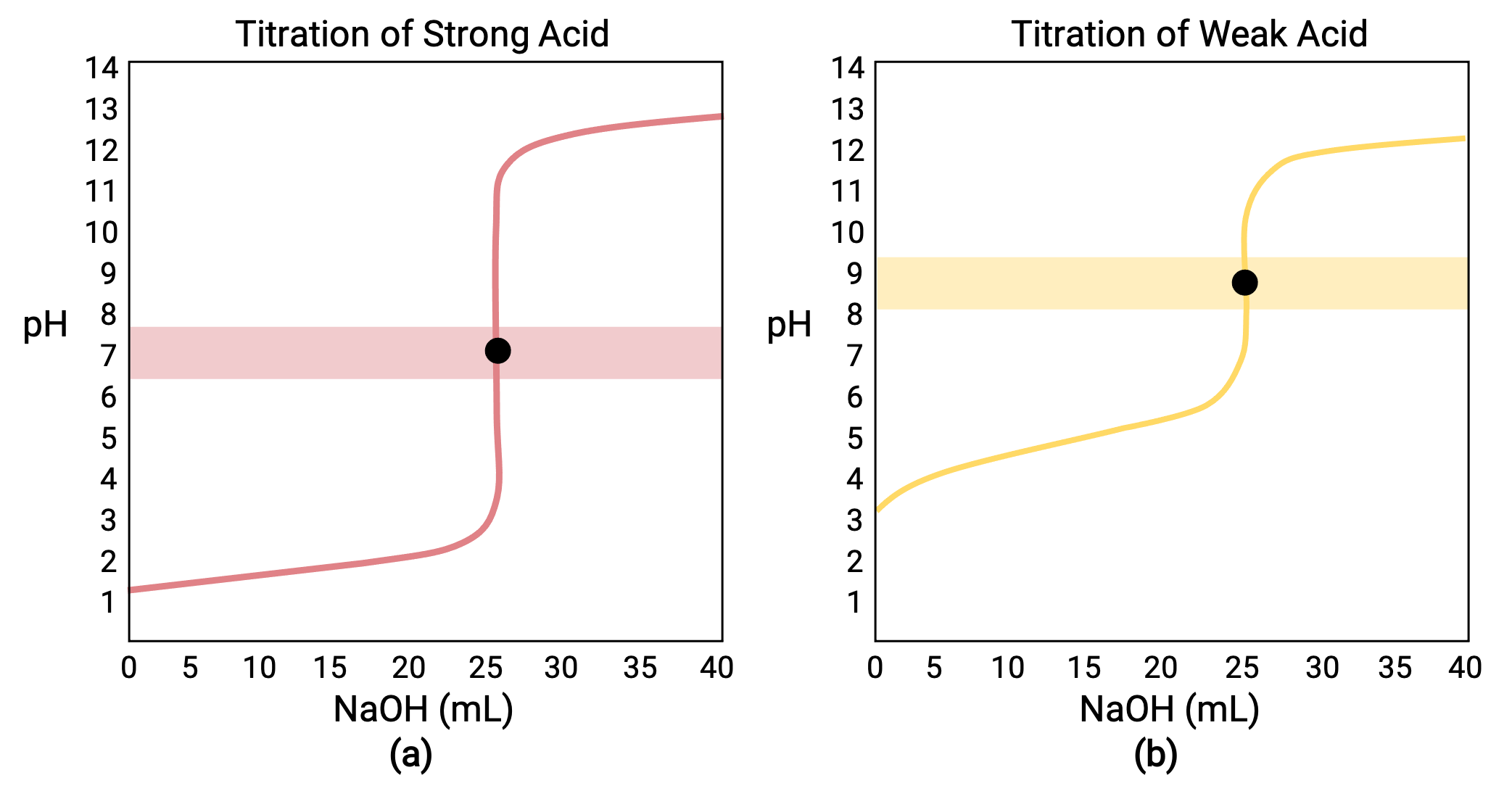
Figura 1 a) La curva di titolazione per la titolazione di 25,00 mL di 0,100 M HCl (acido forte) con NaOH 0,100 M (base forte) ha un punto di equivalenza di 7,00 pH. b) La commissione per l’agricoltura e lo sviluppo La curva di titolazione per la titolazione di 25,00 mL di acido acetico 0,100 M (acido debole) con 0,100 M NaOH (base forte) ha un punto di equivalenza di 8,72 pH.
La titolazione di una base forte o debole con un acido forte ha una curva simile a forma di S; tuttavia, la curva è invertita poiché il pH inizierà nella regione di base e diminuirà con l’aggiunta dell’acido forte. La titolazione di acido debole o base può anche essere utilizzata per determinare rispettivamente Ka o Kb .
Le quattro fasi di una titolazione:
- Stato iniziale (volume di titolazione aggiunto = 0 mL): il pH è determinato dall’acido titolato; poiché i due campioni di acido sono ugualmente concentrati, l’acido debole sporrà di un maggiore pH iniziale
- Punto di pre-equivalenza (0 mL < V < 25 mL): il pH della soluzione aumenta gradualmente e l'acido viene consumato per reazione con titolazione aggiunta; composizione comprende l'acido non reatto e il prodotto di reazione, la sua base coniugata
- Punto di equivalenza (V = 25 mL): si osserva un drastico aumento del pH come la composizione della soluzione passa da acida a neutra (per il campione di acido forte) o di base (per il campione di acido debole), con pH determinato dalla ionizzazione della base coniugata dell’acido
- Punto di post-equivalenza (V > 25 mL): il pH è determinato dalla quantità di titolazione di base forte in eccesso aggiunta; poiché entrambi i campioni sono titolazione con lo stesso titolazione, entrambe le curve di titolazione appaiono simili in questa fase.
Questo testo è adattato da Openstax, Chimica 2e, Sezione 14.7: Titolazioni acido-base.
Suggested Reading
- Ramette, Richard W. "TITRATE: A Learning Tool for Acid-Base Titrations." (1994): 238. https://pubs.acs.org/doi/pdf/10.1021/ed071p238.2
