10.5:
구조이성질현상
A subscription to JoVE is required to view this content. Sign in or start your free trial.
JoVE Core
Chemistry
Structural Isomerism
이성질체는 분자식은 같지만 구조 배열이 다른 화합물입니다. 각 이성질체는 뚜렷한 물리적, 화학적 특성을 가지고 있습니다. 조정 화합물에서 관찰되는 이성질체의 한 종류는 구조적 이성질체입니다.구조 이성질체에서 원자와 중심 금속 원자의 연결성은 분자식이 동일함에도 불구하고 다릅니다. 또한 배위권 이성질체와 연결 이성질체로 분류할 수 있습니다. 배위권 이성질체는 배위권에서 중심 금속과 배위된 리간드가 격자 내의 반대 이온과 위치를 교환할 때 발생합니다.따라서 금속 이온의 배위수가 일정하게 유지되며 배위권 및 화합물의 구성은 변경됩니다. 코발트의 배위 화합물에서 브로민을 리간드 또는 염소로 하여 두 개의 배위권 이성질체가 가능합니다. 화합물의 구성이 다르기 때문에 이 이성질체들은 각기 다른 화학적 특성을 가지고 있습니다.물에 용해되면 펜타민브로모코발트 염화물은 염화물 이온을 생성하고 펜타민 클로로코발트 브롬화물은 용액에서 브롬화 이온을 생성합니다. 반면에 결합 이성질체는 리간드가 두 가지 다른 방향으로 중심 금속 원자와 배위할 수 있을 때 발생합니다. 따라서 하나 이상의 잠재적인 공여 원자를 가진 한자리 리간드는 연결 이성 질화가 가능합니다.어떤 공여 원자가 금속 이온과 배위하는지에 따라 리간드의 이름이 변경됩니다. 아질산염 이온은 두 개의 단일 전자 쌍을 가지고 있는데 하나는 질소 원자에 하나는 산소 원자에 있습니다. 이들 중 하나는 중심 금속 이온과 배위 공유 결합을 형성할 수 있습니다.아질산염 이온이 질소 원자의 고독한 전자 쌍을 통해 배위할 때 니트로 리간드를 형성합니다. 산소 원자가 공여 원자 역할을 할 때 그것은 니트로 리간드를 형성합니다. 아질산염 이온과 코발트 금속의 배위 화합물은 노란색의 펜타암미네이트로코발트(III)와 주황색의 펜타암미네이트로코발트(III)의 두 가지 가능한 결합 이성질체를 가지고 있습니다.
10.5:
구조이성질현상
복합체의 이소머리즘
이소머스는 동일한 화학 적 수식을 가진 다른 화학 종입니다. 조정 화합물의 구조적 이소성은 두 개의 하위 범주, 연결 이소머 및 조정 구 이소머로 나눌 수 있습니다.
링키지 이소마는 조정 화합물이 두 개의 서로 다른 원자를 통해 전이 금속 센터에 결합할 수 있는 리간드를 함유할 때 발생합니다. 예를 들어, CN– 리간드 탄소 원자를 통해 또는 질소 원자를 통해 결합 할 수 있습니다. 마찬가지로, SCN– 유황 또는 질소 원자를 통해 바인딩 될 수 있습니다. 연결 이소성 신경을 할 수있는 몇 가지 다른 리간드가 도 1에 표시됩니다. 이소성 신경증을 연결할 수 있는 리간드의 명칭은 어떤 기증자 원자가 금속 이온과 결합되는지에 달려 있습니다. 예를 들어, CN– 리간드탄소 원자를 통해 바인딩시아노라고, 질소 원자를 통해 바인딩 같은 리간드이 isocyano라고하는 동안.
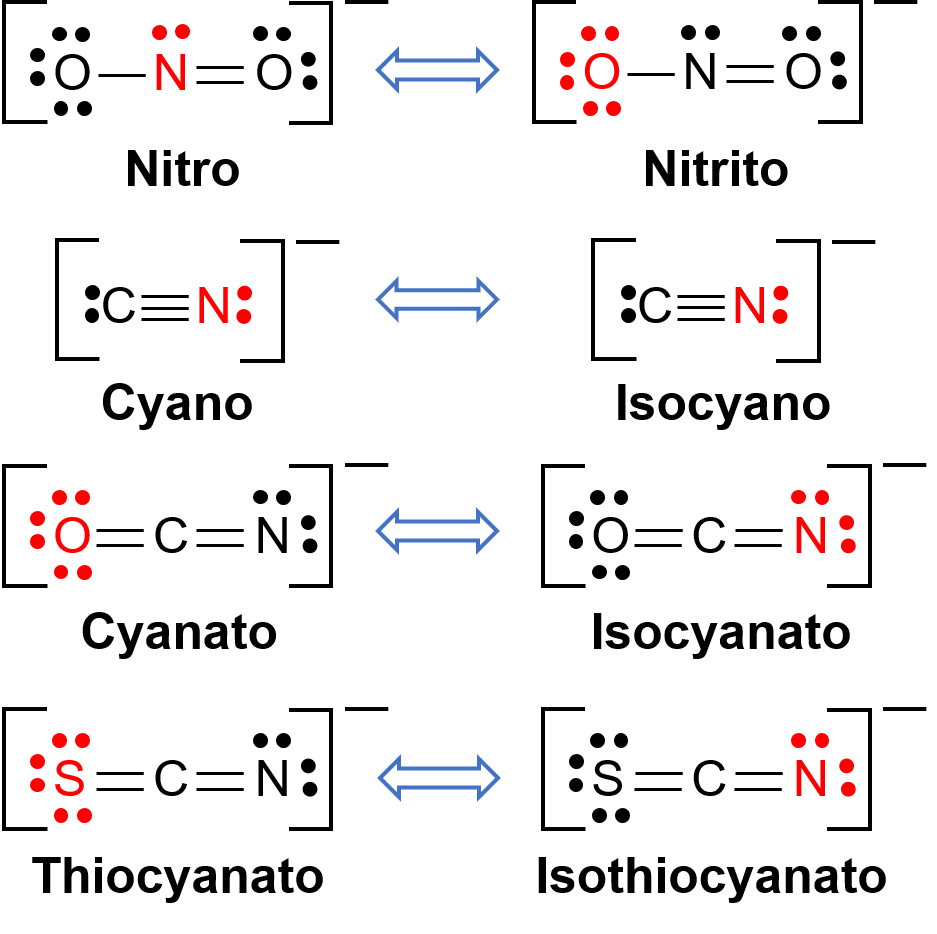
그림 1. 연결 이소성 을 할 수있는 다른 리간드의 목록. 리간드 분자에서, 적색의 원자는 중앙 금속 원자에 결합합니다.
조정 구 이소머(또는 이온화 이소머)는 내부 협응구에서 하나의 이온리간구가 외부 협응구로부터 카운터 이온으로 대체될 때 발생한다. 두 조정 구 이소의 간단한 예는 [CoCl 6][Br] 및 [CoCl5Br][Cl]입니다.
Tags
Structural IsomerismIsomersMolecular FormulaConnectivitiesCoordination CompoundsCoordination-sphere IsomersLinkage IsomersLigandCentral Metal AtomCoordination NumberCompositionCounterionLatticeChemical PropertiesCobalt ComplexBromineChlorinePentaamminebromocobalt(II) ChloridePentaamminechlorocobalt(II) BromideLinkage IsomerismMonodentate LigandsDonor Atom
