10.5:
Структурная изомерия
10.5:
Структурная изомерия
Изомеризм в комплексах
Изомеры — это различные химические виды, которые имеют одинаковую химическую формулу. Структурный изомеризм координационных соединений можно разделить на две подкатегории, соединительное изомеры и координато-сферные изомеры.
Изомеры связности возникают, когда координационное соединение содержит лиганд, который может соединиться с центром переходного металла через два разных атома. Например, лиганд CN может связываться через атом углерода или через атом азота. Аналогичным образом, SCN может быть связан через атом серы или азота. На рисунке 1 показаны несколько различных лигандов, способных к изомеризму рычажного механизма. Номенклатура лигандов, способных соединить изомеризм, зависит от того, какой атом донора связан с ионом металла. Например, лиганд, связанный через атом углерода, называется циано, в то время как тот же лиганд, связанный через атом азота, называется изоциано.
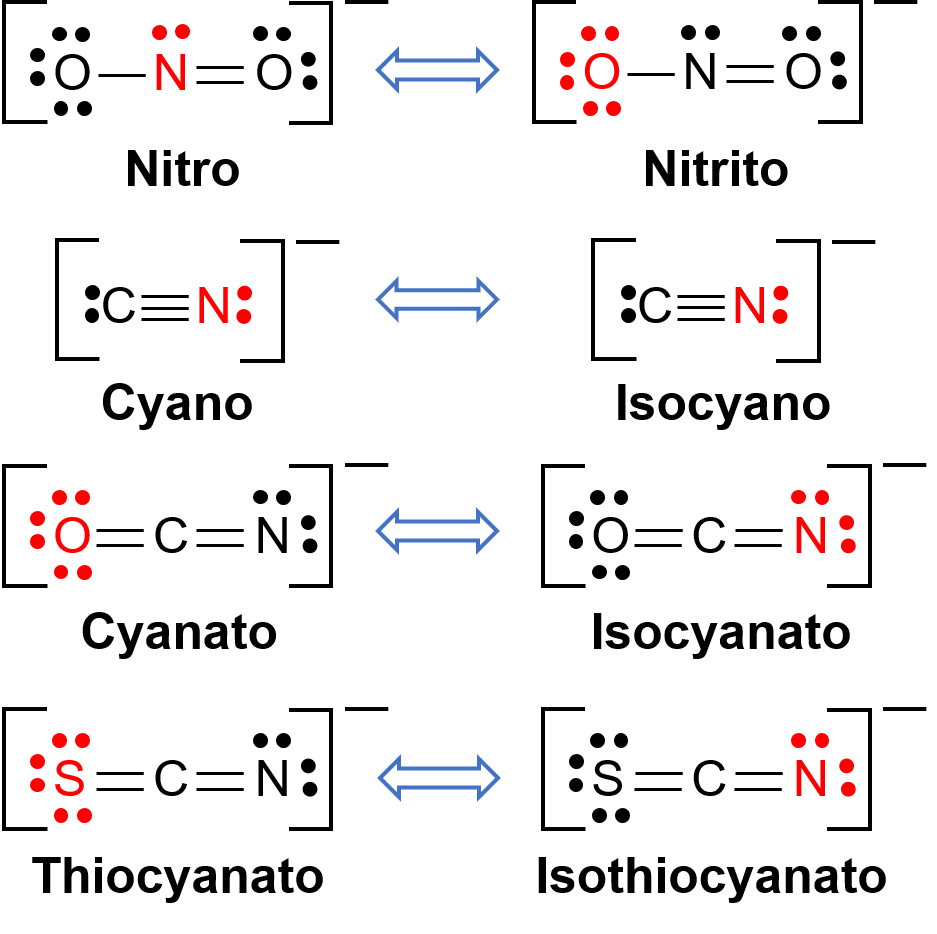
Рисунок 1. Список различных лигандов, способных к связке изомеризма. В молекуле лиганда атом красного связывается с центральным атомом металла.
Координационные сферные изомеры (или ионизационные изомеры) происходят, когда одна анионная лиганда во внутренней координационной сфере заменяется контрионом из внешней координационной сферы. Простым примером двух изомеров координационной сферы являются [CoCl6][br] и [CoCl5Br][CL].
Этот текст адаптирован из Openstax, Химия 2е изд., Section19.2: Координация химии переходных металлов.
