10.5:
Isomérie structurelle
10.5:
Isomérie structurelle
Isomérisme dans les complexes
Les isomères sont des espèces chimiques différentes qui ont la même formule chimique. L’isomérisme structural des composés de coordination peut être divisé en deux sous-catégories, les isomères de liaison et les isomères de la sphère de coordination.
Les isomères de liaison se rencontrent lorsque le composé de coordination contient un ligand qui peut se lier au métal de transition central par le biais de deux atomes différents. Par exemple, le ligand CN− peut se lier par le biais de l’atome de carbone ou de l’atome d’azote. De même, SCN− peut être lié par l’atome de soufre ou d’azote. Quelques ligands différents capables d’isomérisme de liaison sont illustrés dans la figure 1. La nomenclature des ligands capables d’isomérisme de liaison dépend de l’atome donneur qui est lié à l’ion métallique. Par exemple, un ligand CN− lié par l’atome de carbone est appelé cyano, alors que le même ligand lié par un atome d’azote est appelé isocyano.
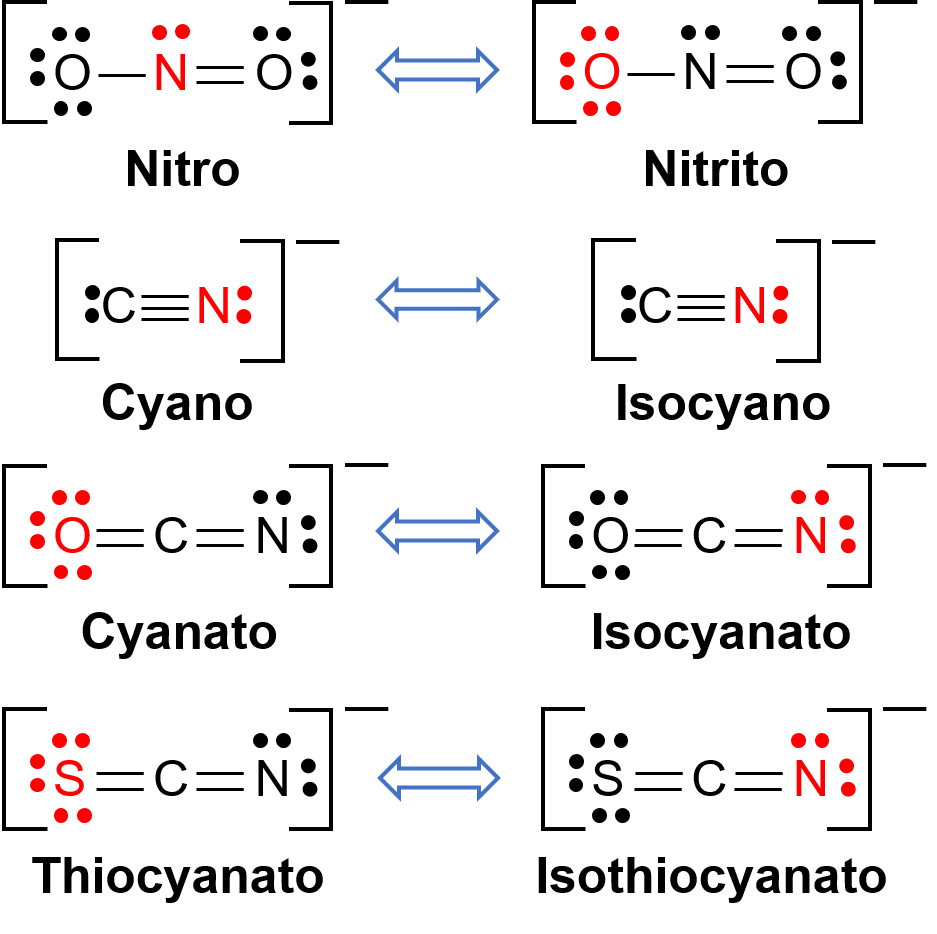
Figure 1. Liste des différents ligands capables d’isomérisme de liaison. Dans la molécule de ligand, l’atome en rouge se lie à l’atome métallique central.
Les isomères de la sphère de coordination (ou isomères d’ionisation) se produisent lorsqu’un ligand anionique dans la sphère de coordination interne est remplacé par le contre-ion de la sphère de coordination externe. Un exemple simple de deux isomères de la sphère de coordination est [CoCl6][Br] et [CoCl5Br][Cl].
Ce texte est adapté de Openstax, Chimie 2e, Section19.2 : Chimie de coordination des métaux de transition.
