10.5:
Isomeria strutturale
10.5:
Isomeria strutturale
Isomerismo nei complessi
Gli isomeri sono diverse specie chimiche che hanno la stessa formula chimica. L’isomerismo strutturale dei composti di coordinazione può essere diviso in due sottocategorie, gli isomeri di collegamento e gli isomeri della sfera di coordinazione.
Gli isomeri di collegamento si verificano quando il composto di coordinazione contiene un ligando che può legarsi al centro del metallo di transizione attraverso due atomi diversi. Per esempio, il CN− ligando può legarsi attraverso l’atomo di carbonio o attraverso l’atomo di azoto. Allo stesso modo, SCN− può essere legato attraverso lo zolfo o l’atomo di azoto. Alcuni ligandi diversi in grado di collegare l’isomerismo sono mostrati nella figura 1. La nomenclatura dei ligandi in grado di collegare l’isomerismo dipende da quale atomo donatore è legato allo ione metallico. Per esempio, un CN− ligando legato attraverso l’atomo di carbonio è chiamato ciano, mentre lo stesso ligando legato attraverso un atomo di azoto è chiamato isociano.
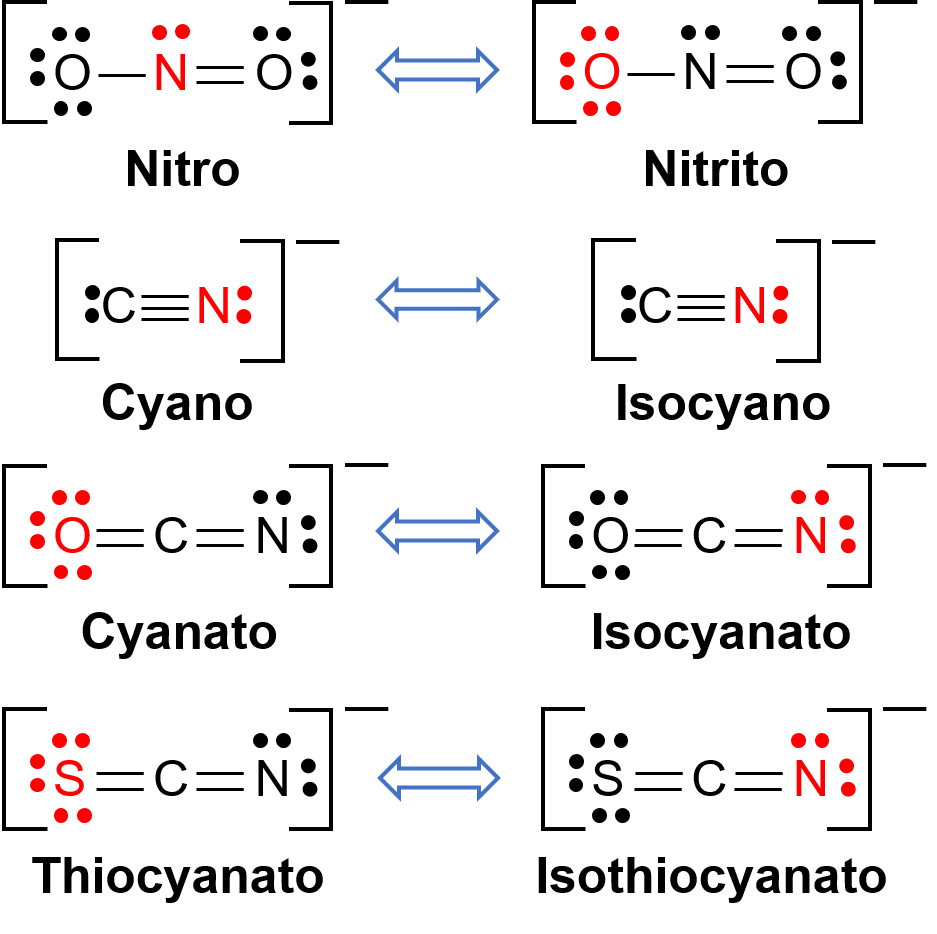
Figura 1. Lista di diversi ligandi capaci di collegare l’isomerismo. Nella molecola del ligando, l’atomo in rosso si lega all’atomo metallico centrale.
Gli isomeri della sfera di coordinazione (o isomeri di ionizzazione) si verificano quando un ligando anionico nella sfera di coordinazione interna viene sostituito con il contatore dalla sfera di coordinazione esterna. Un semplice esempio di due isomeri della sfera di coordinazione sono [CoCl6][Br] e [CoCl5Br][Cl].
Questo testo è adattato da Openstax, Chemistry 2e, Section19.2: Coordination Chemistry of Transition Metals.
