10.5:
التماكب البنيوي
10.5:
التماكب البنيوي
التماثل في المجمعات
الأيزومرات هي أنواع كيميائية مختلفة لها نفس الصيغة الكيميائية. يمكن تقسيم التماثل البنيوي لمركبات التنسيق إلى فئتين فرعيتين ، أيزومرات الارتباط وأيزومرات مجال التنسيق.
تحدثأيزومرات الارتباط عندما يحتوي مركب التنسيق على رابطة يمكنها الارتباط بمركز المعدن الانتقالي من خلال ذرتين مختلفتين. على سبيل المثال، يمكن أن تتحد ربيطة CN− من خلال ذرة الكربون أو من خلال ذرة النيتروجين. وبالمثل، يمكن ربط SCN− عبر ذرة الكبريت أو النيتروجين. يظهر في الشكل 1. عدد قليل من الروابط المختلفة القادرة على ربط تماثل الأيزومرية. وتعتمد تسميات الروابط القادرة على ربط الأيزومرية على ذرة المتبرع التي يتم ربطها بأيون المعدن. على سبيل المثال، يُطلق على ربيطة CN− المرتبط عبر ذرة الكربون اسم سيانو، بينما يُطلق على نفس الرابطة الرابطة عبر ذرة نيتروجين اسم إيزوسيانو
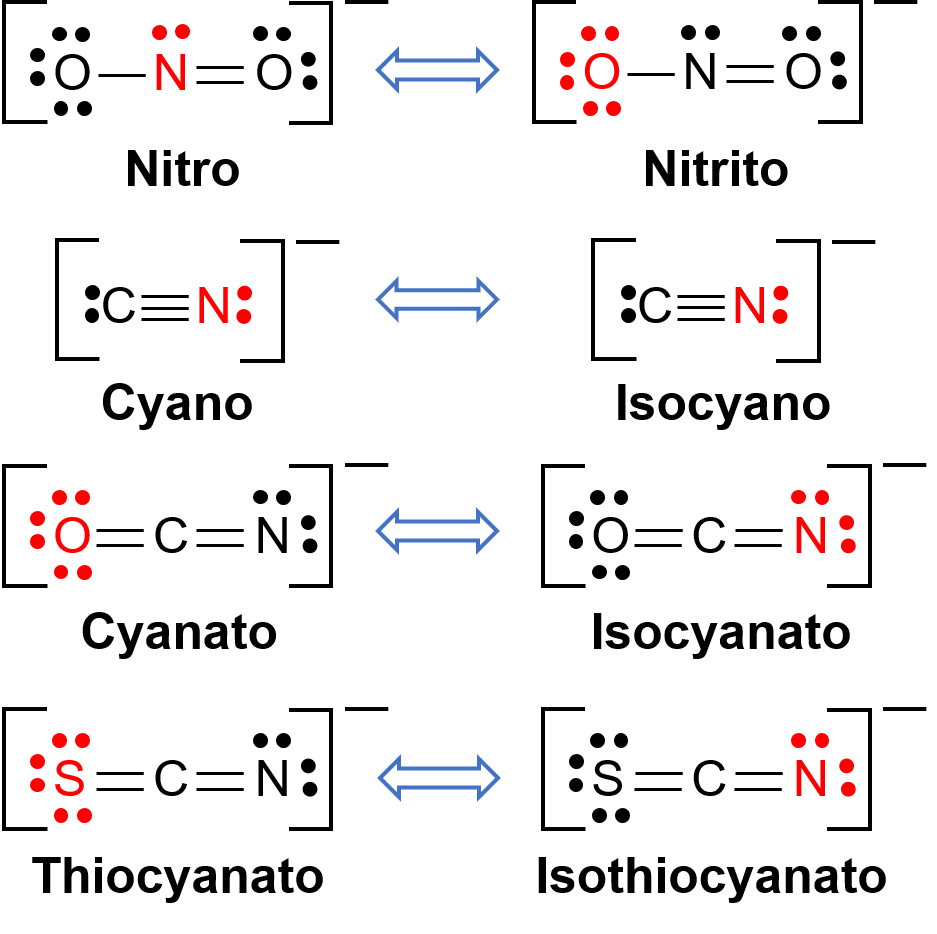
الشكل 1. قائمة مختلفة من الروابط القادرة على ربط التماثل. في جزيء الترابط، ترتبط الذرة الموجودة في اللون الأحمر بذرة المعدن المركزية.
تحدث أيزومرات كرة التنسيق (أو أيزومرات التأين) عندما يتم استبدال رابطة أنيونية واحدة في مجال التنسيق الداخلي بأيون مضاد من مجال التنسيق الخارجي. مثال بسيط لاثنين من أيزومرين في مجال التنسيق هما [CoCl6] [Br] و [CoCl5 Br] [Cl].
هذا النص مقتبس من Openstax, Chemistry 2e, Section19.2: Coordination Chemistry of Transition Metals.
