14.10:
小さい x の仮定
A subscription to JoVE is required to view this content. Sign in or start your free trial.
JoVE Core
Chemistry
The Small x Assumption
The small x assumption is an approximation that can be used under certain conditions to simplify solving the equilibrium expression and to avoid using the quadratic formula. If the equilibrium constant for a reaction is small and the initial concentrations of reactants are sufficiently high, it is possible that only a small amount of reactants will be converted into products. When these conditions are met, the equilibrium concentrations can be approximated using the assumption that the change in the initial concentrations is negligible. However, it must be confirmed that the change in concentration, x, is less than 5% of the initial concentrations to show the the assumption was valid. The decomposition of 0.66 molar carbonyl dichloride gas produces carbon monoxide and chlorine gas, and the equilibrium constant for this reaction is 2.2 × 10−10. To calculate the equilibrium concentrations, the values are tabulated in the ICE table along with the change and equilibrium concentrations. Substituting the equilibrium concentrations in the expression, K equals x squared divided by 0.66 minus x. As K is very small, the change in the initial concentration, x, of carbonyl dichloride is expected to be negligible. Therefore, 0.66 minus x can be approximated to 0.66. When solved, x equals 1.2 × 10−5 molar. Here, x is only 0.0018 percent of the initial 0.66 molar concentration of carbonyl dichloride, which is far less than the 5% maximum allowed. Thus, the small x assumption is valid here. Using the value for x in the ICE table, the equilibrium concentration of carbonyl dichloride is still 0.66 molar with significant figures, while the concentrations of carbon monoxide and chlorine are both 1.2 × 10−5 molar.
14.10:
小さい x の仮定
反応の平衡定数が小さい場合、その平衡は反応物側に有利になります。このようなKcの値が小さな反応では、反応物の初期濃度が高い場合には、濃度の変化が無視できるほど小さくなる場合があります。このような状況では、平衡濃度はその初期濃度にほぼ等しいです。 この推定は、いくつかの平衡濃度が初期濃度に等しいと仮定することで、平衡計算を簡略化するために使用することができます。ただし、この仮定をするためには、弱酸または弱塩基の濃度変化、つまりxが初期濃度の5%未満でなければなりません。もしxが5%以上であれば、二次式を使って平衡方程式を解く必要があります。
代数的に単純化した仮定による平衡濃度の計算
HCNの0.15 M溶液の平衡濃度はいくらでしょうか?
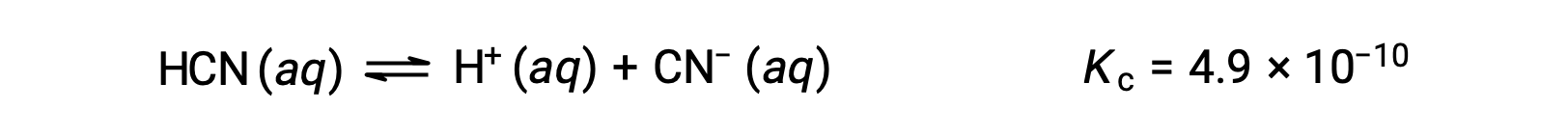
xを用いて平衡時の各生成物の濃度を表すと、このICE表のようになります。
| HCN (aq) | H+ (aq) | CN− (aq) | |
| 初期濃度 (M) | 0.15 | 0 | 0 |
| 濃度変化 (M) | −x | +x | +x |
| 平衡濃度 (M) | 0.15 − x | x | x |
平衡濃度の項をKcの式に代入します。
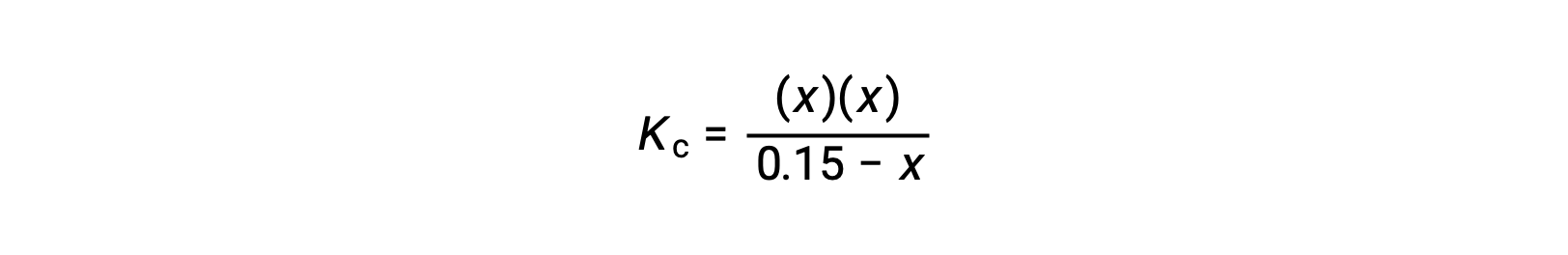
二次式に変形してxを解く。
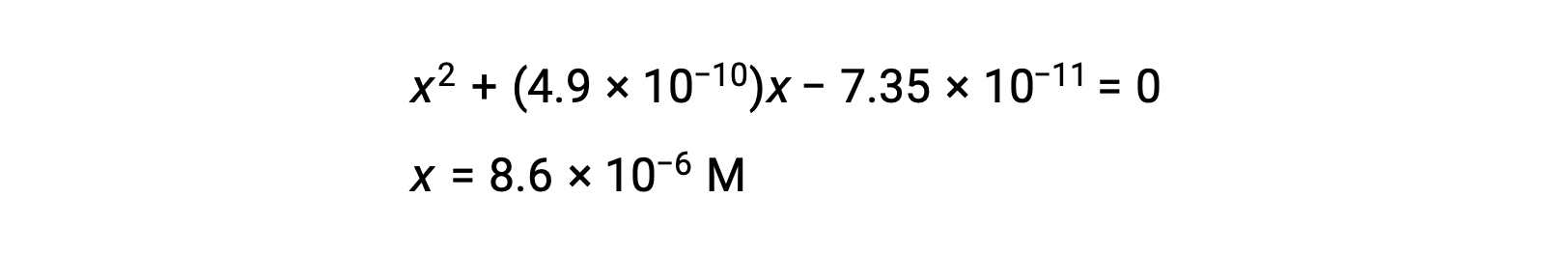
したがって、[H+] = [CN–] = x = 8.6 × 10–6 M、[HCN] = 0.15 – x = 0.15 Mとなります。
この場合、濃度の変化は初期濃度よりもかなり小さく(Kが小さいため)、初期濃度の変化は無視できることに注意しましょう。

この近似を用いることで二次方程式を解く必要がなくなり、より簡便に計算することができます。
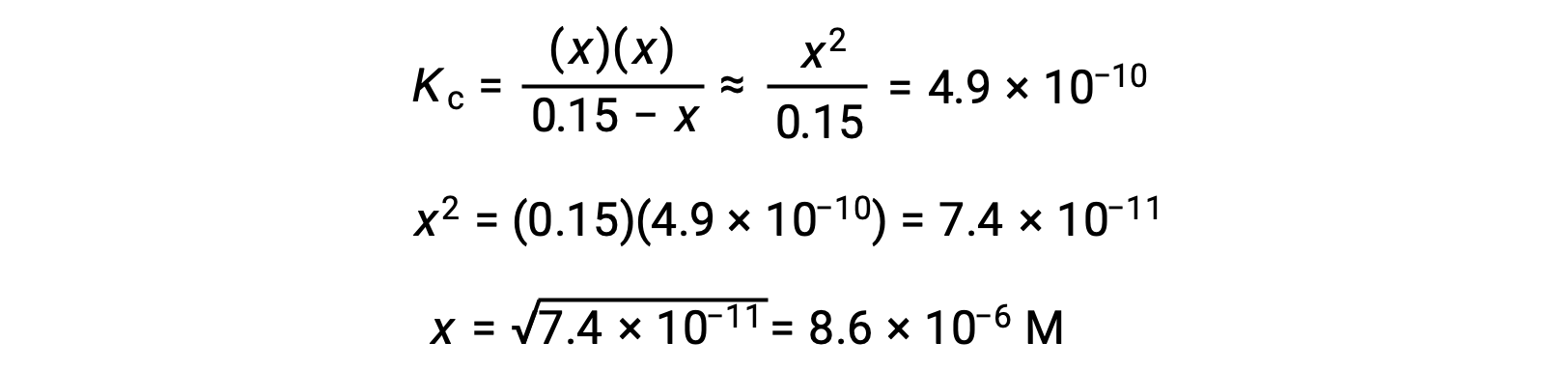
計算されたxの値は、実際には、初期濃度よりもはるかに小さいです。
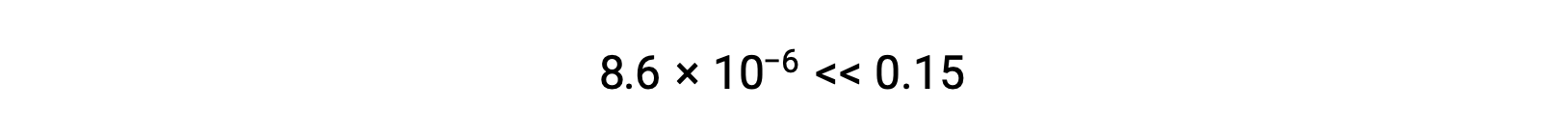
となり、近似が正当化されます。この単純化された手法によって仮定を満たさないxの値が得られた場合は、近似値を使わずに再計算する必要があります。
上記の文章は以下から引用しました。 Openstax, Chemistry 2e, Section 13.4 Equilibrium Calculations.
Suggested Reading
- Lim, Kieran F. "Using graphics calculators and spreadsheets in chemistry: Solving equilibrium problems." Journal of Chemical Education 85, no. 10 (2008): 1347. https://pubs.acs.org/doi/pdf/10.1021/ed085p1347
