14.10:
الافتراض الصغير
14.10:
الافتراض الصغير
إذا كان للتفاعل ثابت توازن صغير، فإن موضع التوازن يفضل المواد المتفاعلة. في مثل هذه التفاعلات، قد يحدث تغيير ضئيل في التركيز إذا كانت التركيزات الأولية للمواد المتفاعلة عالية وقيمة Kc صغيرة. في مثل هذه الظروف، يكون تركيز التوازن مساوياً تقريباً لتركيزه الأولي. يمكن استخدام هذا التقدير لتبسيط حسابات التوازن بافتراض أن بعض تركيزات التوازن تساوي التركيزات الأولية. ومع ذلك، لإجراء هذا الافتراض، يجب أن يكون التغيير في تركيز حمض ضعيف أو قاعدة، أي x، يجب أن يكون أقل من 5% من تركيزه الأولي. إذا كان x أكثر من 5%، فيجب استخدام الصيغة التربيعية لحل معادلة الاتزان.
حساب تركيزات الاتزان باستخدام افتراض تبسيط الجبر
ما التركيزات في توازن محلول حمض الهيدروكلوريك (HCN) الذي يبلغ 0.15 مول؟
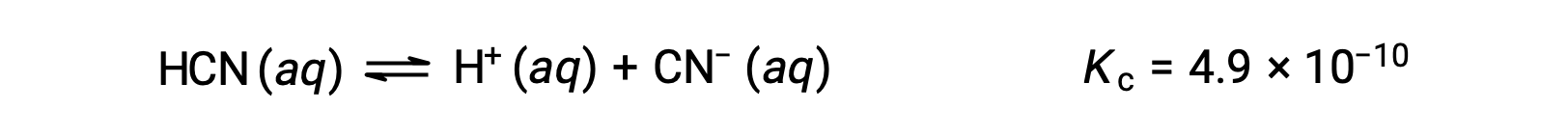
يؤدي استخدام x لتمثيل تركيز كل منتج عند التوازن إلى تقديم جدول ICE هذا.
| HCN (aq) | H+ (aq) | CN− (aq) | |
| التركيز الأولي (M) | 0.15 | 0 | 0 |
| تغيير (M) | −x | +x | +x |
| تركيز التوازن (M) | 0.15 − x | x | x |
استبدل شروط تركيز التوازن في تعبير Kc
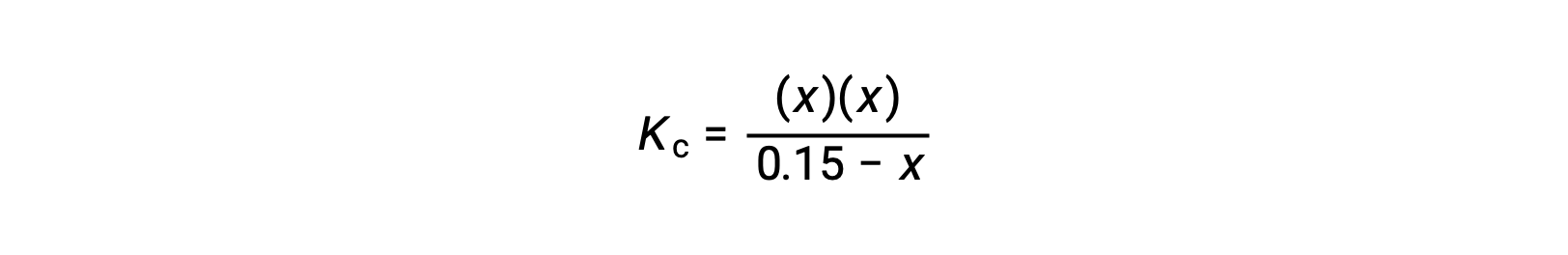
أعد الترتيب للصيغة التربيعية وحل قيمة x
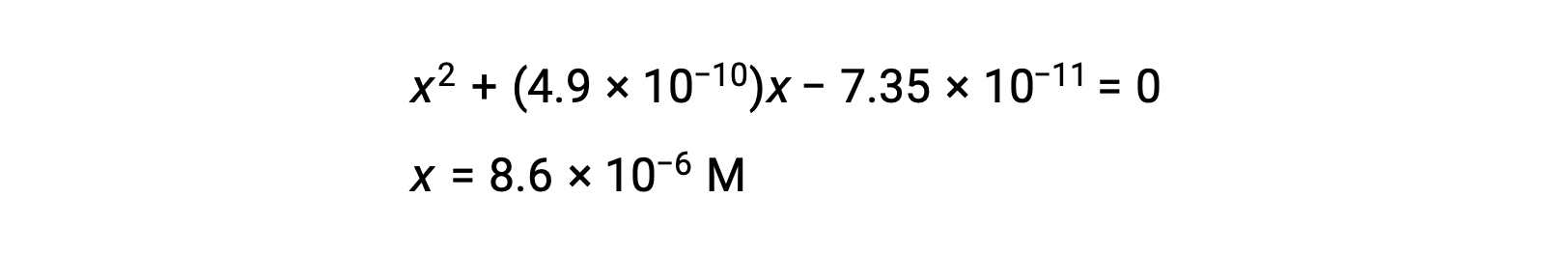
فإذاً، [H+] = [CN–] = x = 8.6 × 10–6 M and [HCN] = 0.15 – x = 0.15 M.
لاحظ في هذه الحالة أن التغيير في التركيز أقل بكثير من التركيز الأولي (نتيجة لقيمة K الصغيرة)، وبالتالي فإن التركيز الأولي يواجه تغييراً يمكن إهماله:

يسمح هذا التقريب باتباع نهج رياضي أكثر ملاءمة للحساب والذي يتجنب الحاجة إلى حل جذور المعادلة التربيعية:
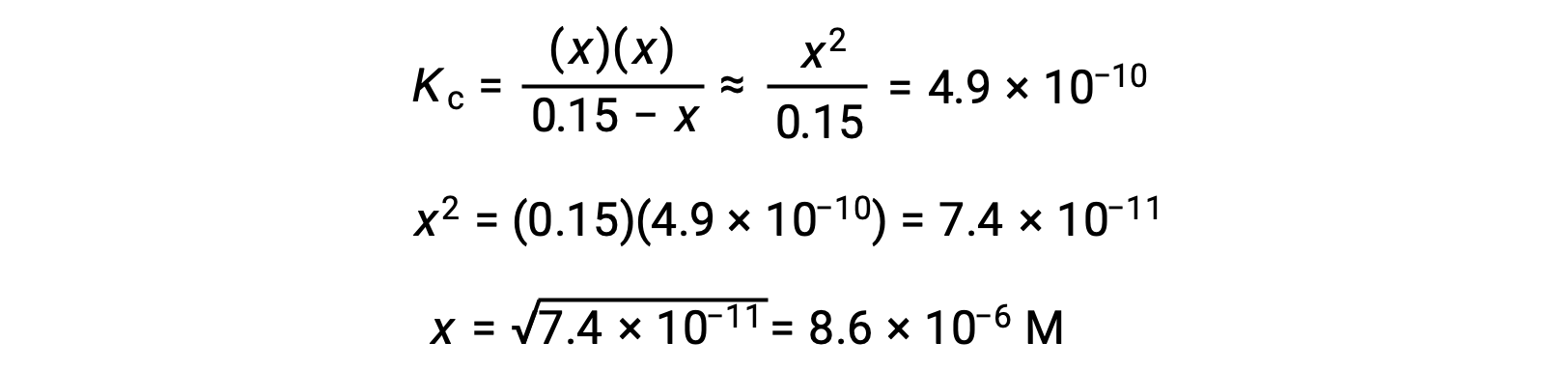
قيمة x المحسوبة بالفعل أقل بكثير من التركيز الأولي
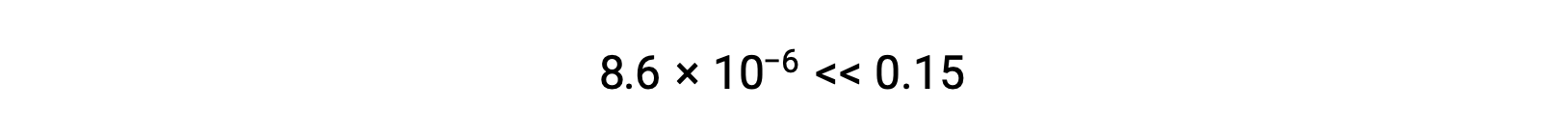
وبهذا نجد أن التقريب كان مبرراً. إذا كان هذا الأسلوب المبسط ينتج عنه قيمة لـ x لا تبرر التقريب، فسيلزم تكرار الحساب بدون إجراء التقريب.
تم اقتباس هذا النص من Openstax, Chemistry 2e, Section 13.4 Equilibrium Calculations.
Suggested Reading
- Lim, Kieran F. "Using graphics calculators and spreadsheets in chemistry: Solving equilibrium problems." Journal of Chemical Education 85, no. 10 (2008): 1347. https://pubs.acs.org/doi/pdf/10.1021/ed085p1347
