14.10:
El Supuesto x es Pequeña
14.10:
El Supuesto x es Pequeña
Si una reacción tiene una constante de equilibrio pequeña, la posición de equilibrio favorece a los reactivos. En tales reacciones, puede producirse un cambio insignificante en la concentración si las concentraciones iniciales de reactivos son altas y el valor de Kc es pequeño. En dichas circunstancias, la concentración en equilibrio es aproximadamente igual a su concentración inicial. Esta estimación se puede utilizar para simplificar los cálculos en equilibrio asumiendo que algunas concentraciones en equilibrio son iguales a las concentraciones iniciales. Sin embargo, para hacer esta suposición, el cambio en la concentración de un ácido o base débil, es decir, x, debe ser inferior al 5% de su concentración inicial. Si x es más del 5%, entonces la fórmula cuadrática necesita ser utilizada para resolver la ecuación de equilibrio.
Cálculo de concentraciones de equilibrio utilizando un supuesto de simplificación algebraica
¿Cuáles son las concentraciones en equilibrio de una solución 0,15 M de HCN?
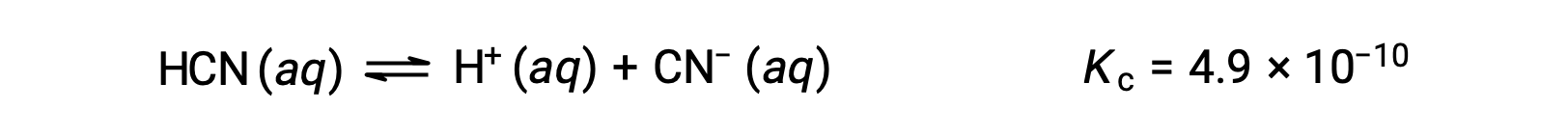
Usando x para representar la concentración de cada producto en equilibrio se obtiene esta tabla ICE.
| HCN (ac) | H+ (ac) | CN− (ac) | |
| Concentración inicial (M) | 0,15 | 0 | 0 |
| Cambiar (M) | −x | +x | +x |
| Concentración en equilibrio (M) | 0,15 − x | x | x |
Sustituya los términos de concentración en equilibrio en la expresión Kc
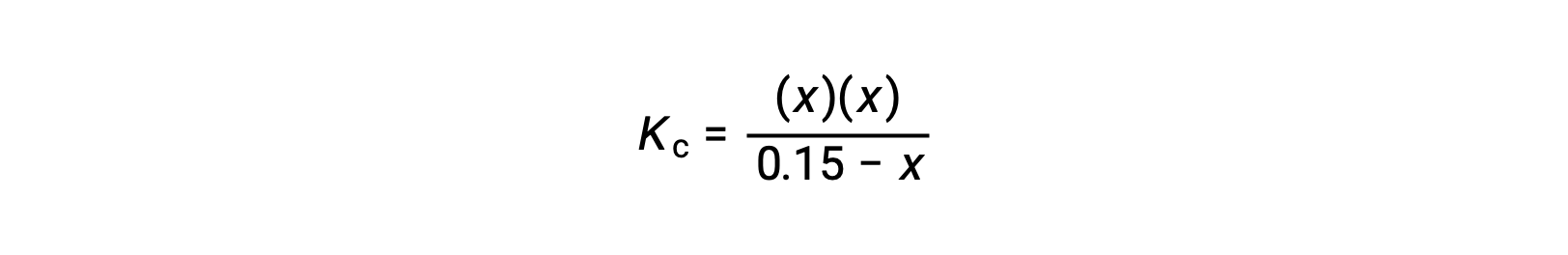
reorganice a la forma cuadrática y resuelva para hallar x
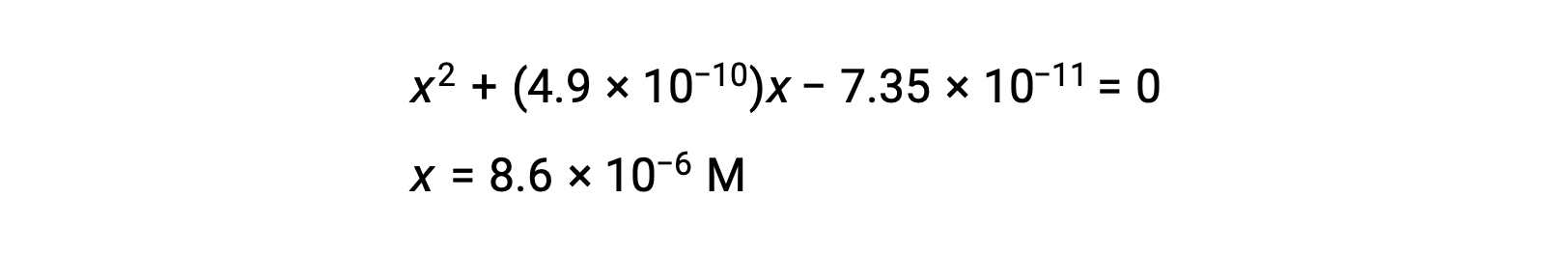
Así, [H+] = [CN−] = x = 8,6 × 10−6 M y [HCN] = 0,15 − x = 0,15 M.
Observe en este caso que el cambio en la concentración es significativamente menor que la concentración inicial (una consecuencia de la K pequeña), y por lo tanto la concentración inicial experimenta un cambio insignificante:

Esta aproximación permite un enfoque matemático más conveniente para el cálculo que evita la necesidad de resolver las raíces de una ecuación cuadrática:
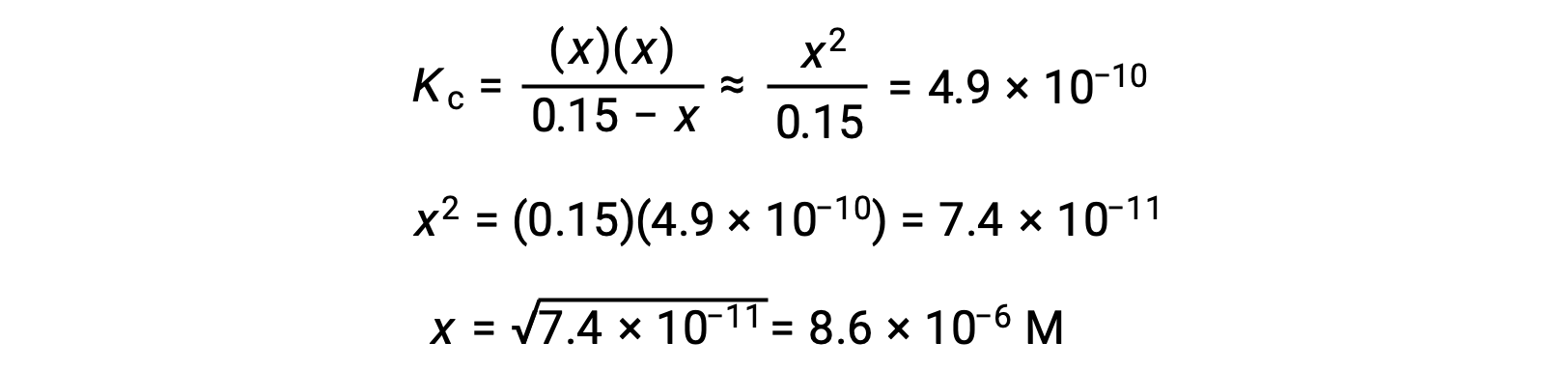
El valor calculado de x es, de hecho, mucho menor que la concentración inicial
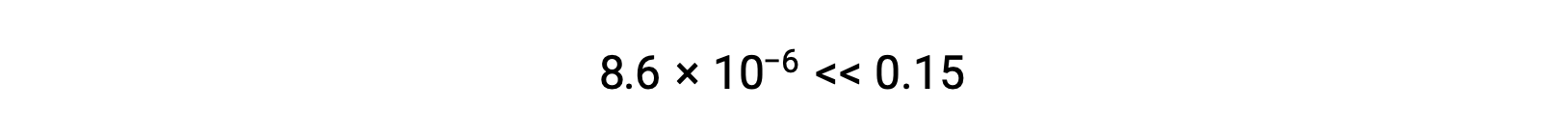
y así la aproximación estaba justificada. Si este enfoque simplificado tuviera arrojara un valor para x que no justificara la aproximación, el cálculo tendría que repetirse sin hacer la aproximación.
Este texto ha sido adaptado de Openstax, Química 2e, Sección 13.4 Cálculos de Equilibrio.
Suggested Reading
- Lim, Kieran F. "Using graphics calculators and spreadsheets in chemistry: Solving equilibrium problems." Journal of Chemical Education 85, no. 10 (2008): 1347. https://pubs.acs.org/doi/pdf/10.1021/ed085p1347
