Summary
خلية كاملة التصحيح ، المشبك التسجيلات السمعية من التشعبات الألياف العصبية في المشبك الشعر الداخلية الشريط خلية في القوقعة الثدييات.
Abstract
المشبك وارد بين الخلية الشعر الداخلي (IHC) وألياف العصب السمعي ويوفر الموقع للوصول electrophysiologically لتسجيل النشاط بعد المشبكي من شريط واحد المشبك 1-4. المشابك شريط من الخلايا الحسية الافراج العصبي بشكل مستمر ، فإن معدل الذي هو منظم في استجابة للتغيرات المحتملة في غشاء متدرج IHC 5. وقد تبين أن نقاط الاشتباك العصبي الشريط لتعمل عن طريق الافراج عن عديد الحويصلات ، حيث يمكن أن تنطلق حويصلات متعددة في نفس الوقت لاستحضار التيارات بعد المشبكي مثير (EPSCs) متفاوتة سعة 1 و 4 و 11/06. لا شيء على ما يرام في الوقت الراهن فهم دور الشريط قبل المشبكي ، ولا الآلية الكامنة وراء الافراج عن عديد الحويصلات.
ومعصب وIHC بنسبة 10-20 ألياف العصب السمعي ، وعلى كل الاتصالات مع الألياف IHC احد امياليني المنتهية لتشكيل المشبك الشريط واحد. وصغر حجم حبات IHCs وارد الاتصال (حوالي 1 ميكرون في القطر) تمكن التسجيلات مع القرار الزماني استثنائية في هذا الشأن. وعلاوة على ذلك ، يمكن تكييف هذه التقنية لتسجيل كلا من الخلايا ما قبل وبعد المشبكي في وقت واحد ، مما يسمح بدراسة نقل وظيفة مباشرة في المشبك 2. هذا الأسلوب يوفر بالتالي وسيلة يمكن من خلالها دراسة الجوانب الأساسية للالعصبي ، من الإفراج عن عديد الحويصلات إلى الدالة بعيد المنال من الشريط في الخلايا الحسية.
Protocol
1. الحلول
- يمكن إعداد حلول مقدما. ويمكن تخزين حلول خارج الخلية في 4 درجة مئوية لمدة تصل إلى شهر واحد. ويمكن تخزين Aliquots الحل الداخلية المجمدة (-20 درجة مئوية). ضمان أن تكون الحلول في درجة حرارة الغرفة قبل بدء التجارب.
- تشريح الحل والحل خارج الخلية التسجيل (مم) : 5.8 بوكل ؛ 144 كلوريد الصوديوم ؛ 0.9 MgCl 2 ؛ 1.3 CaCl 2 ؛ 0.7 ناه 2 ص 4 ؛ 5،6 الجلوكوز ؛ HEPES 10 (1) ؛ نا بيروفات ، ودرجة الحموضة 7.4 (هيدروكسيد الصوديوم) ، و 300 mOsm. كا لIHC 2 + يمكن العزلة الحالية يمكن تعديل الحل خارج الخلية كما هو مبين : 5.8 بوكل ؛ 114 كلوريد الصوديوم ؛ 0.9 MgCl 2 ؛ 1.3 CaCl 2 ؛ 0.7 ناه 2 ص 4 ؛ 5،6 الجلوكوز ؛ HEPES 10 و 30 الكلورين الشاي ؛ 7.4 درجة الحموضة (هيدروكسيد الصوديوم ؛) 300 mOsm.
- يمكن إضافة 1-2 سم الأسماك الرباعية الأسنان ميكرومتر (TTX) إلى حل خارج الخلية لعرقلة الجهد بوابات قنوات الصوديوم وعزل التيارات بعد المشبكي مثير أو إمكانات (EPSCs أو EPSPs).
- جواني حل تسجيل (ملم) : 20 بوكل ؛ K - 110 methanesulfonate ؛ MgCl 5 2 ؛ 0.1 CaCl 2 ، 5 EGTA ؛ HEPES 5 (5) ؛ نا 2 ATP ؛ 0،3 نا 2 GTP ؛ 5 نا 2 phoshocreatine ؛ 7.2 درجة الحموضة (كوه) mOsm 290 ، أو 135 بوكل ؛ 3.5 MgCl 2 ؛ 0.1 CaCl 2 ، 5 EGTA ؛ HEPES 5 ، 4 نا 2 ATP ؛ 0،2 نا 2 GTP ؛ 7.2 درجة الحموضة (كوه) ، 290 mOsm. جواني حل لIHC كا 2 + العزلة الحالية : 135 CsMeSO3 ؛ 13 الكلورين الشاي ؛ 3.5 MgCl 2 ؛ 2،5 نا 2 ATP (1) ؛ EGTA ؛ 7.2 درجة الحموضة (CsOH) ؛ 290 mOsm. وهذا الحل كتلة كمية كبيرة من المواصلة K + أكبر من ذلك بكثير ، مما كا 2 + الحالية المتبقية.
2. حاملو لصنع أنسجة تشريح
- ويمكن أيضا تعديل coverslips تستخدم لإعداد عقد في المكان خلال التسجيلات تكون معدة مسبقا.
- تطبيق قطرة Sylgard (داو كورنينغ ، ميدلاند ، ميتشيغن) نحو حافة الزجاج الدائرية ساترة (8-12 ملم). وضع نهاية سميكة من دبوس الحشرات الدقيقة (FST ، البند لا 26002-10) على ساترة. عقد دبوس الحشرات بإحكام ضد الزجاج مع ملقط وعقد بالقرب من لفائف ساخنة لتعيين sylgard.
3. صنع أقطاب
- إعداد أقطاب جديدة في كل يوم التجريبية وتخزينها في مربع محكم. افتعال 10-20 أقطاب لكل إعداد.
- حدد زجاج كهربائي ، ونحن نستخدم 1 ملم البورسليكات الزجاج الشعيرات الدموية (1B100F من WPI - 4 ، ساراسوتا ، فلوريدا).
- تصميم برنامج على مجتذب متعدد الأقطاب خطوة لسحب يبلغ قطرها حوالي غيض من 2-3 ميكرومتر (~ 6 MΩ في الحلول المذكورة أعلاه). نستخدم سوتر P - 87 متعدد خطوة مجتذب أفقي أو عمودي Narishige مجتذب PC - 10.
- بعناية معطف عرقوب من القطب مع Sylgard أقرب إلى الطرف ممكن. هذا يقلل السعة ، ويقلل من الضجيج ماصة التسجيل.
- النار تلميع الأقطاب باستخدام microforge مع خيوط ساخنة مثل تلك المتاحة من WPI. وينبغي أن أقطاب النار مصقول ويبلغ قطرها الخارجي غيض من حوالي 1 ميكرون (10-15 MΩ في الحلول المذكورة أعلاه). سمك الجدار ماصة هو حوالي 1 / 3 ميكرون. خارج القطر وحول حجم حبة وارد أن تكون مصححة.
- في حالة تنفيذ التسجيلات المتزامنة : يجب أن يتم بناؤها IHC ماصة بنفس الطريقة (نفس الزجاج وسحب نفس البرنامج) ، مع التمييز الذي تلميع النار يجب ان تغادر قطره أكبر غيض من 3 ميكرومتر ~ (6-8 MΩ).
4. إعداد تجربة
- شغل غرف متصلة نضح نظام بالجاذبية مع حل خارج الخلية واختبار الحلول التي تحتوي على عقاقير أو السموم من الفائدة.
- تعيين نضح بحيث حجم الحمام ما يقرب من 2 مل ، يروي باستمرار بمعدل بناء على أمر من 1.5 مل - 1 دقيقة.
- إذا حلول مختلفة ليتم تطبيقها خلال التجربة مع نظام نضح المحلية ، وملء الخزانات مع حلول. تشغيل حلول من خلال النظام وضمان عدم وجود فقاعات الهواء.
5. تشريح وإعداد نموذج
- يرافق الفيلم يوضح تشريح الجهاز كورتي لمدة ثلاثة أسابيع الفئران القديمة (سبراغ داولي تشارلز ريفر) ، التي هي أكثر صعوبة من المراحل السابقة التي من بعدها. واستعرض مزايا وعيوب التسجيل من الفئران من مختلف الأعمار في المناقشة.
- تخدير عميق الفئران عن طريق الاستنشاق isoflurane. ردود الفعل عند انسحاب غائبة والاكتئاب الشديد المنعكسات القرنية ، وقطع رأس. وقد تمت الموافقة على هذه الاجراءات لرعاية الحيوان جامعة جونز هوبكنز واللجنة الاستخدام.
- خطم وإزالة الجلد من رأس مقطوع. شطر الرأس وإزالة المخ لكشف عظام الزمانية.
- إزالة كل عظام الزمنية والمكان في تنظيف الأطباق التي تحتوي على تشريح حل خارج الخلية القياسية.
- إزالةعظم التغليف العظم الصدغي ، وذلك لفضح القوقعة. الاستمرار على العظم الصدغي بشكل آمن في قاعدة مع زوج من الملقط. التعرف على نوافذ مستديرة وبيضاوية. توجيه القوقعة بحيث النافذة البيضوية والجانب المتصاعد من القوقعة صعودا الوجه وإزالة العظم الزائد حول القوقعة.
- إزالة العظام التغليف القوقعة لفضح ظهارة حسية ، مع الحرص على حماية لفائف القمي ، والتي سيتم استخدامها لهذه التجربة. استخدام ملقط الزوج الثاني من الغرامة إلى رقاقة العظام مباشرة قبالة القوقعة ، بدءا من المنطقة التي هي أكثر شفافية من بقية العظام. هنا العظم هو أرق وأسهل في إزالتها. تواصل إزالة العظام من مختلف أنحاء لفائف القمي.
- الاستخدام الجزئي تشريح المقص لقطع طريق عماد القوقعة تحت بدوره القمي. ثم قطع بدوره قمية من انخفاض يتحول من القوقعة.
- استخدام مقص تشريح الصغيرة مرة أخرى ، إذا لزم الأمر ، لضمان أن قطعت تماما بدوره القمي. الحرص على حماية لفائف القمي ، ويجب ألا يتم سحبها أو تمدد. استخدام ملقط غرامة لاقناع بدوره قمية من بقية القوقعة.
- إزالة ما تبقى من العظام من كلا الجانبين من قمية بدوره.
- إزالة بعناية وعائي السطور ، لامعة في قطاع النسيج تقع خارج المنطقة الشعر الخلية (التخطيطي 1). تأكد من تجنب إزالة الشعر الخلايا الحسية ، والتي يمكن بسهولة أن تصبح منفصلة مع وعائي السطر.
- استخدام ملقط غرامة لفصل الغشاء السقفي ، وبراقة ، وشبه شفافة الغشاء الذي يجلس فوق خلايا الشعر الحسية.
- تقليم الآن الأنسجة والعظام الزائدة وتتسطح إعداد مع ملقط. هذا أمر ضروري ، بحيث يمكن وضعها في إطار النسيج بالتساوي دبوس.
- إعداد مكان تحت دبوس يعلق على ساترة (أعدت سابقا) ، مع الحرص على وضع دبوس بعيدا عن خلايا الشعر.
- استخدام ملقط لنقل ساترة إلى غرفة تسجيل. ضمان مغطاة بالكامل النسيج قوقعة مع قطرة من حل خارج الخلية ، بينما نقل ساترة. اضغط لأسفل بشدة ساترة على أسفل الزجاج من الغرفة لضمان أن لا يتحرك أثناء التسجيل.
- يبدأ على الفور نضح مع الحل خارج الخلية ، لضمان بقاء أفضل إعداد.
6. تسجيل
- تحديد موقع التحضير من خلال العدسات باستخدام المجهر 10x وغمر المياه أهداف مدينة دبي للإنترنت 40X. توجيه إعداد الأقطاب الكهربائية بحيث يمكن تسجيل نهج IHCs orthogonally على الجدار الجانبي للIHC.
- إذا كان أكثر من كرة لولبية من إعداد ، مما يحد من الرؤية في المنطقة القاعدية من IHCs ، واستخدام القطب تسجيل لدفع الحافة الخارجية للإعداد انخفض مقابل ساترة الزجاج ، مع الحرص على تجنب الضغط على IHCs أنفسهم.
- * اذا كنت تستخدم صغار الفئران ، في هذه المرحلة يمكن إزالة طبقة سميكة من الخلايا الداعمة فوق خلايا الشعر مع ماصة التنظيف (التي يبلغ قطرها غيض من 10-20 ميكرون ~) للوصول إلى الخلايا الحسية 1 و 12.
- استخدام جهاز العرض لتقييم ما إذا كانت الأنسجة السليمة. باستخدام عدسة التكبير 4X بين المجهر والكاميرا Newvicon NC70 يضخم الصورة ومزيد من المشاريع تبلغ مساحتها حوالي 4800 ميكرون 2 على الشاشة. وينبغي ممدود خلايا الشعر مع الشعر حزم سليمة. عندما تدهور الأنسجة وخلايا الشعر تنتفخ وتصبح أكثر شفافية ومحببة.
- حبات توطين وارد في جميع أنحاء قاعدة IHCs. هي حبات كروية أو بيضاوي ، وحوالي 1 ميكرون في القطر وخفيفة في اللون مع مظهر لامع. وقد تمت ترجمة معظم حبات دون مستوى النواة. عندما الأنسجة تنتفخ حبات غير صحية لنحو 4 أضعاف الحجم الطبيعي ، وتصبح شفافة ، وليس لامعة.
- ملء القطب تسجيل مع حل الخلايا ، وتطبيق الضغط الايجابي واستخدام micromanipulator للمناورة القطب إلى إعداد.
- إجراء شق في التحضير على مستوى القاعدة IHC مع القطب. دفع الكهربائي بين طبقة رقيقة من الخلايا ودعم IHCs ، وذلك باستخدام الضغط الايجابي للتوصل إلى طريق الوصول إلى المنطقة في قاعدة IHCs. هذه الخطوة هي "مفتاح" للوصول إلى حبة وارد لعدم تسجيل ودعم من الخلايا التي ensheath بإحكام النهايات وارد.
- إزالة بعناية واستبدالها القطب الكهربائي مع شغلها حديثا.
- استخدام الضغط الايجابي للحفاظ على طرف القطب نظيفة ، والمناورة من خلال ثقب القطب الوصول إلى غشاء من IHC. ينبغي الضغط الايجابي يساعد في تحريك حول الخلايا المحيطة دعم IHCs.
- تحرك القطب حول الخلايا المجاورة في اتجاه دعم حبة وارد (كما هو مبين في الفيلم المرافق له. ثمة نهج بديل هو نهج حبة وارد بتحريكلفترة طويلة حتى غشاء IHC غيض من القطب يمس حبة). تأكد من أن الطرف الكهربائي مباشرة أمام حبة وارد (لا تزال هناك فجوة صغيرة بين حبة والكهربائي بسبب الضغط الايجابي على ماصة). حبات تقديم مزيد من المقاومة لحركة الخلايا الماصة من دعم والغشاء IHC ، ويمكن أن "شعر" من قبل المجرب.
- ماصة نقل صعودا وهبوطا ، ودفع للتأكد من أن التحركات حبة. هذا يشير إلى أن الطرف ماصة وحبة في الطائرة - Z نفسه.
- مع القطب تضغط على حبة وارد ، والإفراج في وقت واحد وتطبيق الضغط الايجابي الشفط على شكل خاتم GΩ. تشكيل ختم GΩ على حبة وارد مماثلة لتلك التي على خلية الشعر. ويمكن تشكيل ختم يكون سريعا أو قد يحدث ببطء.
- رشقات نارية من تطبيق طيف الامتصاص للتمزق الغشاء داخل القطب وأدخل تسجيل خلية كاملة التكوين.
- إذا كانت الخلية مصححة هي حبة وارد ، والعابرين capacitative صغيرة تظهر على ساحة اختبار نبض رصدها خلال تشكيل ختم (انظر الشكل 1). لقد قدرنا السعة من انهاء وارد أن يكون 0،4-1،8 PF (راجع 3 ، 4). إذا كانت الخلية هي مصححة IHC ، وسوف يكون العابرين بناء على أمر من 3-5 مرات أكبر اعتمادا على المقاومة وصول.
- لتأكيد أن الخلية عبارة عن حبة وارد ، تشغيل بروتوكول مع وhyperpolarizing depolarizing الخطوات الجهد. العلاقات الجهد الحالي (IVS) للألياف وارد IHCs (في كثير من الأحيان عن طريق الخطأ عندما مصححة تهدف للحصول على حبة وارد) هي سمة مميزة لأنواع الخلايا الفردية وتظهر في الشكل 2.
- رصد إمكانات غشاء ؛ لالألياف وارد ، فمن عادة حوالي -60 إلى -65 فولت.
- إذا كانت الخلية ليست حبة وارد ، وإزالة القطب وكرر الخطوات من 8-13 مع القطب شغل حديثا. استخدام قطب جديد لكل محاولة.
- رصد المقاومة في جميع أنحاء سلسلة تسجيل عن طريق تطبيق الخطوات الجهد لضمان أن لا يتم ختم يغلق مرتفعا. إذا المقاومة سلسلة زيادات ، ويمكن ان تكون مفيدة لتطبيق البقول طيف من الشفط أو لنقل الكهربائي قليلا إلى الوراء. سلسلة المقاومات عادة حوالي 30 MΩ. عند تحليل نشاط متشابك ، ونحن مع المقاومة تسجيلات تجاهل سلسلة أكبر من 50 MΩ.
- يمكنك الآن تسجيل النشاط متشابك (انظر الشكل 3). اما المعارض الألياف وارد النشاط العفوي ، أو الخلية الشعر يجب أن يكون الإفراج عن استقطابها لتنشيط جهاز الإرسال. وسوف تطبق حلا خارج الخلية مع تركيز البوتاسيوم أعلى (على سبيل المثال 40 ملم) يزيل الاستقطاب الخلية الشعر وغالبا تنشيط أو زيادة معدل اطلاق سراح الارسال.
- للتسجيلات في وقت واحد وحبات IHCs وارد 2 ، ينبغي تعديل هذا الإجراء على النحو التالي : انتقل من خلال الخطوات من 1 إلى 5. ملء ماصة IHC مع الحل الخلايا المقابلة للكا 2 + العزلة الحالية واتبع كما هو مبين في 6. مغادرة ماصة للتسجيل IHC في "موقف الانتظار" على مقربة من IHC يتم تسجيلها من. متابعة الخطوات 6-14 لتسجيل وارد. عندما ماصة هو وارد في تكوين خلية كاملة تواصل مع IHC ماصة. مناورة ماصة الثانية نحو الجدار الجانبي للIHC المقابلة ، والحفاظ على الضغط دائما إيجابية. يجب أن تظهر IHC المسافة البادئة على الجدار الجانبي عن طريق الضغط وأنه يحتاج إلى التأكد من أن يتم فصل الخلايا دعم منه. ويمكن تطبيق 13 لIHC كذلك -- الخطوات 12. كما هو مبين في 14 ، مقارنة الألياف وارد ، العابرين بالسعة الكبيرة هي السمة المميزة لتسجيل IHC ، بالإضافة إلى العلاقة المميزة الرابع. مرة واحدة وضعت في وقت واحد التسجيلات ، ينبغي أن يسمح لبعض الوقت (3 -- 5 دقائق ، اعتمادا على سلسلة المقاومة) لإيجاد حلول لغسل الخلايا في IHC. وهذه النتيجة في جو كا 2 + التيارات بسبب زيادة كتلة أكبر بكثير من المواصلة + K.
- من أجل أداء فضفاضة ختم التسجيلات خارج الخلية ، في الخطوة 12 ، بدلا من صنع ختم GΩ ، وجعل ختم فضفاض من حوالي 30-50 MΩ على حبة وارد. ويمكن تحقيق ذلك من خلال تطبيق أقل شفط حين الافراج عن الضغط الايجابي. انظر الشكل رقم 5 لمثال لتسجيل خارج الخلية من حبة الفئران P21 وارد.
7. مشكلة رماية
- إذا كان من الممكن تشكيل الأختام ، ولكن لا يمكن تحقيق الانتقال من خلية المرفقة لتسجيل خلية كاملة تكون قد القطر الداخلي للماصة يكون ضيقا جدا.
- إذا لا يمكن أن تتشكل الأختام ضيقة ، قد يكون قطرها ماصة الداخلية كبيرة جدا ، ويمكن لحبة امتص كل ما يصل الى القطب.
- إذا كانت كل الأحداث متشابك صغيرة وموحدة ، قد يكون خارج الخلية تسجيل في وارد. اختبار لعكس الأحداث في إمكانات غشاء إيجابية ؛ سجلت intracellularlyوعكس EPSCs في إمكانات إيجابية.
- إذا المقاومة سلسلة مرتفعة باستمرار عند محطات التصحيح وارد ، ومحاولة تحريك ماصة الوراء قبل محاولة اختراق في تكوين خلية كاملة. هذا يساعد على منع انسداد ماصة وعالية المقاومة الوصول.
- تصحيح موقف ماصة دون خوف. فمن الممكن لتحريك كهربائي للحد من ارتفاع المقاومة سلسلة أو انسداد ماصة دون "فقدان" خاتم في وارد. خلال إنشاء تسجيل في وقت واحد ، هو عادة IHC 'دفع' نحو حبة. يمكن تصحيح الموقف ماصة وارد وفقا لذلك.
8. ممثل النتائج
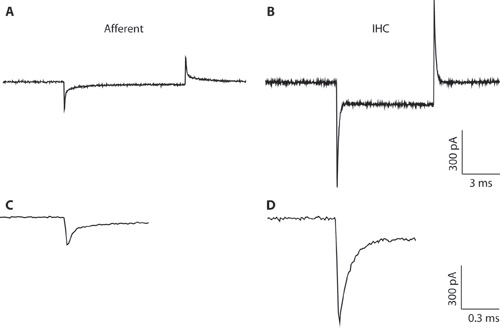
الشكل 1. AB. سجل العابرين نموذجية من الألياف وارد (A) وIHC (ب) استجابة لأمر بالسيارات 10 hyperpolarizing الجهد من الجهد عقد -94 بالسيارات. نظرا لضيق قطرها ماصة وعالية المقاومة وصول وتسجيل IHC (B) هو الأمثل لكامل الخلية IHC التسجيل. ويظهر التسجيل هنا فقط لتوضيح الفرق بين العابرين من capacitative IHCs والألياف وارد. وهذا يمكن أن تساعد على التمييز بين أنواع الخلايا عند تشكيل تكوين خلية كاملة. خلية كاملة من العابرين capacitative IHCs يتم بناء على أمر من 5 مرات أكبر من تلك التي في السعة من الألياف وارد. المضغوط. العابرين من A B & معروضة على جدول زمني موسع. يمكن أن يكون لائقا جيم اضمحلال وارد الاستجابة مع اثنين exponentials. كان من المقدر أن تنتهي من السعة وارد من مكون سريع.

الشكل 2. العلاقات الرابع من حبة وارد (A) وIHC (B). وتسجل العلاقات الرابع من المحتمل عقد -84 بالسيارات مع خطوات من الجهد -124 بالسيارات بالسيارات إلى 36 + 10 في زيادات بالسيارات (الفولتية الاسمية). وترد الفولتية إلى حق بعض آثار. ونفذت هذه التسجيلات من خارج الخلية مع بوكل 5.8 ملي في درجة حرارة الغرفة. النطاق لكل من : 500 السلطة الفلسطينية ، و 200 مللي ثانية.
A. العلاقات الرابع من الألياف وارد في يوم ما بعد الولادة 19. EPSCs موجودة في معظم الخطوات الجهد ؛ EPSCs عكس إيجابية ل+6 بالسيارات. وأجري هذا التسجيل في وجود TTX لعرقلة الجهد بوابات نا + التيارات. لاحظ الحالي تفعيل ببطء نحو الداخل في الفولتية hyperpolarizing (I ح). هذا التيار لم يكن موجودا في IHCs أو خلايا دعم ويوفر مؤشرا جيدا أن الخلية المسجلة من الألياف هو وارد (انظر 3). باء. العلاقات الرابع من IHC P19. نظرا لضيق قطرها ماصة وعالية المقاومة وصول وتسجيل هو الأمثل لوصف IHC التيارات والتيارات هي أصغر مما كان متوقعا. ويظهر التسجيل هنا فقط للتدليل على العلاقات الرابع من IHCs والألياف وارد يمكن تمييزها بوضوح ، وعندما حاول تسجيلا الألياف وارد. لاحظ تفعيل الخارج سريع K + التيارات في الامكانيات الايجابية (السهم) ، يليه تأخر المعدل K + 13 التيارات.

الشكل 3. التيارات نموذج تسجيل متشابك من الألياف وارد في يوم ما بعد الولادة 21 في وجود 40 ملم + K خارج الخلية لزيادة معدل الإفراج عن IHC. تطبيق درجة حرارة الغرفة ، مع TTX لعرقلة الجهد بوابات نا + التيارات. A. نطاق السلطة الفلسطينية 200 ، 5 مللي ثانية ، لاحظ حجم وشكل متغير EPSCs. للحصول على وصف تفصيلي لخصائص EPSC انظر 4 باء. اثنين EPSCs ملحوظ في A (# : متعدد الأطوار ، س : وحيد الطور) معروضة على نطاق موسع : جدول 100 السلطة الفلسطينية ، و 1 مللي ثانية.

الشكل 4. تسجيل الفورية لIHC والاتصال حبة وارد في جهاز الفئران رفعه كورتي ، ويوما بعد الولادة 10 (انظر أيضا 2). خطوة على الجهد depolarizing IHC يثير الافراج عن العصبي وينشط EPSCs في حبة وارد تتبع العليا : بروتوكول الجهد لإزالة الاستقطاب IHC. عقد المحتملة : -79 بالسيارات ، و 50 مللي ثانية إلى الخطوة -29 بالسيارات الأوسط التتبع : L - نوع كا 2 + التيارات المسجلة من IHC عادة ما تظهر قليلا تعطيل وتفعيل الطاقات السلبية في أسفل التتبع : التيارات متشابك في الألياف وارد في استجابة IHC إلى الاستقطاب. لاحظ الاكتئاب متشابك خلال الاستقطاب IHC 50 مللي.

الشكل 5. أ. تسجيل نموذج خارج الخلية من حبة في اليوم وارد بعد الولادة 21. وقد سجلت هذا في درجة حرارة الغرفةتلح ، مع 5.8 ملي K + خارج الخلية. هذا التسجيل قد إشارة إلى نسبة الضوضاء نموذجي للتسجيل في التحضير من الفئران ثلاثة أسابيع من العمر. باء. متوسط الموجي للأحداث المسجلة خارج الخلية من حبة P20 وارد. هذا هو الموجي المتوسط من 10272 الأحداث.

1 التخطيطي. الصليب عرض المقاطع من خلال واحدة بدورها من القوقعة الفئران التي توضح العلاقة التشريحية بين خلايا الشعر الداخلي والخارجي ، والعقد لولبية ، وعائي السطر الغشاء السقفي.
Discussion
في خطوة حاسمة في هذا الإجراء هو تشريح. إذا امتد هذا النسيج أو تضررت خلال التشريح ، والألياف وارد لا البقاء على قيد الحياة. نسيج من الفئران الأصغر أكثر مرونة وتسامحا. نجد أن أيام بعد الولادة 10-11 هي الأسهل للتشريح والتجارب وارتفاع معدلات النجاح. درجة كبيرة من النضج قوقعة يحدث بعد الولادة ، مع الفئران بدأت تسمع من جميع أنحاء يوم بعد الولادة 12 14. ولذلك ، في سن حيث التشريح هو أسهل ، قد لا تكون نقاط الاشتباك العصبي ناضجة تماما 4.
تشريح الفئران الموصوفة هنا هي أساسا لنفسها من أجل الفئران ، والفرق الرئيسي هو أصغر حجم القوقعة الماوس. هذا الأسلوب يسمح للفحص خصائص الشريط نقاط الاشتباك العصبي لدى الفئران المعدلة transgenically 15. تعديلات أخرى لهذا الأسلوب ما يلي : إضافة صبغة الفلورسنت إلى حل للألياف الخلايا تسمية 3 ؛ التسجيلات يقترن الشعر الخلية الداخلية قبل المشبكي وبعد المشبكي حبة وارد ، والسماح ليتم تحديد وظيفة النقل بين الخلايا ما قبل وما بعد متشابك 2 و فضفاض ختم التسجيلات خارج الخلية في وارد حبات لتفادي فقدان النزاهة الخلوية. تكوين تسجيل خارج الخلية هو أسهل لتحقيق من تكوين خلية كاملة والتجارب عموما أطول أمدا.
Disclosures
الإعلان عن أي تضارب في المصالح.
Acknowledgments
وأيد هذا العمل من قبل الصمم منحة بحثية لمؤسسة البحوث وEY NIDCD DC006476 المصري إلى وNIDCD DC005211 لمركز السمع والتوازن ، جامعة جونز هوبكنز. العمل الفني حق المؤلف تيم فيليبس ، جامعة جونز هوبكنز.
LG كتب المخطوطة الأولية ؛ EY وLG بتصوير وتسجيل تشريح. تزويد جميع الأرقام المثالية الكتاب وساهم في كتابة المخطوطة.
Materials
| Name | Company | Catalog Number | Comments |
| Air table | TMC | ||
| Gibraltar Stage with xy-table | Burleigh | ||
| Axioscope FS2 upright microscope DIC optics Green filter | Carl Zeiss, Inc. | ||
| Newvicon camera with controller | Dage | ||
| Monitor | Dage | ||
| Multiclamp 700B (or similar) | Molecular Devices | ||
| Digidata 1322A (or similar) | Molecular Devices | ||
| Manipulator MP285 | Sutter Instrument Co. | ||
| 6-channel valve application system for local perfusion (used with hand made perfusion pipettes) | Warner Instruments | ||
| PC with acquisition software (PClamp) | Molecular Devices | ||
| Above is the equipment in our electrophysiological setups used for recording from afferent terminals. | |||
References
- Glowatzki, E., Fuchs, P. A. Transmitter release at the hair cell ribbon synapse. Nat Neurosci. 5 (2), 147-154 (2002).
- Goutman, J. D., Glowatzki, E. Time course and calcium dependence of transmitter release at a single ribbon synapse. Proc Natl Acad Sci U S A. 104 (41), 16341-16346 (2007).
- Yi, E., Roux, I., Glowatzki, E. Dendritic HCN channels shape excitatory postsynaptic potentials at the inner hair cell afferent synapse in the mammalian cochlea. J Neurophysiol. 103 (5), 2532-2543 (2010).
- Grant, L., Yi, E., Glowatzki, E. Two modes of release shape the postsynaptic response at the inner hair cell ribbon synapse. J Neurosci. 30 (12), 4210-4220 (2010).
- LoGiudice, L., Matthews, G. The role of ribbons at sensory synapses. Neuroscientist. 15 (4), 380-391 (2009).
- Singer, J. H. Coordinated multivesicular release at a mammalian ribbon synapse. Nat Neurosci. 7 (8), 826-833 (2004).
- Keen, E. C., Hudspeth, A. J. Transfer characteristics of the hair cell's afferent synapse. Proc Natl Acad Sci U S A. 103 (14), 5537-5542 (2006).
- Li, G. L. The unitary event underlying multiquantal EPSCs at a hair cell's ribbon synapse. J Neurosci. 29 (23), 7558-7568 (2009).
- Singer, J. H., Diamond, J. S. Vesicle depletion and synaptic depression at a mammalian ribbon synapse. J Neurophysiol. 95 (5), 3191-3198 (2006).
- Suryanarayanan, A., Slaughter, M. M. Synaptic transmission mediated by internal calcium stores in rod photoreceptors. J Neurosci. 26 (6), 1759-1766 (2006).
- Neef, A. Probing the mechanism of exocytosis at the hair cell ribbon synapse. J Neurosci. 27 (47), 12933-12944 (2007).
- Tritsch, N. X. The origin of spontaneous activity in the developing auditory system. Nature. 450 (7166), 50-55 (2007).
- Kros, C. J., Ruppersberg, J. P. Expression of a potassium current in inner hair cells during development of hearing in mice. Nature. 394 (6690), 281-284 (1998).
- Muller, M. Developmental changes of frequency representation in the rat cochlea. Hear Res. 56 (1-2), 1-7 (1991).
- Seal, R. P. Sensorineural deafness and seizures in mice lacking vesicular glutamate transporter 3. Neuron. 57 (2), 263-275 (2008).



