Summary
神経膠腫の治療のための新たな治療パラダイムを評価するために、生理学的な関連モデルが不可欠です。我々は、定位のアプローチよりもより迅速かつ安全である頭蓋内移植モデルの確立のための埋め込み型ガイド用ネジの手順を利用する。
Abstract
免疫抑制マウスの脳にヒト腫瘍細胞の移植は、神経膠芽腫(グリオーマ)と髄芽腫を含む脳腫瘍の研究のための確立された方法です。広く使用されている定位アプローチは一度に一つの動物の注入を可能にする、労働集約的であり、非常に特殊な装置を必要とします。最初はラルら 、1で開発したガイド用ネジの方法は、面倒な定位の手順を排除するために開発されました。我々は現在、迅速かつ非常に安全であると修正されたガイド用ネジのアプローチを説明し、重要な倫理的配慮が、どちらも。特に、私たちの手続きは今同時に腫瘍細胞を注入することが10匹まで可能に注入ポンプを内蔵しています。
HGF /現在臨床評価2-5を受けて散乱係数に向け完全ヒト抗体を、この手順の有用性を実証するために、我々は、AMG102を投与したマウスの頭蓋内異種移植片、のように人間のU87MG神経膠腫細胞を確立した。 AMG102の全身注射は大幅に頭蓋内U87MGの異種移植片ですべてのマウスの生存を延長し、完全な治療の数となりました。
この研究では、ガイド用ネジのメソッドは頭蓋内異種移植片を確立するための安価な、再現性の高いアプローチであることを示しています。さらに、それは脳腫瘍の治療のための新たな治療戦略を検証するための関連する生理学的モデルを提供します。
Protocol
1。細胞株
- U87MG神経膠腫の細胞は、5%ウシ胎児血清(FBS)を添加したDMEM - F12を持つ大規模な組織培養フラスコで培養されています。
- 細胞は温かいリン酸で二回フラスコを洗浄することによって収穫されている生理食塩水(PBS)は、バッファ、37でそれらをインキュベート° 0.25%トリプシンおよび0.05%EDTAを含むPBS 10mlで5分間。一度細胞が解除され、それらは培養培地、遠心分離(4分間300 × g)を10 mlを入れた50 mlチューブに配置されます。
- 洗浄後、細胞を10 × 10 6 / 50,000細胞/5μlの接種のために許容される培地のmlの濃度で再懸濁する。
- 細胞は、頭蓋内注射するまで氷上で保存されています。
2。ボルト頭蓋内ガイドのネジ
この手順は、細胞の注入の前に数日間行うことができます。ここで説明するすべての手順は、厳格な無菌条件下で行われている。
- マウス(BALB / c NU / NU(メス)、5-6週間、約18グラム)は、ケタミン(100 mg / kg体重)及びキシラジン(5 mgの混合物の腹腔内(IP)の注入で秤量し、anesthetised、識別の目的で番号が付けられています/ kg)を。
- 皮膚は、ヨウ素液でダウン拭いていると、小さな切開(2-3 mm)が正中線と両耳ラインの前方の右側に沿って行われます。これは、頭蓋骨の冠状および矢状縫合糸を公開します。ブレグマは、これら2つの縫合糸の接合部に位置している。
- ガイド用ネジのエントリポイントは、ポイント横2.5ミリメートルとブレグマの前方を1 mmにマークされています。この点は、直接に尾状核1の上方に位置しています。
- 1 × 1ミリメートルの深穴は、硬膜に頭蓋骨を介してツイストドリルを保持し、滅菌手で掘られている。
- 硬膜への頭蓋骨の表面の下に1.6ミリメートルを延長する滅菌ガイド用ネジは、ネジをドライバーで穴にボルトで固定されて頭蓋骨(図1A)と同じ高さになるまで。
- 滅菌スタイレットまたはスクリューのダミーは、開口部(図1B)をクローズするためのガイド用ネジの中心孔に配置されます。
- 鎮痛のために傷がVetbond組織接着剤で閉じられます(n -ブチルシアノアクリレート)およびマウスreversineの腹腔内注射(小動物)(0.1 ml / kgをを)与えられ、カルプロフェン(5 mg/kg/100μL)。マウスはその後、20分かかることが温暖化防止マット(36℃)で回復させる。彼らは完全に意識されるまでマウスを頻繁にモニターし、この回復時間の間に観察されています。
3。頭蓋内細胞の生着
- 滅菌カフハミルトンシリンジは、ガイド用ネジコンセント(図1B)の下に拡張するために、針のわずか2 mmを可能に針の先端に小さなプラスチック製のリングを適用することによって調製される。最終的な接種のポイントは、したがって、頭蓋骨の表面の下に3.5ミリメートルです。
- ガイド用ネジの手術後4日間、マウスは再び(2.1)上記のように麻酔し、小さな切開は、スタイレットを除去するためのガイド用ネジを介して行われます。
- カフハミルトンシリンジは、どのような気泡を作成したり、策定しないように予防策を取ってよく混合した細胞を5μlで満たされている。
- シリンジは、注入ポンプに固定され、針をガイドねじ(図1C)に挿入されます。次に、細胞を1時間あたり30μlの割合で注入されています。
- 自動化装置(図1D)は、私たちは一定の流速で一度に10匹まで注入することができました。細胞はまた、カフ付きハミルトンシリンジを使用して手動で注入することができるか、あるいは注射器を針の先端が2mmからガイド用ネジを超えて拡張できるように3 mmでトリミングされている200μlのピペットの先端で手錠することができます。注入は、一定の安定したペースで実行する必要があります。
- 注入が完了すると、注射器を注意深く除去され、スタイレットは、ガイドのネジに置き換えられます。傷口が閉じて接着され、マウスが(2.7)以前のように回復薬を与えられ、温暖化のマットの上に回復するために許可されています。
4。治療の課題
- U87MG細胞接種4日後、マウスを秤量し、無作為にコントロールし、治療群に分けられます。
- 治療群がAMG102(PBS100μl中100μgの)のIP注射を与えている間に、対照群は、PBS(100μL)の腹腔内(IP)注射が与えられます。
- 注射は、14日間は毎秒6日目注射(図2)の合計を繰り返している。
- 最後の注射後、マウスを毎日モニターし、一日おきに秤量する。
- マウスでは有意な神経学的機能障害(平衡感覚障害、麻痺)、脱水、または10%以上の体重減少または瀕死を表示するために始めたとき、彼らは人道的に安楽死された。これらの人道的エンドポイントの日数は、Kaplan - Meier生存曲線を記録した。
5。治療効果の評価
6。代表的な結果:
対照動物は23日、細胞の初期接種後の神経障害や体重減少の兆しを示し始めた。これは、大幅に35日にAMG102投与群では遅れていた。確かに35日で、対照群の77%(N = 7 / 9)が安楽死されていた。 Kaplan - Meier生存曲線は明らかにAMG102の治療(図3)に対応して生存率の有意な増加を示しています。 70日では、対照マウスの88%は、AMG102投与群の37%(N = 3 / 8)と比較して(N = 8 / 9)安楽死されていた。脳の組織学的分析は、対照群では全9動物発達した腫瘍は唯一の3 8 AMG102投与したマウス(図4)のと比較していることを確認した。
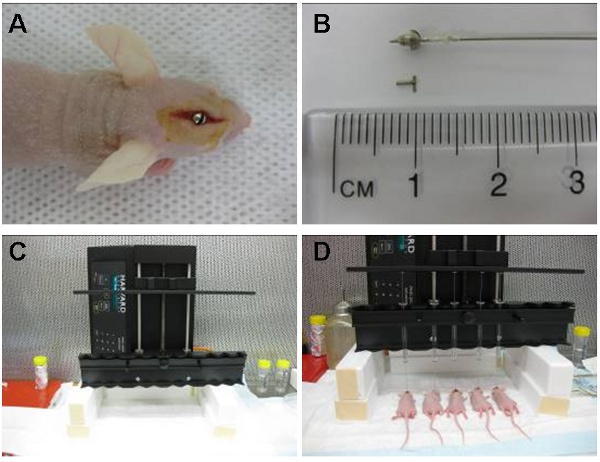
図1:画像は()を直接尾状核の上にあるエリアに位置して頭蓋内のガイド用ネジを示しています。針の2mmのガイド超えると細胞は尾状核の内部に3.5ミリメートルを注入されるように、カフ付きハミルトンシリンジ(細胞との事前ロードされたが)その後、ガイド用ネジの内側に配置されます。注射器は、後にスタイレット(B)によって除去し、置き換えられます。自動注入装置(C)は、一度に10匹まで注入することができます。ここに示した5つの同時注射は、(D)です。

図2:治験実施計画書の回路図。細胞は、治療は4日目に開始0日目に注入した。治療群ではAMG102(100μg/100μL)IPの注入を受けた一方、コントロール動物では、PBS(100μL)IPの注射を受けた。これらの注射は10日間一日おきに与えられた。 6注射の合計が指定されました。動物は、神経学的および物理的な障害の兆候がない70日間モニターした。

図3:コントロールとAMG102処置マウスを比較したKaplan - Meier生存曲線。有意な生存率はAMG102(P = 0.005)で処理した後得られた。

図4:腫瘍対照動物の開発()とAMG102処理された動物(B)のない脳腫瘍の開発を実証する冠状脳切片の顕微鏡写真。スケールバーは1mmである。
Discussion
ここで紹介する頭蓋内のガイド用ネジの方法は、頭蓋内異種移植片を迅速かつ再現性の確立を可能にし、訓練された動物の技術者の手に、この手順は非常に簡単に定位装置を必要とせずに実行されます。我々の手法は正確にin vivoでの腫瘍の開発に最適な脳の領域、および一度に最大10匹までの同時接種が可能な自動注入ポンプを見つけるために、ガイド用ネジを組み合わせて使用します。ガイド用ネジの増大術は、実行するために5分以内かかります。 30μlの/時間における細胞の自動注入は、5μlのボリュームのためにわずか10分かかります。これは一定の速度で正確な投与を保証し、頭蓋内圧亢進に起因する余分-脳神経領域に細胞の追放のリスクを低減します。我々はまた、10μlの容量でこの手順を実行していると携帯逆流に起因する余分-頭蓋腫瘍の成長を確認されていません。自動注入ポンプはまた、いくつかの動物は我々は時間当たり約15の動物に限定されている定位の手順に比べて時間当たり60匹まで注入することができると同時に接種することができますように。
その位置は、腫瘍の大きさの究極の位置を決定するとして、この手順の中で最も重要なステップは、頭蓋骨のガイド用ネジの位置です。ガイド用ネジがあまりにも中心的である場合、細胞はガイドがはるか前方にに配置されている場合では2つの脳半球の間の領域に注入され、細胞は、すべてで脳内に注入されることはありません。したがって、ガイド横2.5ミリメートルとブレグマ1〜前方1 mmの位置で可能な限り正確であることが不可欠である。プラスチック製のガイド用ネジは、このようなMRIやPET 6などの脳イメージングを必要とする研究にも利用できるが、本研究では、鋼のガイド用ネジを使用していました。自動注入ポンプは、いくつかのグループのためのコストがかかりすぎるされている場合でも、細胞はまだ手動でより迅速に定位のアプローチよりも注入することができる。全体的に、この迅速、正確かつ再現性のある方法は神経膠腫、髄芽腫や脳幹の腫瘍7を研究するために使用することができます。この手順は、予想外の麻酔反応(<1%)による死亡者と我々の2つの研究室間、500人以上のマウスで行われている。ガイド用ネジとボルトで固定し、その後、細胞を注入したマウスは、手続きの結果として、神経学的合併症を死亡するか、受けていない。動物はどんな合併症がなく、100日を超えて生存している。我々はヘアレスマウスを使用するのが好ましいが、適切に提供するのと同様に、SCIDのような髪の免疫不全マウスは、頭蓋骨の髪は、サイトを清潔に保つために、ガイド用ネジに干渉する毛を防ぐために手術前に削除されましたれる。
現在、神経膠腫80から10の治療用に開発されているいくつかの新規治療薬があります。最近では、皮下U87MG神経膠腫異種移植片がAMG102 3で処理することにより抑制できることを示した;ヒト化抗体は、現在、神経膠腫5に臨床評価を受けてHGFに指示。我々は、ヌードマウスの脳で頭蓋内U87MG腫瘍を確立する方法がここに記述するために使用。我々の研究は明らかに法の有用性を示し、AMG102が大幅に同所U87MG異種移植片の増殖を阻害することを示しています。我々は、他の治療法が腫瘍の成長をより効果的にinhibitionを取得するにはAMG102と組み合わせて使用することができるかを決定するためにこのモデルを使用し続けます。
Disclosures
この作品は、Amgen社から研究助成金によって支えられて
Acknowledgments
著者らはこのモデルの開発に支援をVerleneヘンリーとリンジーホームズに感謝します。この研究の一部はジェームズS.マクダネル財団(#220020173)によって賄われていた。
Materials
| Name | Company | Catalog Number | Comments |
| DMEM/F12 | Invitrogen | 12634010 | |
| FCS | Bovogen | SFBS | |
| Trypsin | Invitrogen | 15050065 | |
| EDTA | Sigma-Aldrich | E6758 | |
| Balb/c nu/nu mice | ARC Perth | ||
| Screw Holder | Plastics One | SD-1 | |
| Drill Holder | Plastics One | DH-1 | |
| Drill Bit | Plastics One | D#60 | |
| Screw guide (metal) | Plastics One | C212SG | |
| Screw Dummy (stylus) | Plastics One | C212SD | |
| Hamilton Syringe (10 μl 26g cemented needle) | Grace Division Discovery Science | 80075 | |
| PHD 22/2000 infusion pump | Harvard Apparatus | 70-2003 | Optional |
| Vetbond | 3M | 1469SB | |
| Thermo pad | Harvard Apparatus | 340390 |
References
- Lal, S. An implantable guide-screw system for brain tumor studies in small animals. J Neurosurg. 92, 326-333 (2000).
- Jun, H. T. AMG 102, a fully human anti-hepatocyte growth factor/scatter factor neutralizing antibody, enhances the efficacy of temozolomide or docetaxel in U-87 MG cells and xenografts. Clin Cancer Res. 13, 6735-6742 (2007).
- Pillay, V. The plasticity of oncogene addiction: implications for targeted therapies directed to receptor tyrosine kinases. Neoplasia. 11, 448-458 (2009).
- Buchanan, I. M. Radiosensitization of glioma cells by modulation of Met signaling with the hepatocyte growth factor neutralizing antibody. AMG102. J Cell Mol Med. 15, 1999-2006 (2011).
- Wen, P. Y. A phase II study evaluating the efficacy and safety of AMG 102 (rilotumumab) in patients with recurrent glioblastoma. Neuro Oncol. 13, 437-446 (2011).
- Caretti, V. Monitoring of Tumor Growth and Post-Irradiation Recurrence in a Diffuse Intrinsic Pontine Glioma Mouse Model. Brain Pathol. 4, 441-451 (2011).
- Jallo, G. I., Volkov, A., Wong, C., Carson, B. S., Penno, M. B. A novel brainstem tumor model: functional and histopathological characterization. Childs Nerv. Syst. 22, 1519-1525 (2006).
- Johns, T. G. The efficacy of epidermal growth factor receptor-specific antibodies against gliomaxenografts is influenced by receptor levels, activation status, and heterodimerization. Clin Cancer Res. 13, 1911-1925 (2007).
- Scott, A. M. A phase I clinical trial with monoclonal antibody ch806 targeting transitional state and mutant epidermal growth factor receptors. Proc. Natl. Acad. Sci. U. S. A. 104, 4071-4076 (2007).
- Niyazi, M. Therapeutic options for recurrent malignant glioma. Radiother. Oncol. 98, 1-14 (2011).



