Summary
为了评估新的治疗脑胶质瘤的治疗范式,生理相关的模型是必不可少的。颅内移植瘤模型的建立,是比立体定向的方法更快速,更安全,我们利用一个植入式丝杠程序。
Abstract
人类肿瘤细胞移植到免疫抑制小鼠的大脑的脑肿瘤,包括胶质母细胞瘤(神经胶质瘤)和髓母细胞瘤的研究建立的方法。广泛应用于立体定向的方法只允许注射一次一个单一的动物,是劳动密集型的,需要高度专业化的设备。丝杠的方法,最初由拉尔等人,1开发的开发,以消除繁琐的立体程序。我们现在介绍一个修改后的丝杠的方法,是迅速的和极其安全;这两者都是重要的伦理方面的考虑。值得注意的是,现在我们的程序采用输液泵,允许多达10个同时与肿瘤细胞注入动物。
为了演示此过程中的效用,我们确立了颅内移植瘤小鼠,然后用AMG102治疗人类的U87MG胶质瘤细胞向肝细胞生长因子/分散因子,目前正在进行临床评价2-5的完全人类抗体。全身注射的AMG102显著延长所有颅内U87MG移植瘤小鼠的生存,并导致一个完整的治疗方法。
这项研究表明,丝杠方法是一种廉价的,高度重现建立颅内移植瘤的方法。此外,它提供了一个用于验证新的治疗策略,治疗脑癌的有关的生理模型。
Protocol
1。细胞系
- 在大型组织,辅以5%胎牛血清(FBS),DMEM - F12文化烧瓶的U87MG胶质瘤细胞培养。
- 细胞是由磷酸用温水冲洗烧瓶两次收获缓冲液(PBS)和孵化,在37 ° C时5分钟10毫升的PBS,含0.25%胰蛋白酶和0.05%EDTA。一旦细胞被取消,他们是文化传媒和离心(4分钟)300 X克含10毫升到50毫升的管。
- 洗净后,细胞悬浮在浓度为10 × 10 6 /毫升培养基,允许50,000个细胞/ 5μL接种。
- 细胞被保存在冰直到颅内注射。
2。丝杠颅内抽薹
此过程可进行数天前的细胞注射。这里描述的所有程序已经进行了严格的无菌条件下。
- 编号小鼠(BALB / C NU / NU女性; 5-6周;约18克)是用于识别目的,称重并与腹腔注射氯胺酮(100毫克/公斤)和甲苯噻嗪(5毫克的混合物(IP)的anesthetised /公斤)。
- 碘溶液擦拭皮肤,沿中线和前双耳线右侧小切口(2-3毫米)。这暴露颅骨冠状面和矢状面的缝合。前囟门是定位在这两个缝线交界处。
- 丝杠的切入点,然后标记在一个点上侧2.5毫米和1毫米前的前囟。这点是位于正上方的尾状核1。
- 1 × 1毫米的深孔钻举行麻花钻硬脑膜通过头骨无菌手。
- 成孔,用螺丝刀将延长到硬脑膜的头骨表面以下 1.6毫米的消毒丝杠然后狂奔,直到冲洗的头骨(图1A )。
- 无菌钢丝或螺丝假人,然后放置到丝杠的中心孔关闭开幕(图1B)。
- Vetbond组织粘合剂(N -氰基丙烯酸正丁酯)和小鼠封闭伤口reversine腹腔注射液(小动物)(0.1毫升/公斤)和卡洛芬镇痛(5 mg/kg/100μL)。小鼠变暖垫(36℃),这可能需要长达20分钟,然后让其恢复。老鼠经常在此期间恢复时间的监测和观察,直至他们完全清醒。
3。颅内细胞植入
- 无菌铐汉密尔顿注射器准备用一个小塑料环,只允许2毫米的针头,针头,延长丝杠插座(图1B)以下。最后的接种点,因此颅骨表面下3.5毫米。
- 丝杠手术后四天,老鼠再次麻醉上述(2.1)和小切口是在丝杠删除的钢丝。
- 5μL以及采取预防措施,不能创造或制定任何气泡混合细胞充满铐汉密尔顿注射器。
- 固定灌注泵注射器和针头插入到丝杠(图1C)。细胞,然后注入每小时30μL的速度。
- 自动化设备(图1D)允许我们在一个恒定的流量的时候,注入10只动物。细胞也可手动注射,所使用的手铐汉密尔顿注射器或注射器可以由200μL枪头已3毫米修剪,使针尖延长2毫米,超出丝杠铐。注入,然后必须在一个恒定的稳健的步伐。
- 当输液完成后,小心取下注射器和钢丝更换成丝杠。封闭伤口粘和小鼠前(2.7)恢复的药物,并允许恢复变暖垫。
4。治疗的挑战
- 4天的U87MG细胞接种后,小鼠称重,随机分为对照组和治疗组。
- 对照组给予PBS(100μL)腹腔(IP)的注射,而治疗组给予AMG102(100微克,在100μL的PBS)的IP注射。
- 重复注射每隔一天为14天,共6注射(图2)。
- 最后的注射后,老鼠每天监测和权衡每隔一天。
- 当小鼠开始显示显著的神经功能障碍(平衡紊乱,瘫痪),脱水,或超过10%的重量损失或垂死的,他们被人道人道毁灭。这些人性化的终点天,然后记录Kaplan - Meier生存曲线。
5。治疗效率的评价
6。代表性的成果:
控制动物开始后显示的初始接种细胞,神经系统紊乱和减肥23天的迹象。这是在35天的AMG102组显着延迟。事实上,35天,77%(N = 7 / 9),对照组已安乐死。 Kaplan - Meier生存曲线清楚地表明AMG102治疗(图3)的存活率显着增加。 70天,对照组小鼠的88%已被实施安乐死(N = 8 / 9)相比,37%(N = 3 / 8)AMG102治疗组。大脑的组织学分析证实,在对照组的全部9个动物开发的肿瘤相比,只有8 AMG102治疗的小鼠(图4)3。
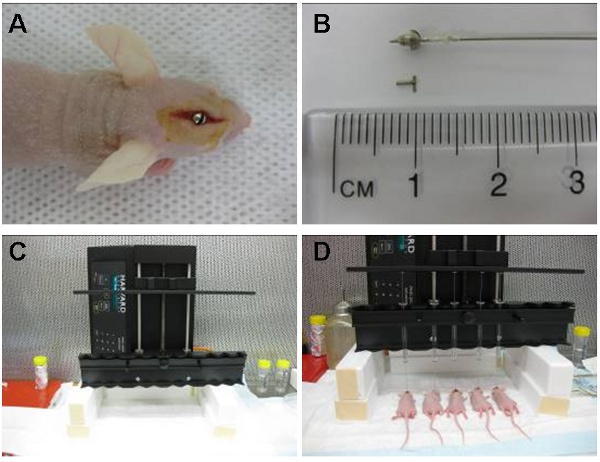
图1:图像(a)显示在上方位于尾状核的区域定位颅内丝杠。铐汉密尔顿注射器(与细胞预装),然后放置内丝杠2毫米的针头,使超出指导和尾状核细胞内注入3.5毫米。注射器后取出,取而代之的是一个钢丝(二)。自动输液器(C)可以注入10只动物在同一时间。这里展示的是五(四)同时注射。

图2:原理的研究协议。 0天细胞注射治疗第4天开始。对照组动物注射PBS(100μL)的IP,而治疗组接受注射的AMG102(100μg/100μL)IP。这些注射,每隔一天为10天。一共有6次注射。动物被监测的70天的神经系统和物理扰动的迹象。

图3:Kaplan - Meier生存曲线比较控制和治疗的小鼠AMG102。 AMG102(P = 0.005),治疗后获得显著的生存。

图4:显微冠状脑肿瘤的发展,在控制动物(一)在AMG102治疗的动物和无脑肿瘤的发展(二)部分展示。比例尺为1毫米。
Discussion
这里介绍的方法,使颅内丝杠快速,重现性颅内移植瘤的建立和一个受过训练的动物技术人员手中,这个过程是很容易没有立体定向设备的需要的情况下进行。我们的方法结合使用一个丝杠,准确地找到最适合在体内肿瘤的发展的大脑区域,并自动输液泵,允许多达10只动物同时接种一次。丝杠隆胸过程只需不到5分钟执行。细胞在30μL/小时的自动输液需要5μL体积仅有10分钟。这将确保以恒定速率准确的剂量和减少额外的颅区,由于颅内压增高的细胞被驱逐的风险。 10μL卷,我们也执行此过程,并没有观察到任何额外的颅内肿瘤的生长,由于细胞回流。至于自动输液泵还允许几种动物同时接种,我们可以注入高达每小时60动物相比,一个立体的过程,是有限的,以每小时约15%的动物。
在此过程中最关键的一步是在颅骨的指导螺丝的位置,作为它的位置决定了肿瘤体积的最终位置。如果丝杠过中央,细胞会被注入到地区之间的两个大脑半球,而如果引导有条件向前,细胞将不会被注入到大脑的。因此,必须在尽可能准确定位指南2.5毫米的横向和1毫米,前囟 1 。在这项研究中,我们使用了钢丝杠,虽然塑料导向螺钉也可用于这些研究需要脑成像如MRI或PET 6 。即使自动输液泵的成本对某些群体望而却步,细胞仍然可以被注入速度比手动更立体定向的方法。总体而言,这种快速,准确,重现性的方法可用于研究脑胶质瘤,髓母细胞瘤和脑干肿瘤 7 。我们两国之间由于意外麻醉反应(<1%)死亡的实验室,超过500只已执行此过程。小鼠,狂奔与丝杠,并随后注入与细胞没有死亡或遭受任何神经系统并发症,作为一个过程的结果。动物存活过去的100天,无任何并发症。虽然我们倾向于使用像头发的SCID一个无毛小鼠,免疫能力受损的老鼠会一样,适当提供头骨头发前去除手术,以保持工地清洁,防止头发干扰丝杠。
有几个为脑胶质瘤8-10的治疗目前正在制订的新疗法。最近,我们发现,皮下的U87MG胶质瘤异种移植可以治疗AMG102 3的抑制作用;向肝细胞生长因子,目前正在进行5胶质瘤临床评价一个人源化抗体。我们所采用的方法在这里描述的,建立在裸小鼠的大脑颅内的U87MG肿瘤。我们的研究清楚地表明该方法的实用工具和演示,AMG102显著抑制原位的U87MG移植瘤的生长。我们将继续使用这个模型来确定与AMG102可使用其他疗法相结合,以获得更有效地抑制肿瘤生长。
Disclosures
这项工作是支持由安进公司从一个研究资助
Acknowledgments
作者想感谢的援助,在发展中国家这种模式Verlene亨利和Lindsay霍尔姆斯。这项工作是部分资金由詹姆斯S麦克唐纳基金会(#220020173)。
Materials
| Name | Company | Catalog Number | Comments |
| DMEM/F12 | Invitrogen | 12634010 | |
| FCS | Bovogen | SFBS | |
| Trypsin | Invitrogen | 15050065 | |
| EDTA | Sigma-Aldrich | E6758 | |
| Balb/c nu/nu mice | ARC Perth | ||
| Screw Holder | Plastics One | SD-1 | |
| Drill Holder | Plastics One | DH-1 | |
| Drill Bit | Plastics One | D#60 | |
| Screw guide (metal) | Plastics One | C212SG | |
| Screw Dummy (stylus) | Plastics One | C212SD | |
| Hamilton Syringe (10 μl 26g cemented needle) | Grace Division Discovery Science | 80075 | |
| PHD 22/2000 infusion pump | Harvard Apparatus | 70-2003 | Optional |
| Vetbond | 3M | 1469SB | |
| Thermo pad | Harvard Apparatus | 340390 |
References
- Lal, S. An implantable guide-screw system for brain tumor studies in small animals. J Neurosurg. 92, 326-333 (2000).
- Jun, H. T. AMG 102, a fully human anti-hepatocyte growth factor/scatter factor neutralizing antibody, enhances the efficacy of temozolomide or docetaxel in U-87 MG cells and xenografts. Clin Cancer Res. 13, 6735-6742 (2007).
- Pillay, V. The plasticity of oncogene addiction: implications for targeted therapies directed to receptor tyrosine kinases. Neoplasia. 11, 448-458 (2009).
- Buchanan, I. M. Radiosensitization of glioma cells by modulation of Met signaling with the hepatocyte growth factor neutralizing antibody. AMG102. J Cell Mol Med. 15, 1999-2006 (2011).
- Wen, P. Y. A phase II study evaluating the efficacy and safety of AMG 102 (rilotumumab) in patients with recurrent glioblastoma. Neuro Oncol. 13, 437-446 (2011).
- Caretti, V. Monitoring of Tumor Growth and Post-Irradiation Recurrence in a Diffuse Intrinsic Pontine Glioma Mouse Model. Brain Pathol. 4, 441-451 (2011).
- Jallo, G. I., Volkov, A., Wong, C., Carson, B. S., Penno, M. B. A novel brainstem tumor model: functional and histopathological characterization. Childs Nerv. Syst. 22, 1519-1525 (2006).
- Johns, T. G. The efficacy of epidermal growth factor receptor-specific antibodies against gliomaxenografts is influenced by receptor levels, activation status, and heterodimerization. Clin Cancer Res. 13, 1911-1925 (2007).
- Scott, A. M. A phase I clinical trial with monoclonal antibody ch806 targeting transitional state and mutant epidermal growth factor receptors. Proc. Natl. Acad. Sci. U. S. A. 104, 4071-4076 (2007).
- Niyazi, M. Therapeutic options for recurrent malignant glioma. Radiother. Oncol. 98, 1-14 (2011).



