Summary
최적의 절삭 온도 매체 (OCT)에 포함 된 고정되지 않은 냉동 조직 샘플은 숨겨진 점액 자연 유통 및 글리코 실화를 공부하는 데 사용할 수 있습니다. 이 접근법 조직 처리에 최소한이며, glycolipids, mucins 및 glycan - epitopes의 자연 프리젠 테이션는 보존됩니다. 조직 섹션은 형광 또는 chromogenic 검색을 사용하여 immunohistochemistry에 의해 분석 할 수 있습니다.
Abstract
Mucins 무게 1-3으로 70 % 이상 탄수화물을 포함 복잡하고 크게 glycosylated O-링크 glycoproteins입니다. 분비의 mucins은 고 블렛 셀과 위 점막에서 생산, 마이크로 미터 두께의 점액 층의 비계를 제공하는 선 내장 및 호흡기 3,4의 상피 조직. mucins뿐만 아니라, 점액 레이어는 또한 항균 펩티드, 크린 시토 킨, 그리고 면역 글로불린 5-9가 포함되어 있습니다. 점액 층은 호스트 타고난 면역의 중요한 부분이며, 미생물 8,10-12을 침해 방어의 첫 번째 라인을 형성한다. 따라서 점액이 미생물과 다양한 상호 작용에 따라 달라질 수 있습니다, 모두 병원균과 symbionts 및 분비의 mucins이 상호 작용에 대한 중요한 인터페이스를 형성하고 있습니다. 이러한 생물학적 상호 작용의 연구는 일반적으로 조직 수집 및 착색에 대한 조직 학적 방법을 포함한다. 조직 수집 및 preserv에 대한 두 가지 가장 일반적으로 사용되는 조직 학적 방법병원 및 연구소의 ation은 다음과 같습니다 포르말린 고정은 cryo-protectant 미디어에 삽입하여 다음에 파라핀 삽입하여 다음과 조직 냉동.
파라핀 - 임베디드 조직 샘플은 명확하고 잘 정의 된 형태를 포함한 조직 학적 시각화에 대한 최적의 품질로 섹션을 생산합니다. 그러나, 파라핀 삽입 과정에서 epitopes의 숫자가 변경 이러한 epitopes을 연구하기 위해, 조직 섹션은 더 많은 에피토프 검색 방법 13 하나 처리해야된다. 분비 mucins 및 지질은 유기 용제 (크실렌 또는 Citrisolv)로 부화을 연장해야 파라핀-퍼가기 소요되는 단계 동안 조직에서 추출됩니다. 그러므로이 방법은 mucins 및 생체 내 점액의 성격 및 배포에 초점을 연구에 대한 하위 최적입니다.
대조적으로, 최적의 절삭 온도에서 동결 조직 (OCT)는 매체를 삽입공극 샘플의 탈수 및 개간 및 샘플 보습을 유지합니다. 이것은 수화 점액 층의 더 나은 보존이 가능하고, 따라서 상피 생물학 mucins의 다양한 역할 연구를 할 수 있습니다. 이 방법은 조직의 최소한의 처리를 필요에 따라, 조직은보다 자연 상태로 보존되어 있습니다. 따라서 냉동 조직 섹션 전에 착색에 대한 추가 처리를 필요로하지 않으며 쉽게 immunohistochemistry 방법을 사용하여 분석 할 수 있습니다.
우리는 냉동 대장 샘플에 마이크로 미터 두께의 분비 점액 층의 보전을 보여줍니다. 같은 조직은 파라핀에 포함 된 경우 계층은 크게 감소된다. 우리는 또한 공장 lectins를 사용하여 mucins에 표시 glycan의 epitopes의 immunofluorescence 얼룩을 보여줍니다. 이 방법의 장점은 특별한 fixatives의 사용을 요구하고 이미 연구실에 보존 할 수 있습니다 냉동 조직을 활용 할 수 없다는 것입니다.
Protocol
1. 10월의 조직 퍼가기
- 얕은 스티로폼 상자에 2 메틸 부탄에 드라이 아이스를 추가하여 냉동 욕조를 준비합니다.
- 조직을 수확하고, 부드럽게 초과 액체를 건조하기 위해 조직 종이에 습기. 스냅 - 냉동 조직을 (액화 질소에 냉동 된 조직)을 사용하면, 조직은 cryo-마이크로톰 챔버에 배치하여 -20 ° C까지 따뜻하게 할 수 있습니다.
- 충분히 금형의 하단을 충당하기 위해, 필-A-웨이 냉동 금형에 10월의 작은 금액을 추가합니다.
- 금형의 조직을 놓고, 조직이 원하는 방향에있는 금형의 하단에 안식되어 있는지 확인하십시오. 일단 냉동 조직 블록은 바닥에서 또는 측면에서 중 sectioned 될 것입니다.
- 10월과 조직을 커버하고, 냉동 목욕탕에 금형을 배치합니다. 조직은 냉동으로 10월 화합물은 흰색으로 바뀝니다.
- 일단 표시된 냉동 가방에 냉동 블록과 장소에서 금형 껍질을 벗기면 냉동.
- 냉동 블록이 유지 될 수-80 ° C에서 사용까지.
2. Sectioning 조직
- 장소 조직 cryo-마이크로톰 챔버에 블록, 그들을 -20 ° C를 (약 30 분)에 도달 할 수 있습니다.
- 3-5 μm 두께의 섹션을 잘라 내고 섹션의 상단에 긍정적 요금이 부과 유리 슬라이드를 놓습니다. 조직 슬라이드를 준수합니다.
- 항공은 30-60 분의 조직을 건조.
- 슬라이드는이 단계에서 사용할 수 있습니다, 또는 그들은 -80 ° C에서 나중에 사용하기 위해 보관 할 수 있습니다.
3. 조직 염색법
- -80에 저장된 슬라이드 ° C : 슬라이드가 30 분 동안 실온에서 건조 해동과 공기 할 수 있습니다.
- 10 % 상온에서 30 분에 포르말린 버퍼로 슬라이드를 수정합니다.
- 250 ML 버퍼에있는 슬라이드에게 10 번을 찍어 각 세척을위한 PBS 또는 TBST 버퍼에 세 번 씻으십시오. PBS 버퍼 인산 가수 분해 효소 - conjug 알카라인와 chromogenic 검색을 위해, 그러나, immunofluorescence 얼룩 사용할 수 있습니다항체를 ated, TBST은 PBS에있는 인산염부터 사용되어야은 알카라인 인산 가수 분해 효소 활동을 억제한다.
- 조직 섹션 슬라이드 이제 물들 할 수 있습니다.
4. 점액을 감지하는 등 Alcian 블루와 정기 산성 스키 프와 같은 Histochemical 착색제를 사용하여
- Alcian 블루 얼룩 :
- 물에 슬라이드를 씻어 상온에서 3 분 3 % 아세트산에 품다.
- 실온에서 30 분에 Alcian 블루 산도 2.5 솔루션 청바지.
- 10 분에 수돗물을 실행에 슬라이드를 씻으, DI 물에 씻어.
- 상온에서 5 분을 위해 원자력 빠른 빨간색으로 Counterstain.
- 워시는 DI 물에 세 번 슬라이드.
- 정기 산성 스키 프 얼룩 :
- 물에 슬라이드를 씻어, 5 분을위한 신선하게 조리 된 1% 정기적으로 산에 품다.
- DI 물에 세 번 씻어 한 번 miliQ 물에 담구.
- 객실 temperatur 15 분 동안 쉬프 시약으로 얼룩5.
- 10 분에 수돗물을 실행에 슬라이드를 씻으, DI 물에 씻어.
- 실온에서 30 초에 Surgipath Hematoxylin에 Counterstain.
- 워시는 DI 물에 세 번 슬라이드.
- 배양은 상온에서 스캇의 수돗물에 30 초를 슬라이드.
- DI 물에 세 번 씻으십시오.
- 탈수 및 100 % 에탄올에 세 신속한 변경 및 Citrisolv의 세 변화, 2 분마다 다음 95 % 에탄올에서 1 분, 잠복기하여 슬라이드를 취소합니다. 실온에서 모든.
- 수지 매체 (Cytoseal 60)와 coverslips에 슬라이드를 탑재합니다.
5. Histochemical 방법으로 Glycan Epitopes를 감지 할 수 Lectins과 항체 (표 1)를 사용
- lectins로 3 glycan의 epitopes의 형광 검출를 들어, 실온에서 10-30 분 동안 PBS에 1 % BSA와 함께 슬라이드를 차단합니다.
- biotinylated 렉틴이 사용되기 때문에, 0.1 %로 15 분 잠복기에 의해 내생 비오틴를 차단아비딘은 실온에서 0.01 % 비오틴과 15 분 부화 다음.
- 각 차단 단계 후에 PBS에서 슬라이드를 씻으십시오.
- 갓 1 μg / ML Rhodamine-복합 succinylated 밀 배아 agglutinin (sWGA), 1.3 μg / ML biotinylated Sambucus nigra agglutinin (SNA), 5 μg / HEPES / NaCl 버퍼에 ML Fluorescein-복합 Jacalin (10 밀리미터 HEPES,의 혼합물을 준비 150 MM NaCl의 산도 7.5).
- 평평한 표면 또는 착색 상자 및 레이어 상단에있는 렉틴 혼합물 장소 슬라이드. 혼합 볼륨이 부드럽게 액체를 parafilm을 배치하여 감소 될 수 parafilm는 액체를 평탄하고 증발을 방지 할 수 있습니다.
- 어둠 속에서 실온에서 1 시간을 품다.
- 워시는 PBS로 세 번 슬라이드.
- 0.7 μg / ML streptavidin - 복합 CY5 (biotinylated-SNA를 감지 할), 그리고 어둠 속에서 실온에서 30 분에 품다와 레이어 슬라이드.
- 워시는 PBS로 세 번 슬라이드.
- 0.1 & m로 핵을 CounterstainU; g / ML DAPI.
- VectaMount 설치 미디어 (또는 수성 미디어) 등의 수성 매체가 coverslips에 슬라이드를 탑재합니다.
6. 렉틴 염색의 특이성에 대한 통제
- 렉틴 염색의 특이성 전에 얼룩을 대상 glycan 에피토프의 특정 효소 절단 또는 작은 분자와 경쟁하여 중 제어됩니다.
- Sambucus nigra agglutinin (SNA) 결합 특이성에 대한 효소 절단
- 250 50 MM 나트륨 아세테이트 산도 5.5의 무 / ML에 Arthrobacter ureafaciens sialidase (AUS)을 희석.
- 팁 박스 빈의 바닥에 물을 추가이 부화하는 동안 습윤 챔버를 형성합니다.
- 장소 슬라이드 coverslip으로 슬라이드와 커버에 팁 박스, 층 150-200 μl AUS 솔루션의 상단 트레이에 직면하고 있습니다. 기포 형성을 피하십시오.
- 2.5 시간에 37 ° C에서 상자 뚜껑과 품다를 닫습니다.
- 워시 룸 성질에 PBS로 3 번 슬라이드무료로 sialic 산을 제거 할 ature. 이 슬라이드는 SNA의 착색에 대해서는 제외해야합니다.
- Jacalin 및 succinylated 밀 배아 agglutinin (sWGA) 특이성에 대한 경쟁력 억제제
- 렉틴 혼합물의 나누어지는 200 μl 단계 5.4 두 Eppendorf 용 시험관에 준비했습니다.
- 다른 유리 병에 1시 10분 희석에서 병 및 키틴 - 가수 분해물 (sWGA 억제제) 중 하나에 200 MM Melibiose을 (Jacalin 억제제)를 추가합니다.
- 있는 오버레이 대조군 슬라이드 억제제 함유 슬라이드의 나머지 부분과 같은 시간에 실온에서 혼합 및 품다 1 시간입니다. 이 슬라이드는 각각 Jacalin 또는 sWGA의 착색에 대해서는 제외해야합니다.
7. 대표 결과
cryo-protectant 미디어 (OCT)에 포함 된 냉동 조직에 파라핀에 포함 된 조직 샘플 사이의 비교는 muci에 얼룩의 보존과 품질에서 큰 차이점을 보여N의 glycoproteins. 이러한 Alcian 블루와 정기 산성 스키 프와 같은 histochemical 염료와 조직 염색법은 냉동 또는 파라핀 임베디드 샘플 (그림 1)에서 비교 조직 섹션에서 매우 다른 결과를 생산하고 있습니다. 이 나타납니다 유기 용매 파라핀 삽입 과정에서 사용되는 (크실렌 또는 Citrisolv)은 상피 조직에서 분비의 mucins 배포뿐만 아니라 많은 샘플 (그림 2)에서 glycolipids의 제거 등의 영향을 미칩니다. 그 결과, 점액 층은 점막 세포에 쓰러져 대부분 블렛 세포에서 발견됩니다 나타납니다. cryo-protectant 미디어 조직의 플래시 동결 (OCT)는 샘플 보습을 유지하고 분비 mucins 레이어 크기를 보존. 파라핀 퍼가기 과정은 비슷한 방식으로 다른 점액 - 관련 glycans 및 glycolipids에 영향을. Glycan 배포를 찾을 epitopes에 대해 정기적으로 glycan 탐지에 사용되는 lectins, (그림 3)과 항체를 사용하여 검사를 한mucins 및 glycolipids (그림 6). 렉틴 구속력이 잘 정의되지 않고 glycans뿐만 아니라 glycan 구조 14,15의 공간적 분포의 영향 때문에 렉틴 착색에 대한 적절한 컨트롤을 적용하는 것이 중요합니다. 효소 절단 및 경쟁 억제 : 여기 우리는 테스트 조직에 렉틴 착색을 제어하기위한 두 가지 방법을 보여줍니다. glycan의 epitopes의 절단은 glycan 특정 효소와 조직 섹션을 소화하여 수행, 예를 들어 세균 sialidase에 대한 SNA (그림 4)에 의해 구속력을 sialic 산성에 대한 제어 있습니다.되었습니다 특정 효소 (예 glycosidase) 공부 glycan 에피토프를 제거를 사용할 수 없습니다 경우에는 렉틴 특이성은 이러한 sWGA의 착색에 대한 Jacalin의 착색 또는 키틴 - 가수 분해물에 대한 Melibiose (그림 5)와 같은 경쟁력있는 억제제를 추가하여 확인 할 수 있습니다.
우리는 스냅 - 냉동 조직 샘플은 어느 rou 것을 여기에 설명tinely 병원과 연구소의 취득, 추가 10월에 포함하고 점액 glycoproteins하고에 존재하는 많은 glycans을 연구하는 데 사용할 수 있습니다.
| 렉틴 / AB | 출처 | 주요 특성 |
| LFA | Limax flavus (황색 탄환) | 터미널 SIA |
| MAA의 * | Maackia amurensis (아무르 Maackia) | Galβ1-R에 Siaα2-3Galβ1-R / 3-O-황산 |
| SNA | Sambucus nigra (Elderberry) | Siaα2 - 6Gal / Siaα2 - 6GalNAc |
| WGA | Triticum의 vulgaris (밀 배아) | GlcNAcβ1 - 4GlcNAcβ1-4GlcNAc / SIA |
| sWGA | Succinylated Triticum의 vulgaris (밀 배아) | GlcNAc & B도착 예정 시간, 1 4GlcNAcβ1 - 4GlcNAc |
| PNA | Arachis hypogaea (땅콩) | Galβ1 - 3GalNAc (수정되지 않은 T-항원) |
| Jacalin | Artocarpus integrifolia (Jacalin) | Galβ1 - 3GalNAc는 O-링크 glycans에서 발견 |
| ECA | Erythrina cristagalli (산호 나무) | Galβ1 - 4GlcNAc |
| TKH2 | 항독소 | O-링크 glycans에 Siaa2-6GalNAc (역) |
| CA19-9 | 항독소 | Siaa2 - 3Galβ1-4 (Fuca1-3) GlcNAc (SLe) |
| SNH3 | 항독소 | Siaa2 - 3Galβ1-3 (Fuca1-4) GlcNAc (SLe X) |
약어 : AB, 항체, SIA, Sialic 산, 걸, 갈락토오스, GalNAc,
표 1. glycan의 epitopes에 대한 lectins과 항체의 일부 목록입니다.
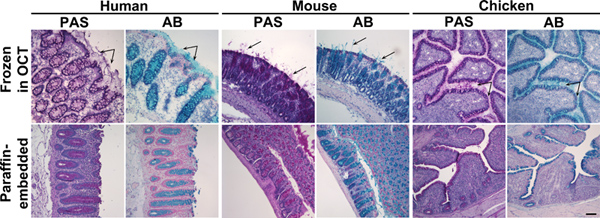
1 그림. Alcian 블루 및 냉동 및 파라핀 - 임베디드 결장 조직의 정기적 산성 스키 프 착색. 인간, 마우스 또는 닭 결장 표본의 조직 섹션 10월 (위 패널)에 냉동 또는 파라핀 (아래 패널)에 포함이 정기 산 스키 프 (PAS)에 물들되었습니다 또는 Alcian 블루 (AB). 이 시약은 각각 분홍색이나 파란색 점액을 얼룩. 상단 패널 : 냉동 조직에서 고 블렛 셀에 mucins뿐만 아니라, 분비의 점액도 마주했다였죠 (화살표). 낮은 패널 :에서 파라핀 - 임베디드 조직, 점액의 착색은 고 블렛 셀에 국한되었다. 핵은 Surgipath (PAS) 또는 메이어의 (AB) Hematoxylin과 counterstained했다. 스케일 바는 100 μm을 나타냅니다. 큰 그림을 보려면 여기를 클릭하십시오 .

그림 2. 10 % 포르말린 버퍼와 수화 (왼쪽 패널) 유지에 mucins의 상당한 손실 Citrisolv의 배양 결과입니다. 냉동 닭 회장의 표본의 직렬 섹션은 연속 70%에서 부화, 90 % 및 100 % 에탄올에 의한 에탄올의 탈수 20 분 동안 고정 된 각 (가운데 패널) 또는 에탄올에 수분이 1 시간 (오른쪽 패널)에 대한 Citrisolv에게 허가. 건조 샘플은 Hematoxylin과 Eosin (H & E) 또는 Alcian 블루 염색하기 전에 PBS로 rehydrated되었습니다. 에탄올 탈수 및 Citrisolv 개간 개선 조직 morphology (예를 들어, 맨 위에, 중간 및 오른쪽 이미지를 대 왼쪽 이미지). 에탄올 탈수는 Alcian 블루 착색 (중간 행, 왼쪽 중간 이미지를 비교)에 더 큰 영향을 미치지 않았다. 반면, Citrisolv의 부화는 Alcian 블루 착색을 감소 파라핀 - 임베디드 조직 (그림 1)에서 볼 수 비슷했다 패턴의 고 블렛 셀 (중간 행, 오른쪽 이미지)에 국한. 이 데이터는 파라핀 - 임베디드 샘플에 점액의 과립의 강한 착색이 소요되는 단계에서 감소하고 잔 세포에서 점액의 응축에 의한 것을 암시. 냉동 월 임베디드 조직에서 점액의 희미하고 덜 조밀 한 착색은 조직에서 점액의 더 자연 분포를 반영합니다. 박스 지역의 높은 배율은 화살표로 표시됩니다. 스케일 바는 50 μm (상단 및 중간 행)와 10 μm (하단 행)을 나타냅니다.

그림 3. 의 바인딩냉동 및 파라핀 - 임베디드 조직에 glycan의 epitopes에 lectins. 치킨 소장 (회장) 표본은 10월 (상단 패널)에 냉동 또는 Jacalin (파란색), sWGA (녹색)와 SNA를 탐색했다 (아래 패널) 파라핀에 포함 (빨간색 ). 박스 지역의 높은 배율은 화살표로 표시됩니다. 냉동 조직에서 O-링크 glycans에게 구속력 Jacalin는 루멘 (Jacalin, 상단 패널, 화살표)로 블렛 셀에서 흘러 것으로 보인다 구조를 공개했다. 반면, 파라핀 - 임베디드 조직에 대한 구속력을 Jacalin는 고 블렛 셀 (Jacalin 낮은 패널, 화살표)과 villi 브러시 테두리 (왼쪽 하단 이미지, 화살표)에 국한되었다. β1-4GlcNAc의 sWGA의 착색은 부분적으로 모두 냉동 조직의 Jacalin의 렉틴의 바인딩 (상단 패널, 화살표)로 공동 번역과에서 조직 (하단 패널, 화살표) 파라핀 - 임베디드. 반면, α2-6 연결 sialic 산에 바인딩 SNA의 렉틴은 (SNA, 화살촉) 세포이며, Jacalin (색상 공동 현지화되지 않습니다붉은 색의 이미지, SNA는 화살촉, 점선 화살표로 표시된 파란색으로 Jacalin)로 표시된. 스케일 바는 100 μm (왼쪽 이미지) 및 20 μm을 (확대 박스 영역) 나타냅니다.

4 그림. SNA와 sialic 산성 염색을위한 효소 절단 제어. 치킨 소장의 표본은 37 ° C.에 250 무 / ML Arthrobacter ureafaciens sialidase (AUS) 또는 2.5 H 50 MM 나트륨 아세테이트 산도 5.5 버퍼와 incubated되었습니다 AUS 치료 sialic 산에 SNA 결합 특이성을 확인, biotinylated SNA와 얼룩 시킨다는. 스케일 바는 100 μm을 나타냅니다.

그림 5. Jacalin 및 sWGA과 glycan 착색을위한 경쟁 저해 제어 할 수 있습니다. 치킨 소장 (회장) 표본은 특정 lec의 존재에 Jacalin와 sWGA 혼합물에 incubated되었습니다주석 억제제 : Melibiose (가운데 열), 키틴 - 가수 분해물 (오른쪽 열) 또는 억제제없이 (A와 D). 어퍼 패널 (왼쪽) 억제제없이 Jacalin의 착색. (중앙) Jacalin의 착색은 Melibiose에 의해 저해되었다. (오른쪽) 키틴 - 가수 분해물은 Jacalin의 착색을 억제하지 않았습니다. 낮은 패널 (왼쪽) 억제제없이 sWGA의 착색. (중앙) Melibiose는 sWGA의 착색을 억제하지 않았습니다. (오른쪽) sWGA의 착색은 키틴 - 가수 분해물에 의해 저해되었다. 이 억제는 조직과 lectins의 특정 상호 작용을 확인합니다. 착색 억제의 별표 마크 이미지입니다. 스케일 바는 100 μm을 나타냅니다.

6 그림. 분비의 mucins, glycolipids 및 냉동 인간의 대장 암 조직에서 glycan epitopes의 감지. villous 암과 점액 암에서 대장 암 biopsies는 액체 질소 스냅인 냉동 있었고, 10월에 포함. 조직 섹션은 1 H에 대한 incubated되었습니다분비 점액에 대한 항체와 MUC5AC는 sialyl 루이스 - glycan 에피토프는 gangliosides (대장 암 마커 CA 19-9)에 있으며 sialyl-TN - mucins에 풍부한 glycan의 에피토프은 (TKH2 항체를 검출)와 30 분 배양 한 다음 biotinylated 당나귀 안티 - 마우스 IgG 항체 보조하고, 퍼 옥시 데이즈 - 복합 streptavidin으로 30 분 배양. 추가 조직은 퍼 옥시 데이즈 - 복합 streptavidin으로 30 분 부화 다음, biotinylated lectins SNA와 sWGA으로 1 시간에 incubated되었습니다. 퍼 옥시 데이즈의 착색은 AEC 키트를 사용하여 개발되었습니다. 블랙 규모 바는 200 μm을 나타냅니다.
Discussion
냉동 조직의 점액과 glycan epitopes의 보존은 파라핀에 포함 된 조직의 우수합니다. 우리는 분비의 점액 층 (그림 1 및 3)과 파라핀 - 임베디드 조직에 비해 냉동 조직의 세 glycans 구조의 분포 (그림 3)의 보전을 보여 주었다. 이러한 Carnoy의 솔루션으로 전문 fixatives은 (60 % 에탄올, 30 % 클로로포름, 10 % 아세트산) 17는 조직 샘플에있는 점액 층의 최적의 보존을 위해 개발되었습니다. 최적이 솔루션은 점액 연구에 최선을 다하고 있습니다 조직 샘플을 수집하는 데 사용되어야하며 점액 층 16-17의 원활한 모양을 유지하기 위해 표시되었습니다. 10월에 포함 된 고정되지 않은 냉동 샘플의 점액 층이 견고 나타나고 일부 지역에서 조직에서 분리 할 수 있습니다, 그러나 전체 층의 두께는 Carnoy의 솔루션과 embedd 고정 된 조직에서 관찰 그와 계약에파라핀 16-17에서 거구나. 16 - 예를 들어, 냉동 인간의 결장 조직 섹션에있는 점액 층은 Carnoy's - 고정 인간 대장 샘플 55.4 ± 2.5 μm (204.8 μm 범위 7.7)에 대한보고 범위 내에 ~ 100 μm (그림 1)입니다.
그것은 수십 년 동안 알려져왔다 그 생물 표본 18 ~ 30 %의 수축 및 조직 13 일부터 같은 크실렌 등의 유기 용제, Citrisolv과 어느 정도 클로로포름 추출 지질, glycolipids하고는, 단백질한다는 점에서 에탄올 탈수 결과. 고정 (10 % 포르말린 버퍼), 탈수 (증가 에탄올 농도) 및 어음 (Citrisolv 또는 크실렌) : 파라핀 삽입하기위한 조직 처리는 다음 단계가 포함되어 있습니다. 고정되지 않은 냉동 조직 섹션에서 다음 단계를 모방함으로써, 우리는 Citrisolv합니다 (Figur 파라핀 - 임베디드 조직의 그것과 비슷 조직 형태의 결과로 냉동 조직 섹션에서 점액을 추출하는 증명전자 2, 오른쪽 패널). 반면, 점액 층은 (그림 2, 왼쪽과 중앙 패널) 포르말린 또는 에탄올과 부화에 의해 변경되지 않았습니다. 이 제안이 Citrisolv / 크실렌에서 장시간 배양을 필요로 표준 파라핀 퍼가기 절차의 소요 단계, 점액 층의 붕괴의 결과. 포르말린 고정이 쉽게 glycans, glycolipids 및 단백질 (그림 2, 3, 6)에 대한 lectins과 항체 물들 일 수있는 포르말린으로 고정 된 점액 층 및 냉동 조직 섹션을 손상하지 않습니다. 이러한 효과는 막에 바인딩 단백질 및 조직 병리의 연구 크지 않을 수 있습니다하지만, 이러한 분비 점액 층으로 높은 수화 구조에 망연자실하고 있습니다. mucins의 그러나 조직 학적 연구는 계속 점액 층 보존 차선이있는 파라핀 - 임베디드 샘플과 주로 실시하고 있습니다. 이러한 SE의 정확한 신원과 같은 점액 층 구성의 깊이 분석에서creted 또는 막 바운드 MUC 당 단백질의 조합은 특정 항체와 단백질 백본의 식별을위한 대량 분석법이 필요합니다. 점액 층의 보존은 연구뿐만 초기 요구 사항입니다.
대부분의 실험실은 다른 프로젝트에 과거에 수집 된 10월에 냉동 조직 샘플이 조직은 쉽게 mucins, glycolipids 및 점액 보존을 위해 독특하게 디자인 된 특수 fixatives으로 조직을 수집 할 필요가 없습니다 glycan 분포를 연구하는 데 사용할 수 있습니다. 냉동 조직은 최소한의 처리를 받아야하기 때문에 자연의 수화 아르 glycans의 자연 배포, 보존되어 있습니다. 이 미생물 - 호스트 상호 작용의 영역에서 특히 중요합니다. 이 "장벽"분자 장식 분비의 mucins과 많은 glycan 구조의 자연 배포하고 풍부한 지식은 호스트 방어, 미생물 착취와 pathogenes을 이해 열쇠가 될 것이다수 있습니다.
Disclosures
관심 없음 충돌이 선언 없습니다.
Acknowledgments
저자는 닭 조직을 수확에서의 도움 니콜 M. 네 메스 (조지아 대학)와 쟌느 M. 페어 (LANL)를 감사하고, 촬영하는 동안 그의 도움 스티븐 A. 스프링 것입니다. 본 연구의 모든 조류의 보호는 로스 알 라모스 국립 보안, LLC, 로스 알 라모스의 운영자에있는 기관 동물 케어 및 사용위원회에 의해 승인되었습니다 실험실 동물과 모든 프로토콜의 인도적인 사용을위한 건강 지침 국립 연구소 준수에 있었던 계약에 따라 국립 연구소 에너지 미국학과와 번호 DE-AC52-06NA25396. 본 연구의 생쥐의 보호는 UCSD 동물 승인 프로토콜을 준수하고 있습니다. 인간 조직은 UCSD 승인의 IRB 프로토콜의 일환으로 획득했다. 이 작품은 캘리포니아 랩 요금 회장 프로그램의 대학 (PG)와 보조금 NS047101 신경 질환 국립 연구소에서와 뇌졸중 (신경 과학의 현미경 공유 시설, UC 샌디에고)에서 보조금 118,645에 의해 지원되었다.
Materials
| Name | Company | Catalog Number | Comments |
| 2-methyl butane | Fisher Scientific | 03551-4 | |
| AEC peroxidase substrate kit | Vector Labs | SK-4200 | |
| Alcian Blue | Sigma-Aldrich | A3157 | |
| Anti-CA 19-9 monoclonal antibody | Calbiochem | CA1003 | |
| Anti-MUC5AC monoclonal antibody | Millipore | MAB2011 | |
| Avidin-Biotin blocking kit | Vector Labs | SP-2001 | |
| Biotinylated donkey anti-mouse antibody | Jackson Immunoresearch | 90863 | |
| Biotinylated SNA | Vector Labs | B-1305 | |
| Bovine serum albumin | Sigma-Aldrich | A4503 | |
| Chitin-hydrolysate | Vector Labs | SP-0090 | |
| Cryostat microtome | Leica Microsystems | Leica CM 1800 | |
| Hematoxylin | Surgipath Medical Ind. | 3801570 | |
| Hydrogen peroxide 30% | Fisher Scientific | H325-100 | |
| Jacalin-FITC | Vector Labs | FL-1151 | |
| Mayer's Hematoxylin | Sigma-Aldrich | MHS32 | |
| Melibiose | Sigma-Aldrich | M5500 | |
| Nuclear Fast Red | Vector Labs | H-3403 | |
| OCT compound | VWR International | 25608-930 | |
| Peroxidase conjugated streptavidin | Jackson Immunoresearch | 94638 | |
| Schiff reagent | Electron microscopy sciences | 26052 | |
| sWGA-Rhodamine | Vector Labs | RL1022S | |
| TKH2 monoclonal antibody | ATCC | HB-9654 | |
| VectaMount aqueous mounting media | Vector Labs | H-5501 | |
| Cytoseal 60 | Thermo Scientific | 8310-4 | |
| Peel-A Way molds | Polysciences Inc. | 18646A-1 |
References
- Slayter, H. S., Wold, J. K., Midtvedt, T. Intestinal mucin of germ-free rats. Biochemical and electron-microscopic characterization. Carbohydr. Res. 222, 1-9 (1991).
- Lamblin, G. The carbohydrate diversity of human respiratory mucins: a protection of the underlying mucosa. Am. Rev. Respir. Dis. 144, S19-S24 (1991).
- Corfield, A. P., Carroll, D., Myerscough, N., Probert, C. S. Mucins in the gastrointestinal tract in health and disease. Front. Biosci. 6, D1321-D1357 (2001).
- Turner, J. R. Intestinal mucosal barrier function in health and disease. Nat. Rev. Immunol. 9, 799-809 (2009).
- Lievin-Le Moal, V., Servin, A. L. The front line of enteric host defense against unwelcome intrusion of harmful microorganisms: mucins, antimicrobial peptides, and microbiota. Clin. Microbiol. Rev. 19, 315-337 (2006).
- Kim, Y. S., Ho, S. B. Intestinal goblet cells and mucins in health and disease: recent insights and progress. Curr. Gastroenterol. Rep. 12, 319-330 (2010).
- Nochi, T., Kiyono, H. Innate immunity in the mucosal immune system. Curr. Pharm. Des. 12, 4203-4213 (2006).
- Vareille, M., Kieninger, E., Edwards, M. R., Regamey, N. The airway epithelium: soldier in the fight against respiratory viruses. Clin. Microbiol. Rev. 24, 210-229 (2011).
- McGuckin, M. A., Linden, S. K., Sutton, P., Florin, T. H. Mucin dynamics and enteric pathogens. Nat. Rev. Microbiol. 9, 265-278 (2011).
- Knowles, M. R., Boucher, R. C. Mucus clearance as a primary innate defense mechanism for mammalian airways. J. Clin. Invest. 109, 571-577 (2002).
- Johansson, M. E. The inner of the two Muc2 mucin-dependent mucus layers in colon is devoid of bacteria. Proc. Natl. Acad. Sci. U.S.A. 105, 15064-15069 (2008).
- Hooper, L. V., Macpherson, A. J. Immune adaptations that maintain homeostasis with the intestinal microbiota. Nat. Rev. Immunol. 10, 159-169 (2010).
- Hayat, M. A. Microscopy, Immunohistochemistry, and Antigen Retrieval Methods: For Light and Electron Microscopy. Hayat, M. A. , Kluwer Academic/Plenum Publishers. New York, NY. 53-70 (2002).
- Cohen, M., Hurtado-Ziola, N., Varki, A. ABO blood group glycans modulate sialic acid recognition on erythrocytes. Blood. 114, 3668-3676 (2009).
- Cohen, M., Varki, A. The sialome--far more than the sum of its parts. OMICS. 14, 455-464 (2010).
- Ota, H., Katsuyama, T. Alternating laminated array of two types of mucin in the human gastric surface mucous later. Histochemical J. 24, 86-92 (1992).
- Matsuo, K., Ota, H., Akamatsu, T., Sugiyama, A., Katsuyama, T. Histochemistry of the surface mucous gel layer of the human colon. Gut. 40, 782-789 (1997).
- Boyde, A., Maconnachie, E. Treatment with lithium salts reduces ethanol dehydration shrinkage of glutaraldehyde fixed tissue. Histochemistry. 66, 181-187 (1980).



