Summary
Незаписанные замороженных образцов тканей, встроенные в оптимальной температуры среды резки (ОКТ) могут быть использованы для изучения распределения природного и гликозилирования выделяется слизь. В этой обработке тканей подход является минимальным и природных презентация гликолипиды, муцина и гликана-эпитопы сохраняется. Срезы тканей могут быть проанализированы с помощью иммуногистохимии с помощью флуоресцентной или хромогенных обнаружения.
Protocol
1. Ткань вложение в октябре
- Подготовка замораживания ванну, добавив сухого льда 2-метил-бутана в неглубокую коробку из пенопласта.
- Урожай ткань и осторожно влажной на папиросной бумаге, чтобы высушить избыток жидкости. При использовании оснастки замороженной ткани (ткань, которая была заморожена в жидком азоте), позволяют ткани нагреться до -20 ° C, поместив его в крио-микротома камеры.
- Добавить небольшое количество октября в Peel-A-Way замораживания формы, достаточно, чтобы покрыть дно формы.
- Поместите ткань в форме, убедитесь, что ткань опиралась на дно формы в нужной ориентации. После заморожены, ткани блок будет секционного либо снизу или с боков.
- Накройте тканью с октября, и поместить форму в морозильной ванны. Соединение октября станет белым, как ткань замерзает.
- После заморожены, очистить плесень с замороженными блок и место в заметное замораживания сумку.
- Замороженные блоки могут быть сохраненыпри -80 ° С до использования.
2. Ткань Секционирование
- Место ткани блоков в крио-микротома камеры, и позволяет им достигать -20 ° C (примерно 30 минут).
- Вырезать 3-5 мкм раздел, и поместить положительно заряженные стекло в верхней части раздела. Ткань будет придерживаться слайд.
- Воздух сухой ткани в течение 30-60 мин.
- Слайды могут быть использованы на данном этапе, или же они могут храниться при -80 ° C для дальнейшего использования.
3. Окрашивание тканей
- Слайды, которые хранились при -80 ° C: позволяет слайды таять и сухой воздух при комнатной температуре в течение 30 мин.
- Исправить слайды с 10% буферном растворе формалина в течение 30 мин при комнатной температуре.
- Вымойте три раза в PBS или TBST буфера, для каждой стирки окунуть слайды в 10 раз по 250 мл буфера. PBS буфера может быть использован для иммунофлуоресцентного окрашивания, однако, для обнаружения хромогенных с щелочной фосфатазы Conjugated антитела, TBST должны быть использованы с фосфатом в PBS ингибирует активность щелочной фосфатазы.
- Срезы тканей слайды теперь готовы быть окрашены.
4. Использование Гистохимические пятен, таких как Alcian синий и периодических Шифф кислота обнаружить слизь
- Alcian синевы:
- Промыть слайдов в воде, инкубировать в 3% уксусной кислоты в течение 3 мин при комнатной температуре.
- Пятно с Alcian синий рН 2,5 раствор в течение 30 мин при комнатной температуре.
- Вымойте слайды в проточной воде в течение 10 мин, промыть в воде DI.
- Контрастирующая в ядерной Fast Red течение 5 мин при комнатной температуре.
- Wash скользит в три раза дистиллированной водой.
- Периодические Шифф кислота пятна:
- Промыть слайдов в воде, инкубировать в свежеприготовленного 1% периодического кислоты в течение 5 мин.
- Вымойте три раза дистиллированной водой, опустите сразу в воду miliQ.
- Пятно с Шифф реагента в течение 15 мин при комнатной температуре.
- Вымойте слайды в проточной воде в течение 10 мин, промыть в воде DI.
- Контрастирующая в Surgipath Hematoxylin в течение 30 сек при комнатной температуре.
- Wash скользит в три раза дистиллированной водой.
- Инкубируйте слайды 30 секунд в водопроводной воде Скотта при комнатной температуре.
- Вымойте три раза дистиллированной водой.
- Высушить и очистить слайдов путем инкубации 1 мин в 95% этаноле, а затем три быстрых изменений в 100% этаноле, и три изменений в Citrisolv, 2 мин каждый. Все при комнатной температуре.
- Установите слайды на покровные со смолистыми среды (Cytoseal 60).
5. Использование лектинов и антител (табл. 1) для обнаружения Glycan Эпитопы по гистохимических методов
- Для флуоресцентной детекции эпитопов из трех гликана использованием лектинов, блокировать слайды с 1% BSA в PBS в течение 10-30 мин при комнатной температуре.
- С биотинилированного лектина используется, блокировать эндогенного биотина путем инкубации 15 мин с 0,1%Авидин, а затем 15 мин инкубации с 0,01% биотина при комнатной температуре.
- Вымойте слайдов в PBS после каждой блокировки шаг.
- Свежий приготовить смесь из 1 мкг / мл родамина-сопряженных сукцинилированный зародышей пшеницы агглютининов (sWGA), 1,3 мкг / мл биотинилированного Бузина черная агглютининов (СНС) и 5 мкг / мл Fluorescein конъюгированных джакалин в HEPES / NaCl буфере (10 мМ HEPES, 150 мМ NaCl, рН 7,5).
- Место слайды на плоской поверхности или в окрашивании поле, а слой лектина смеси на вершине. Смесь объем может быть уменьшен, осторожно размещения парафильмом на жидкость, парафильмом объединяет жидкость и предотвращает испарение.
- Инкубировать 1 час при комнатной температуре в темноте.
- Wash скользит в три раза с PBS.
- Слой слайды с 0,7 мкг / мл стрептавидин-сопряженных Cy5 (для выявления биотинилированного-SNA), и инкубировать в течение 30 мин при комнатной температуре в темноте.
- Wash скользит в три раза с PBS.
- Контрастирующая ядер с 0,1 м иU, г / мл DAPI.
- Установите слайды на покровные водной среде, такой как VectaMount монтаж средств массовой информации (или любой водной среде).
6. Контроль за лектина Специфика Окрашивание
- Лектина специфику окрашивания контролируется либо по конкретным ферментативного расщепления целевой гликана эпитопа перед окрашиванием или конкуренции с малыми молекулами.
- Ферментативное расщепление для Бузина черная агглютининов (СНС) специфичность связывания
- Развести Arthrobacter ureafaciens сиалидазы (AUS) до 250 МЕ / мл в 50 мМ ацетата натрия рН 5,5.
- Добавить воду на дно пустого Tip-Box, это будет являться влажной камере во время инкубации.
- Место слайды лицевой стороной вверх на верхний лоток из Tip-Box, слой 150-200 мкл раствора AUS на слайд и накройте покровным стеклом. Избегайте образования пузырьков воздуха.
- Закройте крышку коробки и инкубировать при 37 ° C в течение 2,5 часов.
- Wash скользит три раза в PBS при комнатной температуреры, чтобы удалить все бесплатно сиаловых кислот. Эти слайды должны быть отрицательными для окрашивания СНС.
- Конкурентные ингибиторы джакалин и сукцинилированный зародышей пшеницы агглютининов (sWGA) специфичность
- Алиготе 200 мкл лектина смеси, приготовленной в шаге 5,4 до двух Eppendorf флаконах.
- Добавить 200 мМ мелибиозы (джакалин ингибитор) в один из флаконов и хитин-гидролизатом при разбавлении 1:10 (sWGA ингибитор) в другой флакон.
- Наложение негативные слайды управления с ингибиторами смесей, содержащих и инкубировать 1 час при комнатной температуре, в то же время, как остальные слайды. Эти слайды должны быть отрицательными для джакалин или sWGA окрашивания, соответственно.
7. Представитель Результаты
Сравнение образцов ткани в парафин замороженных тканей, встроенные в крио-защитного средства массовой информации (ОКТ) выявили поразительную разницу в сохранении и качество окрашивания для muciп гликопротеинов. Ткань окрашивания гистохимических красителей, таких как Alcian синий и периодических Шифф кислота, дают очень разные результаты в сопоставимых срезов тканей из замороженного или парафином образцов (рис. 1). Похоже, что органический растворитель (ксилол или Citrisolv), который используется в процессе вложения парафина влияет на распределение муцина на эпителии секретируемых а также удаление большей части гликолипидов из образцов (рис. 2). В результате, слой слизи появляется рухнул на клетки слизистой оболочки и встречается в основном у бокаловидных клеток. Вспышка замораживания тканей в крио-защитного средства массовой информации (ОКТ) поддерживается образца гидратации и сохранил секретируемых размеры муцинов слоя. Процесс парафин вложения сказывается на других слизи, связанных гликанов и гликолипидов аналогичным образом. Glycan распределению был исследован с помощью лектинов, которые обычно используются для обнаружения гликана (рис. 3) и антитела против эпитопов найти намуцина и гликолипидов (рис. 6). Из-за связывания лектинов не определена и зависит от пространственного распределения гликанов, а также структуры гликанов 14,15, важно, чтобы применить соответствующие меры контроля для лектина окрашивания. Здесь мы показываем два метода для управления лектина пятна на испытания тканей: ферментативного расщепления и конкурентного ингибирования. Расщепление эпитопов гликана было сделано путем переваривания срез ткани с гликана-специфических ферментов, например бактериального сиалидазы, как контроль за сиаловой кислоты связывания SNA (рис. 4). В случаях, когда специфический фермент (например, гликозидазой) не доступен для удаления гликана эпитопа изучены, специфичность лектина может быть подтверждена путем добавления конкурентным ингибитором, таких как мелибиозы для джакалин окрашивание или хитин-гидролизатом для окрашивания sWGA (рис. 5).
Мы демонстрируем здесь, что оснастка замороженных образцов тканей, которые ROUtinely, полученные в клинике и в научно-исследовательских лабораториях, могут быть дополнительно встроены в октябре и использоваться для изучения муцина гликопротеинов и многие гликанов присутствовать на них.
| Лектина / Ab | Источник | Основная специфика |
| LFA | Limax Флава (желтая пуля) | Терминал Sia |
| MAA * | Maackia амурская (Амурская Maackia) | Siaα2-3Galβ1-R / 3-O-сульфата на Galβ1-R |
| SNA | Бузина черная (бузины) | Siaα2-6Gal / Siaα2-6GalNAc |
| WGA | Triticum угри (зародышей пшеницы) | GlcNAcβ1-4GlcNAcβ1-4GlcNAc / Sia |
| sWGA | Сукцинилированный угри Triticum (зародышей пшеницы) | GlcNAc & BОП; 1-4GlcNAcβ1-4GlcNAc |
| PNA | Арахисовое hypogaea (арахис) | Galβ1-3GalNAc (немодифицированного T-антиген) |
| Джакалин | Artocarpus integrifolia, (джакалин) | Galβ1-3GalNAc найти на O-связанных гликанов |
| ECA | Erythrina cristagalli (Coral дерево) | Galβ1-4GlcNAc |
| TKH2 | Антитело | Siaa2-6GalNAc (STN) на O-связанных гликанов |
| CA19-9 | Антитело | Siaa2-3Galβ1-4 (Fuca1-3) GlcNAc (СКВ) |
| SNH3 | Антитело | Siaa2-3Galβ1-3 (Fuca1-4) GlcNAc (СКВ х) |
Сокращения: Ab, антитела, Sia, сиаловой кислоты; Гал, галактоза; GalNAc,
Таблица 1. Неполный список лектинов и антител к эпитопам гликана.
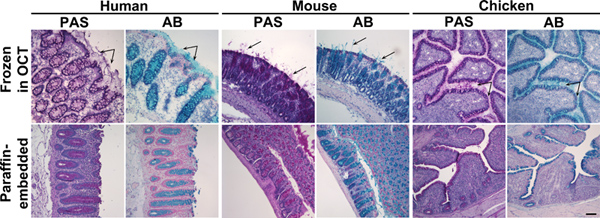
Рисунок 1. Alcian синий и периодического окрашивания Шифф кислота замороженных и парафиновых срезах тканей толстой кишки. Срезы тканей человека, мыши или образцах куриного толстой кишки заморожены в октябре (верхняя панель) или в парафин (нижняя панель) окрашивали с периодическими кислота Schiff (PAS) или Alcian Blue (AB). Эти реагенты пятна слизи, розовый или голубой, соответственно. Верхняя панель: в замороженных тканях, в дополнение к муцина в бокаловидных клеток, слизи, секретируемые также по отношениюible (стрелки). Нижняя панель: в парафин тканей, слизи окрашивания был прикован к бокаловидных клеток. Ядра контрастно Surgipath (PAS) или Майера (AB) Hematoxylin. Масштаб полоса указывает на 100 мкм. Нажмите, чтобы увеличить показатель .

Рисунок 2. Citrisolv инкубации приводит к существенной потере муцинов. Серийные срезы замороженных образцах куриного подвздошной кишки были зафиксированы в 10% буферном растворе формалина и хранится гидратированный (слева), обезвоживали в этаноле последовательной инкубации в 70%, 90% и 100% этанола в течение 20 мин каждый (средняя панель), или обезвоженной в этаноле и согласованы с Citrisolv в течение 1 часа (правая панель). Высушенные образцы регидратации обратно в PBS до гематоксилином и эозином (H & E) или Alcian синего окрашивания. Обезвоживанию этанола и Citrisolv очистки тканей улучшенного морphology (например, верхнего ряда, среднего и правого изображений по сравнению с левым изображением). Этанол обезвоживания не оказали существенного влияния на Alcian синего окрашивания (средний ряд, сравнить левую и среднюю изображений). В отличие от Citrisolv инкубации уменьшено Alcian синего окрашивания и ограничивается его бокаловидных клеток (средний ряд, справа) в шаблон, который был похож на таковой в парафин ткани (рис. 1). Эти данные свидетельствуют о том, что сильное окрашивание слизистой гранул в парафин образцов связано с сокращением и конденсации слизи в бокаловидных клеток во время очистки шаг. Слабее и менее плотной окрашивания слизи в замороженном октября срезах тканей отражает более естественным распределением слизи в тканях. Высшее увеличениях в коробках области отмечены стрелками. Масштаб полоски показывают 50 мкм (верхний и средний ряды) и 10 мкм (нижний ряд).

Рисунок 3. Связываниелектинов в гликана эпитопов на замороженные и парафин тканей. Куриные тонкой кишки (подвздошной кишки) образцов замороженных в октябре (верхняя панель) или в парафин (нижняя панель) были исследованы с джакалин (синий), sWGA (зеленый) и SNA (красный ). Высшее увеличениях в коробках области отмечены стрелками. В замороженных тканей джакалин привязки к O-связанных гликанов показали структуры, которые, казалось, сочилась из бокаловидных клеток в просвет (джакалин, верхняя панель, стрелки). В отличие от джакалин привязки к парафин тканей был прикован к бокаловидных клеток (джакалин, нижняя панель, стрелки) и на границе ворсинки щетки (внизу слева изображение, стрелка). sWGA окрашивания β1-4GlcNAc частично совместно с локализованными связывания лектина джакалин в обоих замороженных тканей (верхняя панель, стрелки), а в парафин тканей (нижняя панель, стрелки). В отличие от СНС лектина привязки к α2-6 связан сиаловых кислот является внутриклеточным (SNA, наконечники стрел), а не ко-локализуются с джакалин (цветИзображение, SNA в красной стрелкой отмечен, джакалин в синий, отмеченные пунктирная стрелка). Масштаб полоски указывают на 100 мкм (слева изображения) и 20 мкм (увеличенный коробках районы).

Рисунок 4. Ферментативный контроль расщепления для окрашивания сиаловой кислоты с СНС. Куриные небольшие образцы кишечника инкубировали с 250 МЕ / мл Arthrobacter ureafaciens сиалидазы (AUS) или 50 мМ ацетата натрия, рН 5,5 буфере в течение 2,5 ч при температуре 37 ° C. AUS лечение отменяет окрашивание с биотинилированным SNA, подтверждающие СНС специфичность связывания с сиаловой кислоты. Масштаб полоса указывает на 100 мкм.

Рисунок 5. Конкурентное управление торможением для гликана окрашивания джакалин и sWGA. Куриные тонкой кишки (подвздошной кишки) образцы инкубировали со смесью джакалин и sWGA в присутствии конкретного лекцииолово ингибиторы: мелибиозы (средняя колонка), хитин-гидролизат (правая колонка) или без ингибитора (А и D). Верхняя панель: (слева) джакалин окрашивание без ингибиторов. (В центре) джакалин окрашивание подавляется мелибиозы. (Справа) хитин-гидролизатом не ингибирует джакалин окрашивания. Нижняя панель: (слева) sWGA окрашивание без ингибитора. (В центре) мелибиозы не ингибирует sWGA окрашивания. (Справа) sWGA окрашивание подавляется хитин-гидролизатом. Это торможение подтверждает специфическое взаимодействие лектинов с тканями. Звездочки знаком образ окрашивания торможения. Масштаб полоса указывает на 100 мкм.

Рисунок 6. Обнаружение секреторных муцин, гликолипиды и гликана эпитопов в замороженных тканях человека колоректального рака. Колоректального рака биопсия ворсинок от рака и рака слизистой были оснастку замороженной в жидком азоте и встроенные в октябре Срезы тканей инкубировали в течение 1 чс антителами против выделяется муцина MUC5AC, сиалил-Льюис - гликана эпитопа найти на ганглиозидов (колоректальный рак маркера СА 19-9), и сиалил-Tn - обильные эпитопа гликана на муцин (обнаружен с TKH2 антитела), а затем 30 мин инкубации с биотинилированного осла анти-мышиных IgG вторичные антитела, и через 30 мин инкубации с пероксидазой сопряженных стрептавидином. Дополнительная тканей инкубировали в течение 1 часа с биотинилированным лектинов СНС и sWGA, а затем 30 мин инкубации с пероксидазой сопряженных стрептавидином. Пероксидазы окрашивания был разработан с использованием AEC комплект. Черные шкалы указывает 200 мкм.
Discussion
Сохранение слизи и гликана эпитопов в замороженных тканях выше, чем в тканях, которые были внедрены в парафин. Мы продемонстрировали сохранение секретируемых слой слизи (рис. 1 и 3) и распределения из трех гликанов структуры (рис. 3) в замороженных тканях по сравнению с парафином тканях. Специализированная фиксаторы, такие, как решение Карнуа (60% этанола, 30% хлороформа, 10% уксусной кислоты) 17 были разработаны для оптимального сохранения слизистого слоя в образцах тканей. Оптимально, это решение должно быть использован для сбора образцов ткани, которые предназначены для исследования слизи и был показан сохранить гладкую появление слизи слоем 16-17. Слой слизи в незаписанных замороженные образцы встроенные в октябре появляется прочная и в некоторых районах может отделяться от тканей, однако общая толщина слоя находится в согласии с этим наблюдается в тканях, которые были зафиксированы с решением Карнуа и embeddред в парафин 16-17. Например, слой слизи в замороженных тканях человека разделе толстой кишки составляет ~ 100 мкм (рис. 1), которая находится в пределах сообщалось Carnoy's фиксированной человека образца толстой кишки 55,4 ± 2,5 мкм (в диапазоне 7,7 - 204,8 мкм) 16.
Она была известна на протяжении десятилетий, что этанол приводит к обезвоживанию ~ 30% сокращение биологических образцов 18, и что органические растворители, такие как ксилол, хлороформ и Citrisolv экстракт липидов, гликолипидов и, в некоторой степени, белков из тканей 13. Ткань для обработки парафин вложения включает в себя следующие действия: фиксация (10% буферном растворе формалина), обезвоживание (увеличение концентрации этанола) и очистки (Citrisolv или ксилол). По имитируя эти действия на нефиксированные замороженных срезов ткани, мы показали, что Citrisolv извлекает слизи из замороженных срезов ткани в результате чего ткани морфологии, который похож на парафин тканей (FigurE 2, справа). В отличие от слизистого слоя не была изменена путем инкубации с формалином или этанола (рис. 2, слева и в центре панели). Это говорит о том, что на поляне шаг стандартная процедура вложения парафин, который требует длительной инкубации в Citrisolv / ксилол, приводит к краху слой слизи. Формалин фиксации не повредить слой слизи и замороженных срезов тканей, которые были зафиксированы с формалином может быть легко окрашивается с лектинов и антител против гликанов, гликолипиды и белки (рис. 2, 3 и 6). Эти эффекты могут быть незначительными для изучения мембран-связанных белков и тканей патологии, но они являются разрушительными для высоко гидратированных структур, таких как выделяемый слой слизи. Однако гистологические исследования муцина по-прежнему осуществляются преимущественно с парафином образцов, в которых сохранение слой слизи является оптимальным решением. В углубленный анализ слой слизи композиции, такие как точная идентичность себеcreted или мембраносвязанных MUC комбинации гликопротеин требуют специфических антител и масс-спектрометрии для идентификации белков магистралей. Сохранение слой слизи является лишь начальным требованиям для таких исследований.
Многие лаборатории образцы тканей замораживали в октябре, что было собрано в прошлом для различных проектов, эти ткани могут быть легко использованы для изучения муцин, гликолипиды и гликана распределения избавляя пользователя от необходимости собирать тканей в специальных фиксаторов, которые предназначены исключительно для сохранения слизи. Замороженные ткани подвергаются минимальной обработке, и поэтому естественное распределение гликанов, которые являются гидратированные в природе, сохраняется. Это особенно важно в области микробных-хозяин взаимодействий. Знание натуралистического распределение и численность муцинов секретируемых и многие структуры гликанов украшении этих "барьеров" молекул будет ключевым в понимании иммунной защиты, микробные эксплуатации и возбудителиесть.
Disclosures
Нет конфликта интересов объявлены.
Acknowledgments
Авторы хотели бы поблагодарить Николь М. Немет (Университет штата Джорджия) и Жанна М. Fair (LANL) за помощь в уборке куриные тканей, и Steven A. Springer за его помощь во время съемок. Обо всех птиц в этом исследовании был в соответствии с Национальными Институтами Здоровья руководящие принципы для гуманного использования лабораторных животных, а все протоколы были одобрены Институциональные уходу и использованию животных комитета в Лос-Аламосской национальной безопасности, LLC, оператор в Лос-Аламосе Национальная лаборатория по контракту № DE-AC52-06NA25396 с министерством энергетики США. Уход за мышами в данном исследовании, в соответствии с UCSD животных утвержденным протоколом. Ткани человека были получены в рамках UCSD протокол IRB утвержден. Эта работа была поддержана грантом 118645 из Университета Калифорнии Лаборатории стоимость программы Президента (PG) и гранта NS047101 из Национального института неврологических расстройств и инсульта (Neuroscience микроскопии общего фонда, UC San Diego).
Materials
| Name | Company | Catalog Number | Comments |
| 2-methyl butane | Fisher Scientific | 03551-4 | |
| AEC peroxidase substrate kit | Vector Labs | SK-4200 | |
| Alcian Blue | Sigma-Aldrich | A3157 | |
| Anti-CA 19-9 monoclonal antibody | Calbiochem | CA1003 | |
| Anti-MUC5AC monoclonal antibody | Millipore | MAB2011 | |
| Avidin-Biotin blocking kit | Vector Labs | SP-2001 | |
| Biotinylated donkey anti-mouse antibody | Jackson Immunoresearch | 90863 | |
| Biotinylated SNA | Vector Labs | B-1305 | |
| Bovine serum albumin | Sigma-Aldrich | A4503 | |
| Chitin-hydrolysate | Vector Labs | SP-0090 | |
| Cryostat microtome | Leica Microsystems | Leica CM 1800 | |
| Hematoxylin | Surgipath Medical Ind. | 3801570 | |
| Hydrogen peroxide 30% | Fisher Scientific | H325-100 | |
| Jacalin-FITC | Vector Labs | FL-1151 | |
| Mayer's Hematoxylin | Sigma-Aldrich | MHS32 | |
| Melibiose | Sigma-Aldrich | M5500 | |
| Nuclear Fast Red | Vector Labs | H-3403 | |
| OCT compound | VWR International | 25608-930 | |
| Peroxidase conjugated streptavidin | Jackson Immunoresearch | 94638 | |
| Schiff reagent | Electron microscopy sciences | 26052 | |
| sWGA-Rhodamine | Vector Labs | RL1022S | |
| TKH2 monoclonal antibody | ATCC | HB-9654 | |
| VectaMount aqueous mounting media | Vector Labs | H-5501 | |
| Cytoseal 60 | Thermo Scientific | 8310-4 | |
| Peel-A Way molds | Polysciences Inc. | 18646A-1 |
References
- Slayter, H. S., Wold, J. K., Midtvedt, T. Intestinal mucin of germ-free rats. Biochemical and electron-microscopic characterization. Carbohydr. Res. 222, 1-9 (1991).
- Lamblin, G. The carbohydrate diversity of human respiratory mucins: a protection of the underlying mucosa. Am. Rev. Respir. Dis. 144, S19-S24 (1991).
- Corfield, A. P., Carroll, D., Myerscough, N., Probert, C. S. Mucins in the gastrointestinal tract in health and disease. Front. Biosci. 6, D1321-D1357 (2001).
- Turner, J. R. Intestinal mucosal barrier function in health and disease. Nat. Rev. Immunol. 9, 799-809 (2009).
- Lievin-Le Moal, V., Servin, A. L. The front line of enteric host defense against unwelcome intrusion of harmful microorganisms: mucins, antimicrobial peptides, and microbiota. Clin. Microbiol. Rev. 19, 315-337 (2006).
- Kim, Y. S., Ho, S. B. Intestinal goblet cells and mucins in health and disease: recent insights and progress. Curr. Gastroenterol. Rep. 12, 319-330 (2010).
- Nochi, T., Kiyono, H. Innate immunity in the mucosal immune system. Curr. Pharm. Des. 12, 4203-4213 (2006).
- Vareille, M., Kieninger, E., Edwards, M. R., Regamey, N. The airway epithelium: soldier in the fight against respiratory viruses. Clin. Microbiol. Rev. 24, 210-229 (2011).
- McGuckin, M. A., Linden, S. K., Sutton, P., Florin, T. H. Mucin dynamics and enteric pathogens. Nat. Rev. Microbiol. 9, 265-278 (2011).
- Knowles, M. R., Boucher, R. C. Mucus clearance as a primary innate defense mechanism for mammalian airways. J. Clin. Invest. 109, 571-577 (2002).
- Johansson, M. E. The inner of the two Muc2 mucin-dependent mucus layers in colon is devoid of bacteria. Proc. Natl. Acad. Sci. U.S.A. 105, 15064-15069 (2008).
- Hooper, L. V., Macpherson, A. J. Immune adaptations that maintain homeostasis with the intestinal microbiota. Nat. Rev. Immunol. 10, 159-169 (2010).
- Hayat, M. A. Microscopy, Immunohistochemistry, and Antigen Retrieval Methods: For Light and Electron Microscopy. Hayat, M. A. , Kluwer Academic/Plenum Publishers. New York, NY. 53-70 (2002).
- Cohen, M., Hurtado-Ziola, N., Varki, A. ABO blood group glycans modulate sialic acid recognition on erythrocytes. Blood. 114, 3668-3676 (2009).
- Cohen, M., Varki, A. The sialome--far more than the sum of its parts. OMICS. 14, 455-464 (2010).
- Ota, H., Katsuyama, T. Alternating laminated array of two types of mucin in the human gastric surface mucous later. Histochemical J. 24, 86-92 (1992).
- Matsuo, K., Ota, H., Akamatsu, T., Sugiyama, A., Katsuyama, T. Histochemistry of the surface mucous gel layer of the human colon. Gut. 40, 782-789 (1997).
- Boyde, A., Maconnachie, E. Treatment with lithium salts reduces ethanol dehydration shrinkage of glutaraldehyde fixed tissue. Histochemistry. 66, 181-187 (1980).



