Summary
Non fixées échantillons de tissus congelés incorporés dans un milieu de température optimale de coupe (OCT) peut être utilisé pour étudier la distribution de glycosylation naturelle et du mucus sécrété. Dans cette approche de traitement de tissus est minime et la présentation naturelle des glycolipides, des mucines et glycane-épitopes est préservée. Les coupes de tissus peuvent être analysées par immunohistochimie en utilisant la détection par fluorescence ou chromogène.
Abstract
Mucines sont complexes et fortement glycosylée O-liés glycoprotéines, qui contiennent plus de 70% en poids de glucides 1-3. Mucines sécrétées, produite par les cellules caliciformes et de la muqueuse gastrique, l'échafaud pour fournir une couche de mucus micromètres d'épaisseur qui tapisse l'épithélium de l'intestin et des voies respiratoires 3,4. En plus des mucines, les couches de mucus également contenir des peptides antimicrobiens, des cytokines, des immunoglobulines et 5-9. La couche de mucus est une partie importante de l'immunité innée de l'hôte, et constitue la première ligne de défense contre les micro-organismes envahisseurs 8,10-12. En tant que tel, le mucus est soumis à de nombreuses interactions avec les microbes, les deux agents pathogènes et de symbiotes, et les mucines sécrétées former une interface importante pour ces interactions. L'étude de ces interactions biologiques implique généralement des méthodes histologiques pour la collecte des tissus et de la coloration. Les deux méthodes les plus couramment utilisés pour la collecte des tissus histologiques et préservanttion dans la clinique et dans les laboratoires de recherche sont: la fixation au formol suivie par inclusion dans la paraffine et la congélation des tissus, puis en intégrant en cryo-protecteurs médias.
Échantillons de tissus inclus en paraffine produire des sections avec des qualités optimales pour la visualisation histologique, y compris la clarté et la morphologie bien définie. Cependant, au cours du processus de paraffine intégration d'un certain nombre d'épitopes s'altérer et dans le but d'étudier ces épitopes, des coupes de tissus doivent être traitées ultérieurement de l'une des nombreuses méthodes de démasquage 13. Mucines sécrétées et les lipides sont extraits à partir du tissu au cours de l'étape de compensation de la paraffine enrobage, ce qui nécessite de prolonger l'incubation avec des solvants organiques (xylène ou Citrisolv). Par conséquent, cette approche est sous-optimal pour les études portant sur la nature et la répartition des mucines et de mucus in vivo.
En revanche, le gel des tissus à la température de coupe optimale (PTOM) intégrant un supportvides déshydratation et la compensation de l'échantillon, et maintient l'hydratation de l'échantillon. Cela permet une meilleure préservation de la couche de mucus hydraté, et permet ainsi l'étude des nombreux rôles de mucines en biologie épithéliale. Comme cette méthode nécessite un minimum de traitement du tissu, le tissu est conservé dans un état plus naturel. Par conséquent gelés sections tissus ne nécessitent aucun traitement supplémentaire avant la coloration et peut être facilement analysée par des méthodes immunohistochimiques.
Nous démontrons la préservation de micromètres d'épaisseur couche de mucus sécrété dans les échantillons congelés du côlon. Cette couche est considérablement réduite lorsque les mêmes tissus sont inclus dans la paraffine. Nous démontrons également immunofluorescence des épitopes présentés sur des glycanes des mucines en utilisant des lectines végétales. L'avantage de cette approche est qu'elle ne nécessite pas l'utilisation de fixateurs spéciaux et permet à partir de tissus congelés qui peuvent déjà être conservés dans le laboratoire.
Protocol
1. Enrobage des tissus dans de l'OCT
- Préparer un bain de gel en ajoutant de la neige carbonique en 2-méthyl butane dans une zone peu profonde en polystyrène.
- Récolter le tissu, et lentement humide sur un papier tissu à sécher le liquide en excès. Si vous utilisez composant logiciel enfichable congelés tissu (tissu qui a été congelé dans l'azote liquide), laisser le tissu se réchauffer à -20 ° C en le plaçant dans une chambre cryo-microtome.
- Ajouter une petite quantité de l'OCT dans le moule Peel-A-Way congélation, juste assez pour couvrir le fond du moule.
- Placer le tissu dans le moule, s'assurer que le tissu est posé sur le fond du moule à l'orientation souhaitée. Une fois congelé, le bloc de coupe de tissu est supporte par le dessous ou par les côtés.
- Couvrir le tissu avec octobre, et placer le moule dans le bain de congélation. Le composé OCT devient blanc que le tissu se fige.
- Une fois congelés, peler le moule hors du bloc congelé et placer dans un sac de congélation marquée.
- Les blocs congelés peuvent être conservésà -80 ° C jusqu'à utilisation.
2. Sectionnement des tissus
- Placez les blocs de tissus dans la chambre cryo-microtome, et leur permettent d'atteindre -20 ° C (30 min environ).
- Coupez une section de 5.3 microns d'épaisseur, et placez une lame de verre chargée positivement au-dessus de la section. Le tissu adhère à la lame.
- Air sécher les tissus pendant 30-60 min.
- Les diapositives peuvent être utilisées à ce stade, ou ils peuvent être conservés à -80 ° C pour une utilisation ultérieure.
3. Coupes
- Les diapositives qui ont été stockés à -80 ° C: laisser les lames de dégeler et de l'air sec à température ambiante pendant 30 min.
- Fixer les lames avec 10% du formol tamponné pendant 30 min à température ambiante.
- Laver trois fois dans du PBS ou tampon TBST, pour chaque lavage tremper les lames 10 fois dans 250 ml de tampon. Tampon PBS peut être utilisé pour le marquage en immunofluorescence, cependant, pour la détection chromogénique avec la phosphatase alcaline ConjugATED anticorps, TBST doit être utilisé depuis le phosphate dans du PBS inhibe l'activité de la phosphatase alcaline.
- Coupes de tissus transparents sont maintenant prêts à être colorés.
4. Utilisation colorations histochimiques comme le Bleu Alcian et Schiff acide périodique pour détecter mucus
- Bleu Alcian tache:
- Rincer les lames dans de l'eau, incuber dans de l'acide acétique à 3% pendant 3 min à température ambiante.
- Colorer avec Alcian Blue 2.5 pH solution pendant 30 min à température ambiante.
- Laver les lames à l'eau courante pendant 10 minutes, rincer à l'eau déminéralisée.
- Contre-colorer en rouge rapide nucléaire pendant 5 min à température ambiante.
- Laver les lames trois fois dans de l'eau déminéralisée.
- Periodic Acid Schiff tache:
- Rincer les lames dans de l'eau, incuber dans fraîchement préparée d'acide périodique 1% pendant 5 min.
- Laver trois fois dans de l'eau DI, tremper dans l'eau une fois miliQ.
- Colorer avec le réactif de Schiff pendant 15 min à températur ambiantee.
- Laver les lames à l'eau courante pendant 10 minutes, rincer à l'eau déminéralisée.
- Contre-colorer en Surgipath hématoxyline pendant 30 sec à température ambiante.
- Laver les lames trois fois dans de l'eau déminéralisée.
- Incuber les lames 30 secondes dans de l'eau du robinet de Scott à la température ambiante.
- Laver trois fois dans de l'eau déminéralisée.
- Déshydrater et nettoyer les lames en les incubant 1 min dans de l'éthanol à 95%, suivie de trois changements rapides dans l'éthanol à 100%, et trois changements de Citrisolv, 2 min chacun. Le tout à température ambiante.
- Montez diapositives sur des lamelles avec le milieu résineux (Cytoseal 60).
5. Utilisation lectines et anticorps (Tableau 1) pour détecter des épitopes Glycan par des méthodes histochimiques
- Pour la détection par fluorescence d'épitopes glycanes trois en utilisant des lectines, bloquer les lames avec 1% de BSA dans du PBS pendant 10-30 min à température ambiante.
- Depuis une lectine biotinylée est utilisée, empêcher la biotine endogène par incubation de 15 min avec 0,1%L'avidine, suivi par 15 minutes d'incubation avec de la biotine 0,01% à température ambiante.
- Laver les lames dans du PBS après chaque étape de blocage.
- Fraîchement préparer un mélange de 1 ug / ml de rhodamine conjuguée succinylée agglutinine de germe de blé (sWGA), 1,3 ug / ml biotinylé Sambucus nigra agglutinine (SNA) et 5 ug / ml conjuguée à la fluorescéine jacaline dans HEPES / NaCl (10 mM HEPES, NaCl 150 mM pH 7,5).
- Placer les lames sur une surface plane ou dans une boîte de coloration, et la couche du mélange sur le dessus lectine. Le volume de mélange peut être réduite en plaçant doucement parafilm sur le liquide, le parafilm aplatit le liquide et empêche l'évaporation.
- Incuber 1 heure à température ambiante dans l'obscurité.
- Laver les lames trois fois avec du PBS.
- Glissements de couches avec 0,7 pg / ml de streptavidine conjuguée CY5 (pour détecter la biotinylé-SNA), et incuber pendant 30 min à température ambiante dans l'obscurité.
- Laver les lames trois fois avec du PBS.
- Contre-noyaux avec 0,1 m &u, g / ml DAPI.
- Montez diapositives sur des lamelles avec un milieu aqueux comme milieu de montage VectaMount (ou tout autre support aqueux).
6. Contrôle de la spécificité de coloration Lectine
- Spécificité de coloration lectine est commandé soit par un clivage enzymatique spécifique d'épitope cible glycane avant la coloration ou par compétition avec des molécules de petite taille.
- Le clivage enzymatique de Sambucus nigra agglutinine (SCN) une spécificité de liaison
- Diluer Arthrobacter ureafaciens sialidase (AUS) à 250 mU / ml dans 50 mM d'acétate de sodium pH 5,5.
- Ajouter de l'eau au fond d'un vide Tip-Box, cela formera une chambre humide pendant l'incubation.
- Placer les lames face visible sur le plateau supérieur de la pointe-boîte, couche 150-200 AUS ul de solution sur la lame et recouvrir d'une lamelle. Eviter la formation de bulles d'air.
- Fermez le couvercle de la boîte et incuber à 37 ° C pendant 2,5 heures.
- Laver les lames trois fois dans du PBS à tempérament chambrerature pour enlever tous les acides sialiques libres. Ces lames doivent être négatifs pour la coloration du SCN.
- Inhibiteurs compétitifs pour jacaline et succinylée germe de blé agglutinine (sWGA) spécificité
- Aliquote de 200 ul du mélange de lectine préparée à l'étape 5.4 à deux flacons Eppendorf.
- Ajouter 200 mM (inhibiteur de jacaline) Melibiose l'une quelconque des flacons et l'hydrolysat de chitine-dilution 1:10 (sWGA inhibiteur) à l'autre flacon.
- Diapositives de superposition de contrôle négatif avec les inhibiteurs contenant du mélange et incuber 1 h à température ambiante, en même temps que le reste des diapositives. Ces lames doivent être négatif pour jacaline ou coloration sWGA, respectivement.
7. Les résultats représentatifs
Une comparaison entre des échantillons de tissus inclus dans la paraffine pour les tissus congelés embarqués en cryo-protecteurs médias (OCT) a révélé différence frappante dans la préservation et la qualité de la coloration pour muciglycoprotéines n. La coloration des tissus avec des colorants histochimiques, tels que le Bleu Alcian et acide périodique Schiff, produire des résultats très différents dans des coupes de tissus congelés ou comparables de paraffine échantillons embarqués (Figure 1). Il semble que le solvant organique (xylène ou Citrisolv) qui est utilisé pendant le processus de l'inclusion en paraffine affecte la distribution des mucines sécrétées sur l'épithélium ainsi que la suppression de beaucoup les glycolipides à partir des échantillons (figure 2). En conséquence, la couche de mucus semble effondré sur les cellules de la muqueuse et se trouve surtout dans les cellules caliciformes. Congélation instantanée des tissus en cryo-protecteurs des médias (OCT) a maintenu l'hydratation de l'échantillon et conservé les dimensions sécrétées couche mucines. Le procédé d'enrobage de paraffine affectée autres mucus-glycanes et des glycolipides associés d'une manière similaire. La distribution Glycan été examinée en utilisant des lectines, qui sont couramment utilisés pour la détection de glycane (figure 3) et des anticorps contre des épitopes présents surmucines et des glycolipides (figure 6). Parce lectine n'est pas bien définie et est affectée par la répartition spatiale des glycanes ainsi que la structure glycane 14,15, il est important d'appliquer les contrôles appropriés pour la coloration de lectine. Ici, nous démontrons deux méthodes pour contrôler coloration lectine sur les tissus testés: clivage enzymatique et inhibition compétitive. Clivage des épitopes glycaniques a été fait par digestion avec la section de tissu glycane enzymes spécifiques, par exemple bactérienne telle que la sialidase contrôle de liaison d'acide sialique par SNA (figure 4). Dans les cas où une enzyme spécifique (par exemple glycosidase) n'est pas disponible pour enlever l'épitope glycane étudiés, la spécificité lectine peut être confirmé par l'ajout d'un inhibiteur compétitif tel que Melibiose pour la coloration jacaline ou chitine-hydrolysat pour la coloration sWGA (figure 5).
Nous démontrons ici que des échantillons de tissus congelés composant logiciel enfichable, qui sont routinely obtenu dans la clinique et dans les laboratoires de recherche, peut encore être incorporé dans un PTOM, et utilisées pour étudier glycoprotéines mucines et les glycanes de nombreux présents sur eux.
| Lectine / Ab | Source | Spécificité majeure |
| LFA | Limax flavus (limace jaune) | Terminal Sia |
| * MAA | Maackia amurensis (Amour Maackia) | Siaα2-3Galβ1-R / 3-O-sulfate sur Galβ1-R |
| SNA | Sambucus nigra (Sureau) | Siaα2-6Gal / Siaα2-6GalNAc |
| WGA | Triticum vulgaris (germe de blé) | GlcNAcβ1-4GlcNAcβ1-4GlcNAc / Sia |
| sWGA | Triticum vulgaris succinylée (germe de blé) | GlcNAc & beta; 1-4GlcNAcβ1-4GlcNAc |
| PNA | Arachis hypogaea (arachide) | Galβ1-3GalNAc (non modifiée antigène T) |
| Jacaline | Artocarpus integrifolia (jacaline) | Galβ1-3GalNAc trouve sur O-glycanes |
| CEA | Erythrina cristagalli (arbre corail) | Galβ1-4GlcNAc |
| TKH2 | Anticorps | Siaa2-6GalNAc (STN) sur O-glycanes |
| CA19-9 | Anticorps | Siaa2-3Galβ1-4 (Fuca1-3) GlcNAc (SLE a) |
| SNH3 | Anticorps | Siaa2-3Galβ1-3 (Fuca1-4) GlcNAc (SLe x) |
Abréviations: Ab, anticorps; Sia, de l'acide sialique; Gal, Galactose; GalNAc,
Tableau 1. Voici une liste partielle des lectines et anticorps pour épitopes glycanes.
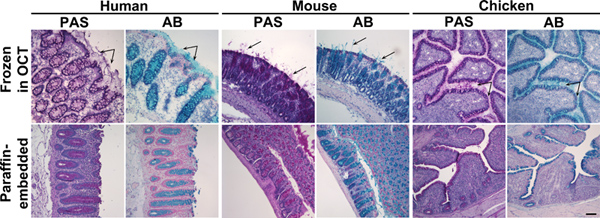
Figure 1. Bleu Alcian et périodique Schiff coloration acide des tissus du côlon congelées et inclus en paraffine. Coupes de tissus d'origine humaine, souris ou du côlon spécimens de poulet congelés dans l'OCT (panneau supérieur) ou inclus en paraffine (panneau inférieur) ont été colorées avec de l'acide périodique Schiff (PAS) ou Bleu Alcian (AB). Ces réactifs tache mucus rose ou bleu, respectivement. Panneau supérieur: Dans les tissus congelés, en plus de mucines dans les cellules caliciformes, le mucus sécrété était aussi visible (flèches). Panneau inférieur: Dans les tissus inclus en paraffine, coloration du mucus a été confinée aux cellules caliciformes. Les noyaux ont été contre-colorées avec Surgipath (PAS) ou Mayer (AB) hématoxyline. La barre d'échelle indique 100 um. Cliquez ici pour agrandir la figure .

Figure 2. Résultats d'incubation Citrisolv une perte importante de mucines. Sections en série de spécimens congelés de poulet iléon ont été fixés dans du formol tamponné à 10% et maintenu hydraté (panneau de gauche), déshydratées dans de l'éthanol par incubation séquentielle de 70%, 90% et 100% d'éthanol pendant 20 min chacune (graphique du milieu), ou déshydratés dans l'éthanol et effacé avec Citrisolv pendant 1 heure (panneau de droite). Échantillons déshydratés ont été réhydratés retour à la PBS avant d'hématoxyline et l'éosine (H & E) ou coloration au bleu alcian. Déshydratation de l'éthanol et Citrisolv élimination de tissu amélioration morlogie (par exemple, rangée du haut, les images milieu et de droite par rapport à l'image à gauche). Déshydratation de l'éthanol n'a eu aucun effet significatif sur la coloration bleu Alcian (rangée du milieu, comparer les images gauche et du milieu). En revanche, l'incubation Citrisolv réduit la coloration au bleu Alcian et confinée à des cellules caliciformes (rangée du milieu, l'image de droite) dans un modèle qui a été similaire à celle observée dans les tissus inclus en paraffine (Figure 1). Ces données impliquent que la forte coloration des granules de mucus dans les échantillons inclus en paraffine est due à la contraction et la condensation de mucus dans les cellules caliciformes lors de l'étape de compensation. La coloration plus pâle et moins dense de mucus dans surgelés OCT-embarqués tissus reflète une répartition plus naturelle du mucus dans le tissu. Forts grossissements de zones encadrées sont marqués par des flèches. Barres d'échelle indiquent 50 pm (lignes du haut et du milieu) et 10 um (rangée du bas).

Figure 3. Reliure d'lectines à épitopes glycanes sur des tissus congelés et inclus en paraffine. poulet intestin grêle (iléon) Les échantillons congelés dans l'OCT (panneaux supérieurs) ou inclus en paraffine (panneaux inférieurs) ont été sondés avec jacaline (bleu), sWGA (vert) et SNA (rouge ). Forts grossissements de zones encadrées sont marqués par des flèches. Dans les tissus congelés liaison à O-glycanes jacaline révélé des structures qui semblaient suinter de cellules caliciformes dans la lumière (jacaline, panneau supérieur, flèches). En revanche, les contraignant à paraffine tissus jacaline a été confinée aux cellules caliciformes (jacaline, panneau inférieur, flèches) et de la bordure en brosse des villosités (bas de l'image de gauche, flèche). coloration sWGA de β1-4GlcNAc partiellement co-localisée avec la liaison de la lectine jacaline dans les deux tissus congelés (panneau supérieur, flèches), et dans les tissus inclus en paraffine (en bas, flèches). En revanche, la lectine SNA liaison à α2-6 acides sialiques liés est intracellulaire (SCN, pointes de flèches), et n'est pas co-localisés avec jacaline (couleurimage, SNA en rouge marqué avec une flèche, jacaline en bleu marqué avec une flèche en pointillés). Barres d'échelle indiquent 100 um (images de gauche) et 20 um (agrandies zones encadrées).

Figure 4. Contrôle de clivage enzymatique pour la coloration acide sialique avec le SCN. Échantillons de poulet intestin grêle ont été incubées avec 250 mU / ml Arthrobacter ureafaciens sialidase (AUS) ou avec 50 mM d'acétate de sodium pH 5,5 tampon pendant 2,5 h à 37 ° C. AUS traitement abolit coloration avec biotinylé SNA, ce qui confirme la spécificité de liaison SNA aux acides sialiques. La barre d'échelle indique 100 um.

Figure 5. Contrôle de l'inhibition compétitive pour la coloration glycane avec jacaline et sWGA. Poulet intestin grêle (iléon) échantillons ont été incubés avec un mélange jacaline et sWGA en présence de lec spécifiqueinhibiteurs de l'étain: mélibiose (colonne du milieu), chitine-hydrolysat (colonne de droite) ou sans inhibiteur (A et D). Panneau supérieur: (à gauche) jacaline coloration sans inhibiteurs. (Au centre) jacaline coloration a été inhibée par Melibiose. (À droite) Le chitine hydrolysat n'a pas inhibé la coloration jacaline. Panneau inférieur: (à gauche) sWGA coloration sans inhibiteur. (Au centre) Melibiose n'a pas inhibé la coloration sWGA. (À droite) sWGA coloration a été inhibée par chitine-hydrolysat. Cette inhibition confirme l'interaction spécifique des lectines avec les tissus. Les astérisques marque l'image de l'inhibition de la coloration. La barre d'échelle indique 100 um.

Figure 6. Détection des mucines sécrétoires, des glycolipides et des épitopes glycanes dans les tissus humains congelés cancer colorectal. Biopsies de cancer colorectal cancer villeux et le carcinome muqueux étaient composant logiciel enfichable congelés dans de l'azote liquide et intégré dans octobre Les coupes de tissus ont été incubés pendant 1 havec des anticorps contre la mucine sécrétée MUC5AC, un sialyl-Lewis - glycane épitope trouvé sur les gangliosides (cancer colorectal marqueur CA 19-9), et sialyl-Tn - abondante épitope glycannique sur mucines (détecté avec l'anticorps TKH2), suivie de 30 minutes d'incubation avec biotinylé d'âne anti-souris IgG anticorps secondaire, et 30 minutes d'incubation avec la streptavidine conjuguée à la peroxydase. D'autres tissus ont été incubés pendant 1 heure avec le SNA biotinylée lectines et sWGA, suivie de 30 minutes d'incubation avec la streptavidine conjuguée à la peroxydase. Marquage par la peroxydase a été développé en utilisant l'AEC kit. Barre d'échelle noire indique 200 um.
Discussion
Conservation des épitopes de mucus et de tissus congelés glycane est supérieure à celle des tissus qui ont été incorporées dans de la paraffine. Nous avons démontré la préservation de la couche de mucus sécrété (figures 1 et 3) et de la répartition des structures des glycanes trois (figure 3) dans les tissus congelés par rapport à des tissus inclus en paraffine. Fixateurs spécialisés, comme solution de Carnoy (éthanol à 60%, le chloroforme 30%, 10% d'acide acétique) 17 ont été développés pour une conservation optimale de la couche de mucus dans les échantillons de tissus. De façon optimale, cette solution devrait être utilisé pour recueillir des échantillons de tissus qui se consacrent à des études de mucus et a été montré pour préserver l'aspect lisse de 16-17 couche de mucus. La couche de mucus dans les échantillons congelés non fixées intégré dans un PTOM, semble robuste et dans certaines régions peut se détacher du tissu, mais l'épaisseur de la couche globale est en accord avec celle observée dans les tissus qui ont été fixées avec une solution de Carnoy et embedded dans de la paraffine 16-17. Par exemple, la couche de mucus dans la section du côlon congelé les tissus humains est de ~ 100 um (Figure 1), ce qui est à l'intérieur de la fourchette indiquée pour Carnoy's fixe échantillon côlon humain 55,4 ± 2,5 microns (plage de 7,7 à 204,8 um) 16.
Il a été connu depuis des décennies que les résultats de la déshydratation d'éthanol ~ retrait de 30% des échantillons biologiques 18, et que des solvants organiques tels que le xylène, Citrisolv et des lipides, des glycolipides extrait de chloroforme et, dans une certaine mesure, les protéines provenant des 13 tissus. Le traitement des tissus pour inclusion dans la paraffine comprend les étapes suivantes: fixation (10% du formol tamponné), déshydratation (concentration en éthanol augmente) et de compensation (Citrisolv ou le xylène). En reproduisant les étapes de coupes de tissus congelés non fixées, nous avons montré que des extraits de mucus Citrisolv de coupes de tissus congelés résultant de la morphologie du tissu qui est similaire à celle de tissus inclus dans la paraffine (Figure 2, panneau de droite). En revanche, la couche de mucus n'a pas été modifiée par une incubation avec du formol ou de l'éthanol (Figure 2, gauche et du milieu). Ceci suggère que l'étape de compensation de la procédure de paraffine plongement standard, ce qui nécessite une incubation prolongée dans Citrisolv / xylène, entraîne l'effondrement de la couche de mucus. La fixation au formol ne pas endommager la couche de mucus et surgelés sections de tissus qui ont été fixés à la formaline peut être facilement colorés avec les lectines et les anticorps dirigés contre les glycanes, des glycolipides et des protéines (figures 2, 3 et 6). Ces effets peuvent être négligeables pour l'étude des protéines membranaires et des tissus pathologie, mais ils sont dévastateurs pour les structures fortement hydratées telles que la couche de mucus sécrété. Des études histologiques Cependant de mucines sont encore menées principalement avec des échantillons inclus en paraffine, dont la préservation couche de mucus est sous-optimale. Dans des analyses approfondies de composition de la couche de mucus telles que l'identité précise de soicreted ou glycoprotéine liée à la membrane combinaisons MUC exiger des anticorps spécifiques et la spectrométrie de masse pour l'identification de l'épine dorsale de protéine. Préservation de la couche de mucus n'est que la première exigence pour de telles études.
De nombreux laboratoires ont des échantillons de tissus congelés dans l'OCT qui ont été recueillies dans le passé pour des projets différents, ces tissus peuvent être facilement utilisées pour étudier les mucines, des glycolipides et de distribution glycane éliminant la nécessité de recueillir des tissus dans fixateurs spéciaux qui sont conçus uniquement pour la préservation du mucus. Tissus congelés subir une transformation minimale et par conséquent la répartition naturelle des glycanes, qui sont hydratés dans la nature, est conservée. Ceci est particulièrement important dans le domaine des interactions hôte-microbienne. Connaissance de la répartition et de l'abondance naturaliste de mucines sécrétées et les structures des glycanes de nombreux décorer ces molécules "barrière" sera un élément clé dans la compréhension de défense de l'hôte, de l'exploitation et de pathogènes microbiensest.
Disclosures
Aucun conflit d'intérêt déclaré.
Acknowledgments
Les auteurs tiennent à remercier Nicole M. Nemeth (Université de Géorgie) et Jeanne M. Fair (LANL) pour leur aide dans la récolte des tissus de poulet et Steven A. Springer pour son aide pendant le tournage. La prise en charge de tous les oiseaux de cette étude était en conformité avec les lignes directrices des National Institutes of Health pour l'utilisation des animaux de laboratoire et tous les protocoles ont été approuvés par le soin des animaux institutionnel et comités utilisation à Los Alamos National Security, LLC, opérateur du Los Alamos Laboratoire national au titre du contrat n ° DE-AC52-06NA25396 avec le Département américain de l'Énergie. La prise en charge de la souris dans cette étude est en conformité avec l'UCSD animale protocole approuvé. Tissus humains ont été obtenus dans le cadre du protocole de l'UCSD CISR approuvé. Ce travail a été soutenu par une bourse de 118.645 Université de Californie frais Lab Programme Président (PG) et la subvention NS047101 de l'Institut national des troubles neurologiques et des maladies (laboratoire de microscopie Neuroscience partagée, UC San Diego).
Materials
| Name | Company | Catalog Number | Comments |
| 2-methyl butane | Fisher Scientific | 03551-4 | |
| AEC peroxidase substrate kit | Vector Labs | SK-4200 | |
| Alcian Blue | Sigma-Aldrich | A3157 | |
| Anti-CA 19-9 monoclonal antibody | Calbiochem | CA1003 | |
| Anti-MUC5AC monoclonal antibody | Millipore | MAB2011 | |
| Avidin-Biotin blocking kit | Vector Labs | SP-2001 | |
| Biotinylated donkey anti-mouse antibody | Jackson Immunoresearch | 90863 | |
| Biotinylated SNA | Vector Labs | B-1305 | |
| Bovine serum albumin | Sigma-Aldrich | A4503 | |
| Chitin-hydrolysate | Vector Labs | SP-0090 | |
| Cryostat microtome | Leica Microsystems | Leica CM 1800 | |
| Hematoxylin | Surgipath Medical Ind. | 3801570 | |
| Hydrogen peroxide 30% | Fisher Scientific | H325-100 | |
| Jacalin-FITC | Vector Labs | FL-1151 | |
| Mayer's Hematoxylin | Sigma-Aldrich | MHS32 | |
| Melibiose | Sigma-Aldrich | M5500 | |
| Nuclear Fast Red | Vector Labs | H-3403 | |
| OCT compound | VWR International | 25608-930 | |
| Peroxidase conjugated streptavidin | Jackson Immunoresearch | 94638 | |
| Schiff reagent | Electron microscopy sciences | 26052 | |
| sWGA-Rhodamine | Vector Labs | RL1022S | |
| TKH2 monoclonal antibody | ATCC | HB-9654 | |
| VectaMount aqueous mounting media | Vector Labs | H-5501 | |
| Cytoseal 60 | Thermo Scientific | 8310-4 | |
| Peel-A Way molds | Polysciences Inc. | 18646A-1 |
References
- Slayter, H. S., Wold, J. K., Midtvedt, T. Intestinal mucin of germ-free rats. Biochemical and electron-microscopic characterization. Carbohydr. Res. 222, 1-9 (1991).
- Lamblin, G. The carbohydrate diversity of human respiratory mucins: a protection of the underlying mucosa. Am. Rev. Respir. Dis. 144, S19-S24 (1991).
- Corfield, A. P., Carroll, D., Myerscough, N., Probert, C. S. Mucins in the gastrointestinal tract in health and disease. Front. Biosci. 6, D1321-D1357 (2001).
- Turner, J. R. Intestinal mucosal barrier function in health and disease. Nat. Rev. Immunol. 9, 799-809 (2009).
- Lievin-Le Moal, V., Servin, A. L. The front line of enteric host defense against unwelcome intrusion of harmful microorganisms: mucins, antimicrobial peptides, and microbiota. Clin. Microbiol. Rev. 19, 315-337 (2006).
- Kim, Y. S., Ho, S. B. Intestinal goblet cells and mucins in health and disease: recent insights and progress. Curr. Gastroenterol. Rep. 12, 319-330 (2010).
- Nochi, T., Kiyono, H. Innate immunity in the mucosal immune system. Curr. Pharm. Des. 12, 4203-4213 (2006).
- Vareille, M., Kieninger, E., Edwards, M. R., Regamey, N. The airway epithelium: soldier in the fight against respiratory viruses. Clin. Microbiol. Rev. 24, 210-229 (2011).
- McGuckin, M. A., Linden, S. K., Sutton, P., Florin, T. H. Mucin dynamics and enteric pathogens. Nat. Rev. Microbiol. 9, 265-278 (2011).
- Knowles, M. R., Boucher, R. C. Mucus clearance as a primary innate defense mechanism for mammalian airways. J. Clin. Invest. 109, 571-577 (2002).
- Johansson, M. E. The inner of the two Muc2 mucin-dependent mucus layers in colon is devoid of bacteria. Proc. Natl. Acad. Sci. U.S.A. 105, 15064-15069 (2008).
- Hooper, L. V., Macpherson, A. J. Immune adaptations that maintain homeostasis with the intestinal microbiota. Nat. Rev. Immunol. 10, 159-169 (2010).
- Hayat, M. A. Microscopy, Immunohistochemistry, and Antigen Retrieval Methods: For Light and Electron Microscopy. Hayat, M. A. , Kluwer Academic/Plenum Publishers. New York, NY. 53-70 (2002).
- Cohen, M., Hurtado-Ziola, N., Varki, A. ABO blood group glycans modulate sialic acid recognition on erythrocytes. Blood. 114, 3668-3676 (2009).
- Cohen, M., Varki, A. The sialome--far more than the sum of its parts. OMICS. 14, 455-464 (2010).
- Ota, H., Katsuyama, T. Alternating laminated array of two types of mucin in the human gastric surface mucous later. Histochemical J. 24, 86-92 (1992).
- Matsuo, K., Ota, H., Akamatsu, T., Sugiyama, A., Katsuyama, T. Histochemistry of the surface mucous gel layer of the human colon. Gut. 40, 782-789 (1997).
- Boyde, A., Maconnachie, E. Treatment with lithium salts reduces ethanol dehydration shrinkage of glutaraldehyde fixed tissue. Histochemistry. 66, 181-187 (1980).



