Summary
Unfixierter gefrorenen Gewebeproben in Optimal Cutting Temperatur Medium (OCT) eingebettet werden verwendet, um natürliche Verteilung und Glykosylierung von sezernierten Schleim zu studieren. Bei diesem Ansatz Gewebe-Verarbeitung ist minimal und die natürliche Darstellung der Glycolipide, Schleimstoffe und Glykan-Epitope erhalten. Gewebeschnitte können immunhistochemisch mittels Fluoreszenz oder chromogener Detektion analysiert werden.
Abstract
Mucine sind komplex und stark glykosyliert O-verknüpften Glykoproteine, die mehr als 70% Kohlenhydrate enthalten Gew. 1-3. Sezernierten Muzine, produziert von Becherzellen und der Magenschleimhaut, bieten das Gerüst für eine Mikrometer dicke Schleimschicht, die Linien der Epithelien des Darms und der Atemwege 3,4. Neben Mucinen, Schleim Schichten enthalten auch antimikrobielle Peptide, Cytokine und Immunglobuline 5-9. Die Schleimschicht ist ein wichtiger Teil der Host angeborenen Immunität und bildet die erste Verteidigungslinie gegen eindringende Mikroorganismen 8,10-12. Als solche, die Schleim unterliegen zahlreichen Interaktionen mit Mikroben ist, bilden beide Pathogene und Symbionten, und sezernierten Muzine eine wichtige Schnittstelle für diese Wechselwirkungen. Die Untersuchung solcher biologischen Wechselwirkungen Regel beinhaltet histologischen Methoden zur Gewebesammelbeutel und Färbung. Die beiden am häufigsten verwendeten histologischen Methoden für die Gewebe-Sammlung und preservation in der Klinik und in Forschungslabors sind: Formalinfixierung durch Paraffineinbettung folgte, und Gewebe Gefrieren, gefolgt von der Einbettung in Cryo-Schutzmittel Medien.
Paraffin eingebetteten Gewebeproben erzeugen Schnitte mit optimalen Eigenschaften für die histologische Visualisierung mit Klarheit und gut definierten Morphologie. Jedoch während des Einbettungsprozesses Paraffin mehrere Epitope verändert werden, und um diese Epitope zu studieren, Gewebeschnitte weiter mit einer von vielen Methoden Epitopdemaskierung 13 verarbeitet werden müssen. Sekretiert Mucinen und Lipiden aus dem Gewebe während der Einbettung in Paraffin Lichtung Schritt, der zu verlängern Inkubation mit organischen Lösungsmitteln (Xylol oder Citrisolv) erfordert extrahiert. Daher ist dieser Ansatz nicht optimal für Studien, die die Art und Verteilung der Mucinen und Schleim in vivo.
Im Gegensatz dazu die Einbettung Gefrierpunkt Gewebe Optimal Cutting Temperature (OCT) Medium einHohlräume Austrocknung und Aufhellung der Probe und unterhält die Probe Feuchtigkeit. Dies ermöglicht eine bessere Konservierung des hydratisierten Schleimschicht, und ermöglicht somit die Untersuchung der zahlreichen Rollen der Mucine in epithelialen Biologie. Da diese Methode erfordert minimale Verarbeitung des Gewebes wird das Gewebe in einem natürlichen Zustand belassen. Deshalb eingefroren Geweben Abschnitte erfordern keine zusätzliche Verarbeitung vor der Färbung und können leicht analysiert werden mittels Immunhistochemie Methoden.
Wir zeigen die Erhaltung Mikrometer dicken ausgeschieden Schleimschicht in gefrorenem Doppelpunkt Proben. Diese Schicht wird drastisch reduziert, wenn die gleichen Gewebe in Paraffin eingebettet sind. Wir zeigen auch Immunfluoreszenzfärbung von Glykan Epitope auf Schleimstoffe mit Pflanzenlektinen vorgestellt. Der Vorteil dieses Ansatzes ist, dass es erfordert nicht die Verwendung von speziellen Fixiermittel und ermöglicht die Verwendung gefrorenen Gewebe, die bereits im Labor aufbewahrt werden kann.
Protocol
Ein. Tissue Einbettung in Oktober
- Vorbereiten einer Gefrierbad durch Zugabe von Trockeneis zu 2-Methyl-butan in einem flachen Styrobox.
- Ernten das Gewebe, und sanft auf einem Papiertuch feucht, um überschüssige Flüssigkeit zu trocknen. Bei der Verwendung von Snap-gefrorenem Gewebe (Gewebe, das in flüssigem Stickstoff eingefroren wurde), lassen Sie das Gewebe zu erwärmen bis -20 ° C, indem Sie es in einem Kryo-Mikrotom Kammer.
- Fügen Sie eine kleine Menge von Oktober an die Peel-A-Way Gefrierformbeutel, gerade genug, um den Boden der Form bedecken.
- Platzieren des Gewebes in der Form sicherstellen, das Gewebe auf der Unterseite der Form wird bei der gewünschten Orientierung ruhte. Sobald eingefroren wird der Gewebeblock entweder von unten oder von der Seite geschnitten.
- Bedecken Sie das Gewebe mit Oktober und die Form in der eisigen Bad. Die OCT-Verbindung wird weiß, wenn das Gewebe gefriert.
- Einmal eingefroren, ziehen Sie die Form aus dem gefrorenen Block und in einer deutlichen Gefrierbeutel.
- Die gefrorenen Blöcken gehalten werden kannbei -80 ° C bis zur Verwendung.
2. Tissue Schnitte
- Ort Gewebeblöcke in der Kryo-Mikrotom Kammer, und es ihnen zu -20 ° C (ca. 30 min) zu erreichen.
- Schneiden Sie ein 3-5 um dicken Abschnitt und legen Sie eine positiv geladene Objektträger aus Glas auf der Oberseite des Profils. Das Gewebe wird auf der Folie haften.
- An der Luft trocknen Gewebe für 30-60 min.
- Die Folien können in dieser Phase verwendet werden, oder sie können bei -80 ° C für die zukünftige Verwendung aufbewahrt werden.
3. Immunhistochemie
- Folien, die bei -80 ° C wurden: Die Objektträger zu tauen und an der Luft trocknen bei Raumtemperatur für 30 min.
- Befestigen Sie die Folien mit 10% gepuffertem Formalin für 30 min bei Raumtemperatur.
- Dreimal in PBS oder TBST-Puffer, für jede Wäsche tauchen die Folien 10 Mal in 250 ml Puffer. PBS Puffer kann Immunfluoreszenzfärbung verwendet werden, aber für chromogenen Nachweis mit alkalischer Phosphatase-conjugated Antikörper, TBST sollte, da das Phosphat in PBS verwendet werden hemmt Aktivität der alkalischen Phosphatase.
- Gewebeschnitte Dias können nun gefärbt werden.
4. Mit histochemische Färbungen wie Alcianblau und Periodic Acid Schiff um Schleim Detect
- Alcianblau Fleck:
- Spülen Sie die Dias in Wasser, 3% Essigsäure inkubieren 3 min bei Raumtemperatur.
- Verfärbung mit Alcianblau pH 2,5 für 30 min bei Raumtemperatur.
- Waschen Sie die Slides in fließendem Leitungswasser für 10 min, in DI Wasser spülen.
- Gegenfärbung in Nuclear Fast Red für 5 min bei Raumtemperatur.
- Wash gleitet dreimal in DI-Wasser.
- Periodic Acid Schiff Fleck:
- Spülen der Folien in Wasser, frisch zubereiteten 1% Perjodsäure für 5 min inkubiert.
- Dreimal in DI Wasser, einmal in MilliQ Wasser tauchen.
- Fleck mit Schiff-Reagenz für 15 min bei Raumtemperatur temperaturE.
- Waschen Sie die Slides in fließendem Leitungswasser für 10 min, in DI Wasser spülen.
- Gegenfärbung Hämatoxylin im Surgipath für 30 sec bei Raumtemperatur.
- Wash gleitet dreimal in DI-Wasser.
- Inkubieren 30 sec in Scotts Leitungswasser bei Raumtemperatur.
- Dreimal in DI-Wasser.
- Entwässern und deaktivieren Dias durch Inkubation 1 min in 95% Ethanol, durch drei schnelle Änderungen in 100% Ethanol und drei Änderungen in Citrisolv, 2 min jeweils gefolgt. Alle bei Raumtemperatur.
- Montieren Sie gleitet auf Deckgläsern mit harzigen Medium (Cytoseal 60).
5. Mit Lektine und Antikörper (Tabelle 1) Glycan Epitope durch histochemische Methoden erkennen
- Zur Fluoreszenzdetektion von drei Epitope Glykan mit Lektinen, blockieren die Folien mit 1% BSA in PBS für 10-30 min bei Raumtemperatur.
- Da ein biotinyliertes Lectin verwendet wird, zu blockieren endogenes Biotin durch Inkubation 15 min mit 0,1%Avidin, gefolgt von 15 min Inkubation mit 0,01% Biotin bei Raumtemperatur.
- Waschen Sie die Slides in PBS nach jedem Schritt des Blockierens.
- Frisch zubereiten eine Mischung aus 1 ug / ml Rhodamin-konjugierten succinylierte Weizenkeimagglutinin (sWGA), 1,3 pg / ml biotinylierten Sambucus nigra Agglutinin (SNA) und 5 ug / ml Fluorescein-konjugierten Jacalin in HEPES / NaCl-Puffer (10 mM HEPES, 150 mM NaCl pH 7,5).
- Objektträger auf eine ebene Fläche oder in einer Färbung Feld und das Lektin Schicht Mischung auf die Oberseite. Die Mischung Volumen durch sanftes Auflegen Parafilm auf die Flüssigkeit verringert werden kann, flacht die Parafilm die Flüssigkeit und verhindert die Verdunstung.
- Inkubieren 1 Std bei Raumtemperatur in Dunkelheit.
- Wasch gleitet dreimal mit PBS.
- Schicht Objektträger mit 0,7 ug / ml Streptavidin-konjugierten CY5 (um die biotinylierten-SNA erkennen), und Inkubation für 30 min bei Raumtemperatur im Dunkeln.
- Wasch gleitet dreimal mit PBS.
- Gegenfärbung Kerne mit 0,1 & mu; g / ml DAPI.
- Montieren gleitet auf Deckgläschen mit wässrigen Medium wie VectaMount Eindeckmitteln (oder irgendwelche wäßrigen Medien).
6. Controlling für Lectin Färbung Spezifität
- Lectin Färbung Spezifität wird entweder durch spezifische enzymatische Spaltung von Ziel-Glycan Epitop vor der Färbung oder durch die Konkurrenz mit kleinen Molekülen gesteuert.
- Enzymatische Spaltung zur Sambucus nigra-Agglutinin (SNA) Bindungsspezifität
- Verdünnte Arthrobacter ureafaciens Sialidase (AUS) auf 250 mU / ml in 50 mM Natriumacetat, pH 5,5.
- Fügen Sie Wasser auf den Boden eines leeren Tip-Box, wird dies eine feuchte Kammer während der Inkubation bilden.
- Die Objektträger offen auf den obersten Boden der Tip-Box, Schicht 150-200 ul AUS Lösung auf dem Objektträger geben und mit einem Deckglas. Vermeiden Luft Blasenbildung.
- Schließen Sie die Box-Deckel und bei 37 ° C für 2,5 Stunden.
- Wash gleitet dreimal in PBS bei Raumtemperaturtur, um alle freien Sialinsäuren zu entfernen. Diese Folien sollten für SNA-Färbung negativ.
- Kompetitive Inhibitoren für Jacalin und succinylierte Weizenkeimagglutinin (sWGA) Spezifität
- Aliquot 200 ul der Lektin Gemisch in Schritt 5,4 bis zwei Eppendorf Phiolen hergestellt.
- Hinzufügen 200 mM Melibiose (Jacalin Inhibitor) zu einem der Fläschchen und Chitin-Hydrolysat bei 1:10 Verdünnung (sWGA Inhibitor) zur anderen Ampulle.
- Overlay Negativkontrolle Objektträger mit dem Hemmer-enthaltenden Mischung, Inkubation 1 h bei Raumtemperatur an der gleichen Zeit wie der Rest der Folien. Diese Folien sollten für Jacalin oder sWGA Färbung negativ sind.
7. Repräsentative Ergebnisse
Ein Vergleich zwischen Gewebeproben in Paraffin gefrorenen Gewebe in Cryo-Schutzmittel Medien (OCT) Embedded Embedded zeigte auffälliger Unterschied in der Erhaltung und Qualität der Färbung für Mucin Glykoproteine. Gewebefärbung mit histochemischen Farbstoffe, wie Alcianblau und Periodic Acid Schiff, sehr unterschiedliche Ergebnisse in vergleichbaren Gewebeschnitten von gefrorenen oder in Paraffin eingebettete Proben (Abbildung 1). Es scheint, dass das organische Lösungsmittel (Xylol oder Citrisolv), die während der Paraffineinbettung Verfahren verwendet wird, beeinflusst die Verteilung des sekretierten Schleimstoffe auf Epithelien sowie Entfernen viel der Glycolipide von den Proben (Abb. 2). Als Ergebnis erscheint die Schleimschicht stürzte auf die Schleimhaut-Zellen und wird vor allem in Becherzellen gefunden. Flash Einfrieren von Gewebe in Cryo-Schutzmittel Medien (Oktober) gehalten Probe Feuchtigkeit und bewahrt die sezernierte Muzine Schicht Dimensionen. Die Paraffineinbettung Prozess betroffen anderen Schleim-assoziierten Glykane und Glykolipide in ähnlicher Weise. Glycan Verteilung wurde mittels Lektinen, die routinemäßig für Glycan Detektion verwendet werden (Abbildung 3) und Antikörper gegen Epitope gefunden aufMucinen und Glykolipide (Abbildung 6). Weil Lektinbindung ist nicht gut definiert und wird durch die räumliche Verteilung der Glycane sowie die Glycanstruktur 14,15 führt, ist es wichtig, die entsprechenden Steuerungen für Lectin Färbung anzuwenden. Hier zeigen wir zwei Methoden zur Steuerung Lektin Färbung auf den getesteten Geweben: enzymatische Spaltung und kompetitive Hemmung. Spaltung der Glycan Epitope wurde durch Verdauen des Gewebeschnitts mit Glycan-spezifischen Enzymen geschieht beispielsweise bakterielle Sialidase als Kontrolle für Sialinsäure-Bindung durch SNA (Abbildung 4). In Fällen, in denen spezifische Enzym (zB Glycosidase) nicht zur Entfernung des Glycan Epitop untersucht verfügbar, können Lectin Spezifität durch Zugabe eines kompetitiven Inhibitors wie Melibiose für Jacalin Färbung oder Chitin-Hydrolysat zur sWGA Färbung (Abbildung 5) bestätigt werden.
Wir zeigen hier, dass Snap-gefrorenen Gewebeproben, die rou sindtinely in der Klinik und in Forschungslabors erhalten, können weitere in OCT eingebettet werden und verwendet werden, um Mucin-Glycoproteinen und die vielen Glykane derzeit auf sie zu studieren.
| Lectin / Ab | Quelle | Wichtige Spezifität |
| LFA | Limax flavus (Gelbe slug) | Terminal Sia |
| MAA * | Maackia amurensis (Amur Maackia) | Siaα2-3Galβ1-R / 3-O-sulfat zu Gal &bgr; 1-R |
| SNA | Sambucus nigra (Holunder) | Siaα2-6Gal / Siaα2-6GalNAc |
| WGA | Triticum vulgaris (Weizenkeime) | GlcNAcβ1-4GlcNAcβ1-4GlcNAc / Sia |
| sWGA | Succinylierte Triticum vulgaris (Weizenkeime) | GlcNAc & beta, 1-4GlcNAcβ1-4GlcNAc |
| PNA | Arachis hypogaea (Erdnuss) | Gal &bgr; 1-3GalNAc (unmodifiziert T-Antigen) |
| Jacalin | Artocarpus integrifolia (Jacalin) | Gal &bgr; 1-3GalNAc am O-Glycane gefunden |
| ECA | Erythrina cristagalli (Coral tree) | Gal &bgr; 1-4GlcNAc |
| TKH2 | Antikörper | Siaa2-6GalNAc (STN) auf O-Glycane |
| CA19-9 | Antikörper | Siaa2-3Galβ1-4 (FUCA1-3) GlcNAc (SLe a) |
| SNH3 | Antikörper | Siaa2-3Galβ1-3 (FUCA1-4) GlcNAc (SLe x) |
Abkürzungen: Ab, Antikörper; Sia, Sialinsäure, Gal, Galactose, GalNAc,
Tabelle 1. Eine unvollständige Liste von Lektinen und Antikörpern für Glykan Epitope.
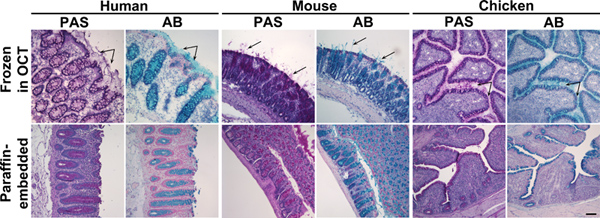
Abbildung 1. Alcianblau und Periodic Acid Schiff-Färbung von gefrorenen und in Paraffin eingebetteten Doppelpunkt Gewebe. Gewebeschnitte von Mensch, Maus oder Huhn Doppelpunkt Proben in OCT (oberes Feld) eingefroren oder in Paraffin eingebettet (unten) wurden mit Periodic Acid Schiff (PAS) gefärbt oder Alcianblau (AB). Diese Reagenzien Flecken Schleim rosa oder blau sind. Oben: Im gefrorene Gewebe, zusätzlich zu Mucinen bei Becherzellen war sezernierten Schleim auch visIVK (Pfeile). Unten: In Paraffin eingebettete Gewebe wurde Schleim Färbung zu Becherzellen beschränkt. Zellkerne wurden mit Surgipath (PAS) oder Mayers (AB) Hämatoxylin gegengefärbt. Maßstab zeigt 100 um. Klicken Sie hier für eine größere Abbildung zu sehen .

Abbildung 2. Citrisolv Inkubationszeit führt zu erheblichen Verlust der Schleimstoffe. Serielle Schnitte von gefrorenem Hühnerfleisch Ileum Proben wurden in 10% gepuffertem Formalin fixiert und gehalten hydratisiert (links), in Ethanol dehydriert durch sequentielle Inkubation in 70%, 90% und 100% Ethanol für 20 min each (Mitte), oder in Ethanol dehydriert und gelöscht mit Citrisolv für 1 h (rechts). Dehydratisierten Proben wurden zurück in PBS vor Hämatoxylin und Eosin (H & E) oder Alcianblaufärbung rehydratisiert. Ethanol Austrocknung und Citrisolv Clearing verbesserten Gewebe morMorphologie (zB, obere Reihe, Mitte und rechts Bildern gegenüber linkes Bild). Ethanol Dehydration hatte keinen signifikanten Einfluss auf Alcianblaufärbung (mittlere Reihe, zu vergleichen, linke und mittlere Bilder). Im Gegensatz dazu verringert Citrisolv Inkubation Alcian-Blau-Färbung und beschränkt es Becherzellen (mittlere Reihe, rechtes Bild) in einem Muster, ähnlich dem in Paraffin eingebetteten Gewebe (Abbildung 1) ersichtlich ist. Diese Daten implizieren, dass die starke Färbung von Schleim Granulat in Paraffin eingebettete Proben aufgrund schrumpfender und Kondensieren von Schleim in den Becherzellen bei der Räumung Schritt ist. Die schwächer und weniger dichte Färbung von Schleim in eingefrorenen Oktober eingebetteten Geweben spiegelt eine natürliche Verteilung der Schleim in das Gewebe. Höhere Vergrößerungen boxed Bereiche sind mit Pfeilen markiert. Maßstab Balken zeigen 50 um (oberen und mittleren Zeile) und 10 um (untere Reihe).

Abbildung 3. Bindung vonLektine Glykan Epitope auf gefrorenem und Paraffin eingebetteten Geweben. Chicken Dünndarm (Ileum) Proben in OCT (oben) eingefroren oder in Paraffin eingebettet (unten) wurden mit Jacalin (blau), sWGA (grün) und SNA sondiert (rot ). Höhere Vergrößerungen boxed Bereiche sind mit Pfeilen markiert. In gefrorenen Geweben Jacalin Bindung an O-Glycane offenbart Strukturen, die von Becherzellen werden Nässen in das Lumen (Jacalin, oberes Feld, Pfeile) erschienen. Im Gegensatz dazu wurde Jacalin Bindung an Paraffin-eingebetteten Geweben zu Becherzellen (Jacalin, unteres Feld, Pfeile) und die Zotten Bürstensaum (untere linke Bild, Pfeil) beschränkt. sWGA Färbung von β1-4GlcNAc teilweise mit der Bindung von Jacalin Lectin in beiden gefrorene Gewebe (oberes Feld, Pfeile) co-lokalisiert, und in Paraffin eingebettete Gewebe (unteres Feld, Pfeile). Im Gegensatz dazu ist die Bindung an Lectin SNA α2-6 verknüpft Sialinsäuren intrazelluläre (SNA, Pfeilspitzen) und nicht kolokalisieren mit Jacalin (FarbeBild SNA rot markiert mit einer Pfeilspitze, Jacalin in blau mit gestrichelten Pfeil markiert). Maßstab Balken zeigen 100 um (linke Bilder) und 20 um (vergrößert boxed Bereiche).

Abbildung 4. Enzymatische Spaltung Steuerung für Sialinsäure Färbung mit SNA. Huhn Dünndarm Proben wurden mit 250 mU / ml Arthrobacter ureafaciens Sialidase (AUS) oder mit 50 mM Natriumacetat-Puffer pH 5,5 und 2,5 h bei 37 ° C inkubiert AUS Behandlung schafft Färbung mit biotinylierten SNA, bestätigt SNA Bindungsspezifität an Sialinsäuren. Maßstab zeigt 100 um.

Abbildung 5. Steuerung für kompetitive Hemmung Glycan Färbung mit Jacalin und sWGA. Huhn Dünndarms (Ileum) Proben wurden mit einem Jacalin und sWGA Mischung in Gegenwart von spezifischen lec inkubierttin-Hemmer: Melibiose (mittlere Spalte), Chitin-Hydrolysat (rechte Spalte) oder ohne Inhibitor (A und D). Oben: (links) Jacalin Färbung ohne Inhibitoren. (Mitte) Jacalin Färbung wurde durch Melibiose gehemmt. (Rechts) Chitin-Hydrolysat nicht hemmen Jacalin Färbung. Unten: (links) sWGA Färbung ohne Inhibitor. (Mitte) Melibiose nicht hemmen sWGA Färbung. (Rechts) sWGA Färbung wurde von Chitin-Hydrolysat gehemmt. Diese Hemmung bestätigt die spezifische Interaktion von Lektinen mit den Geweben. Sternchen markieren Bild Färbung Hemmung. Maßstab zeigt 100 um.

Abbildung 6. Nachweis von sekretorischen Mucinen, Glykolipide und Glycan Epitope in gefrorenen menschlichen Dickdarmkrebs Geweben. Darmkrebs Biopsien von villöse Karzinom und Schleimhäute Karzinom wurden schockgefroren in flüssigem Stickstoff und eingebettet in Oktober Gewebeschnitte wurden für 1 h inkubiertmit Antikörpern gegen die sekretierten Mucin MUC5AC, Sialyl-Lewis a - Glycan Epitop auf Ganglioside (Darmkrebs Marker CA 19-9) gefunden, und Sialyl-Tn - vollflächiger Glycan Epitop auf Mucinen (detektiert mit TKH2 Antikörper), um 30 min Inkubation mit gefolgt biotinylierte Esel-Anti-Maus-IgG-sekundärem Antikörper, und 30 min Inkubation mit Peroxidase-konjugiertem Streptavidin. Zusätzliche Gewebe wurden für 1 Stunde mit dem biotinylierten Lektine SNA und sWGA inkubiert, gefolgt von 30 min Inkubation mit Peroxidase-konjugiertem Streptavidin. Peroxidasefärbung wurde entwickelt, mit AEC-Kit. Schwarz Maßstab zeigt 200 um.
Discussion
Konservierung von Schleim und Glycan Epitope in gefrorenen Geweben ist besser als die der Gewebe, die in Paraffin eingebettet waren. Wir haben gezeigt, die Erhaltung von sekretiertem Schleimschicht (1 und 3) und der Verteilung von drei Glycane Strukturen (Abbildung 3) in gefrorenen Geweben verglichen mit Paraffin eingebetteten Geweben. Spezialisierte Fixiermittel, wie Carnoys Lösung (60% Ethanol, 30% Chloroform, 10% Essigsäure) 17 sind für eine optimale Konservierung der Schleimschicht in Gewebeproben entwickelt. Optimalerweise sollte diese Lösung verwendet, um Gewebeproben für Schleim Studien gewidmet sind einzuziehen und wurde gezeigt, dass die glatte Aussehen Schleimschicht 16-17 erhalten. Die Schleimschicht in unfixierten eingefrorenen Proben in den Oktober eingebettetes robust und in einigen Bereichen kann aus dem Gewebe lösen, aber die gesamte Schichtdicke ist in Übereinstimmung mit dem im Gewebe, die mit Carnoy-Lösung und einbetten behoben wurden beobachteted in Paraffin 16-17. Zum Beispiel ist die Schleimschicht in gefrorener Gewebeschnitt menschlichen Dickdarm ~ 100 um (Abbildung 1), die innerhalb des Bereichs für Carnoy's-fixierten humanen Kolons Probe 55,4 ± 2,5 um (Bereich 7,7 bis 204,8 um) beträgt 16 gemeldet.
Es ist seit Jahrzehnten bekannt, dass Ethanol Dehydratisierung Ergebnisse in ~ 30% Schrumpf von biologischen Proben 18 und dass organische Lösungsmittel, wie Xylol, Proteine Citrisolv und Chloroformextrakt Lipide, Glykolipide und, in gewissem Maße von den Geweben 13. Tissue-Verarbeitung für Paraffineinbettung umfasst die folgenden Schritte: Fixierung (10% gepuffertem Formalin), Dehydration (steigende Ethanol-Konzentration) und Clearing (Citrisolv oder Xylol). Durch Nachahmung diese Schritte auf unfixierten gefrorenen Gewebeschnitten, zeigten wir, dass Citrisolv Schleim von Gefrierschnitten wodurch Gewebemorphologie die ähnlich derjenigen von in Paraffin eingebetteten Geweben ist extrahiert (Figure 2, rechts). Im Gegensatz dazu wurde die Schleimschicht nicht durch Inkubation mit Formalin oder Ethanol (Abb. 2, links und Mitte-Panels) verändert. Dies deutet darauf hin, dass das Clearing Schritt von Standard Paraffineinbettung Verfahren, das verlängerte Inkubationszeit erfordert in Citrisolv / Xylol, führt zum Kollabieren der Schleimschicht. Formalinfixierung nicht beschädigt Schleimschicht und gefrorenen Gewebe Abschnitte, die mit Formalin fixiert wurden, können leicht mit Lektine und Antikörper gegen Glykane, Glykolipide und Proteine (Abbildungen 2, 3 und 6) gefärbt werden. Diese Effekte vernachlässigbar sein für das Studium der membrangebundenen Proteine und Gewebepathologie, aber sie sind für hochhydratisierten Strukturen wie der sezernierte Schleimschicht verheerend. Jedoch histologische Untersuchungen von Mucinen noch meist mit Paraffin eingebettete Proben, bei der die Schleimschicht Konservierung nicht optimal durchgeführt. In eingehenden Analysen der Schleimschicht Zusammensetzung wie die genaue Identität secreted oder membrangebundene MUC Glykoprotein Kombinationen erfordern spezifische Antikörper und Massenspektrometrie zur Identifizierung der Protein-Backbones. Erhaltung der Schleimschicht ist aber die anfängliche Anforderung für solche Studien.
Vielen Laboratorien haben Gewebeproben in OCT eingefroren, die in der Vergangenheit für verschiedene Projekte wurden gesammelt, können diese Gewebe ohne weiteres eingesetzt werden zu Mucinen, Glykolipide und Glycan Verteilung entfällt die Notwendigkeit, Geweben in spezielle Fixiermittel, der einzigartig für Schleim Konservierung entworfen sammeln studieren. Gefrorenem Gewebe unterziehen minimale Verarbeitung und somit die natürliche Verbreitung der Glykane, die hydratisiert in der Natur sind, wird beibehalten. Dies ist besonders wichtig in dem Bereich der mikrobielle Wirt-Wechselwirkungen. Kenntnisse der naturalistischen Verteilung und Häufigkeit von sezernierten Muzine und die vielen Glykanstrukturen schmücken diese "Barriere" Moleküle werden der Schlüssel für das Verständnis Immunabwehr, mikrobielle Ausbeutung und Erregerist.
Disclosures
Keine Interessenskonflikte erklärt.
Acknowledgments
Die Autoren bedanken sich bei Nicole M. Nemeth (University of Georgia) und Jeanne M. Fair (LANL) für ihre Hilfe bei der Ernte Hühnerfleisch danken und Steven A. Springer für seine Hilfe während der Dreharbeiten. Die Betreuung aller Vögel in dieser Studie war in Übereinstimmung mit National Institutes of Health Leitlinien für die humane Nutzung von Labortieren und alle Protokolle wurden von der Institutional Animal Care und Formate Ausschüsse am Los Alamos National Security, LLC, Betreiber des Los Alamos zugelassen National Laboratory unter Vertrag Nr. DE-AC52-06NA25396 mit dem US Department of Energy. Die Pflege der Mäuse in dieser Studie ist in Übereinstimmung mit UCSD Tier zugelassenen Protokolls. Menschliche Gewebe wurden als Teil der UCSD zugelassenen IRB-Protokoll erhalten. Diese Arbeit wurde durch Zuschüsse 118.645 von der University of California Lab Fee President Program (PG) und Grant NS047101 vom National Institute of Neurological Disorders and Stroke (Neuroscience Microscopy Gemeinsame Facility, UC San Diego) unterstützt.
Materials
| Name | Company | Catalog Number | Comments |
| 2-methyl butane | Fisher Scientific | 03551-4 | |
| AEC peroxidase substrate kit | Vector Labs | SK-4200 | |
| Alcian Blue | Sigma-Aldrich | A3157 | |
| Anti-CA 19-9 monoclonal antibody | Calbiochem | CA1003 | |
| Anti-MUC5AC monoclonal antibody | Millipore | MAB2011 | |
| Avidin-Biotin blocking kit | Vector Labs | SP-2001 | |
| Biotinylated donkey anti-mouse antibody | Jackson Immunoresearch | 90863 | |
| Biotinylated SNA | Vector Labs | B-1305 | |
| Bovine serum albumin | Sigma-Aldrich | A4503 | |
| Chitin-hydrolysate | Vector Labs | SP-0090 | |
| Cryostat microtome | Leica Microsystems | Leica CM 1800 | |
| Hematoxylin | Surgipath Medical Ind. | 3801570 | |
| Hydrogen peroxide 30% | Fisher Scientific | H325-100 | |
| Jacalin-FITC | Vector Labs | FL-1151 | |
| Mayer's Hematoxylin | Sigma-Aldrich | MHS32 | |
| Melibiose | Sigma-Aldrich | M5500 | |
| Nuclear Fast Red | Vector Labs | H-3403 | |
| OCT compound | VWR International | 25608-930 | |
| Peroxidase conjugated streptavidin | Jackson Immunoresearch | 94638 | |
| Schiff reagent | Electron microscopy sciences | 26052 | |
| sWGA-Rhodamine | Vector Labs | RL1022S | |
| TKH2 monoclonal antibody | ATCC | HB-9654 | |
| VectaMount aqueous mounting media | Vector Labs | H-5501 | |
| Cytoseal 60 | Thermo Scientific | 8310-4 | |
| Peel-A Way molds | Polysciences Inc. | 18646A-1 |
References
- Slayter, H. S., Wold, J. K., Midtvedt, T. Intestinal mucin of germ-free rats. Biochemical and electron-microscopic characterization. Carbohydr. Res. 222, 1-9 (1991).
- Lamblin, G. The carbohydrate diversity of human respiratory mucins: a protection of the underlying mucosa. Am. Rev. Respir. Dis. 144, S19-S24 (1991).
- Corfield, A. P., Carroll, D., Myerscough, N., Probert, C. S. Mucins in the gastrointestinal tract in health and disease. Front. Biosci. 6, D1321-D1357 (2001).
- Turner, J. R. Intestinal mucosal barrier function in health and disease. Nat. Rev. Immunol. 9, 799-809 (2009).
- Lievin-Le Moal, V., Servin, A. L. The front line of enteric host defense against unwelcome intrusion of harmful microorganisms: mucins, antimicrobial peptides, and microbiota. Clin. Microbiol. Rev. 19, 315-337 (2006).
- Kim, Y. S., Ho, S. B. Intestinal goblet cells and mucins in health and disease: recent insights and progress. Curr. Gastroenterol. Rep. 12, 319-330 (2010).
- Nochi, T., Kiyono, H. Innate immunity in the mucosal immune system. Curr. Pharm. Des. 12, 4203-4213 (2006).
- Vareille, M., Kieninger, E., Edwards, M. R., Regamey, N. The airway epithelium: soldier in the fight against respiratory viruses. Clin. Microbiol. Rev. 24, 210-229 (2011).
- McGuckin, M. A., Linden, S. K., Sutton, P., Florin, T. H. Mucin dynamics and enteric pathogens. Nat. Rev. Microbiol. 9, 265-278 (2011).
- Knowles, M. R., Boucher, R. C. Mucus clearance as a primary innate defense mechanism for mammalian airways. J. Clin. Invest. 109, 571-577 (2002).
- Johansson, M. E. The inner of the two Muc2 mucin-dependent mucus layers in colon is devoid of bacteria. Proc. Natl. Acad. Sci. U.S.A. 105, 15064-15069 (2008).
- Hooper, L. V., Macpherson, A. J. Immune adaptations that maintain homeostasis with the intestinal microbiota. Nat. Rev. Immunol. 10, 159-169 (2010).
- Hayat, M. A. Microscopy, Immunohistochemistry, and Antigen Retrieval Methods: For Light and Electron Microscopy. Hayat, M. A. , Kluwer Academic/Plenum Publishers. New York, NY. 53-70 (2002).
- Cohen, M., Hurtado-Ziola, N., Varki, A. ABO blood group glycans modulate sialic acid recognition on erythrocytes. Blood. 114, 3668-3676 (2009).
- Cohen, M., Varki, A. The sialome--far more than the sum of its parts. OMICS. 14, 455-464 (2010).
- Ota, H., Katsuyama, T. Alternating laminated array of two types of mucin in the human gastric surface mucous later. Histochemical J. 24, 86-92 (1992).
- Matsuo, K., Ota, H., Akamatsu, T., Sugiyama, A., Katsuyama, T. Histochemistry of the surface mucous gel layer of the human colon. Gut. 40, 782-789 (1997).
- Boyde, A., Maconnachie, E. Treatment with lithium salts reduces ethanol dehydration shrinkage of glutaraldehyde fixed tissue. Histochemistry. 66, 181-187 (1980).



