ERRATUM NOTICE
Important: There has been an erratum issued for this article. Read more …
Introduction
על 1: 500 עד 1: 1000 תינוקות תערוכה שסועים מעורבים השפה ו / או חיך (CLP); כך זה מום המולד הנפוץ ביותר בבני האדם 1. השרירים של החיך הרך הם קריטיים לתפקודו של החיך הרך בדיבור, בליעה, ומציצה. אם שסוע של החיך הרך הוא הווה, שרירים אלה מוכנסים באופן חריג לקצה האחורי של עצם החיך.
החיך הרך נע מעלה ומטה במהלך נאום, מניעת אוויר לברוח דרך האף. ילדים עם שסע בחיך אין לי פונקצית שליטה זו וכתוצאה מכך תופעה הידועה בתפקוד velopharyngeal 2,3. למרות שפרוטוקולי הטיפול משתנים, התיקון ניתוחי של החיך הרך מתרחש בילדות המוקדמת (6-36 חודשים של גיל) 4. השרירים מוכנסים באופן חריג של החיך הרך ניתן לתקן בניתוח 5-7, לעומת זאת, תפקוד לקוי של velopharyngeal נמשך ב -7% עד 30%של החולים 2,3,8-10.
יכולתו של שריר שלד להתחדש דרך הפעולה של תאי לווין (SCS) היא מבוססת היטב 11,12. על פגיעה בשרירים, מאמנים מופעלים ולעבור לאתר של פציעה. לאחר מכן הם מתרבים, להבדיל, ולמזג ליצירת myofibers החדש או אלה תיקון פגום 13. מאמנים רגיעה להביע גורם שעתוק Pax7 14,15, בעוד צאצאיהם, myoblasts מתרבים, גם להביע גורם myogenic נחישות 1 (Myod) 16. myoblasts ההבחנה להתחיל להביע myogenin (MyoG) 17. בידול המסוף של myoblasts מסומן על ידי ההיווצרות של myofibers, והביטוי של חלבוני שריר ספציפי כגון שרשרת שרירן כבדה (MyHC) 16,18.
לאחרונה, מספר אסטרטגיות כבר בשימוש ברפואת רגנרטיבית לשפר התחדשות שריר של שרירי גפיים 19-23. מחקרים ספציפיים עלשרירי ראש branchiomeric חשובים גם משום שהוא הוכיח לאחרונה כי הם שונים משרירים אחרים בכמה היבטים 24. בניגוד לשרירי גפיים, זה כבר הציע שרירי ראש branchiomeric מכילים פחות SCS 25, להתחדש איטי יותר, ורקמת חיבור סיבית יותר נוצר לאחר פציעת 26 בנוסף, מתרבות מאמנים משרירי ראש branchiomeric גם להביע את גורמי שעתוק אחרים. לדוגמא, Tcf21, גורם שעתוק לבניית שריר craniofacial בחום לידי ביטוי בהתחדשות שרירי ראש אבל לא בהתחדשות שרירי גפיים 25. השרירים בחיך הרך של חולי CLP הם בדרך כלל קטנים ומאורגן היטב פחות בהשוואה לשרירי חיך רגיל 27,28. סיבים איטיים ומהירים גם נמצאים בשרירי החיך הרכים אבל הסיבים איטיים הם שופעים יותר. לעומת זאת, שרירים שסועים מכילים שיעור גבוה יותר של סיבים מהירים וגם אספקת נימים מופחתתלעומת שרירי חיך רכים נורמלים 29-31. סיבים מהיר נוטים יותר לפגיעה הנגרמת על-התכווצות 31-33. אספקת נימי עניים הנלווית עשויה גם לקדם סיסטיק 34,35. כל ההיבטים הללו עשויים לתרום לעניי ההתחדשות של שרירי חיך רכים לאחר סגירה שסועה כירורגית 36. לאור זאת, פרוטוקול לבידוד והאפיון של שריר ראש branchiomeric SCS הוא חיוני. זה מספק את האפשרות ללמוד ביולוגיה SC של שרירי ראש branchiomeric. בנוסף, ניתן לפתח טיפולים חדשים המבוססים על הנדסת רקמות לקידום התחדשות שריר לאחר הניתוח בCLP ותנאים אחרים להתפשר אזור craniofacial.
באופן כללי, ניתן לקבל SCS לאחר הניתוק של רקמת שריר 14. ממינסינג, עיכול אנזימטי, וטחינה הדקה נדרשים בדרך כלל כדי לשחרר מאמנים מהנישה שלהם. יכול להיות מטוהר SCS ידי מראש ציפוי על מנות ללא ציפוי 14,37,38, fractionation על Percoll 39,40, תא או ניאון או מגנטי מיון 41-43. כאן אנו מציגים פרוטוקול כלכלי ומהיר חדש לבידוד של תאי לווין משרירי ראש branchiomeric של חולדות מבוגרות צעירות. פרוטוקול זה מבוסס על כתב יד קודמת 14 ומותאם ספציפית לדגימות רקמה קטנות. הבידוד של מאמנים משרירי נציג מקורם -1, 2 nd, ו -4 קשתות branchial ה מתואר. לאחר בידוד, מספרים נמוכים של תאי לווין בתרבית על כתמי ג'ל מטריקס בגודל מילימטר ללמוד הבידול שלהם. גישה זו תמנע את הדרישה להרחבה וpassaging של מאמנים.
Protocol
כל הניסויים המתוארים במסמך זה אושרו על ידי הדירקטוריון המקומי לניסויים בבעלי חיים מRadboud ניימיכן האוניברסיטה בהתאם לחוקים ולתקנות (RU-DEC 2,013-205) הולנדיים.
1. כתמים תאי מטריקס ג'ל
- בצע את השלבים הבאים יום אחד לפני הבידוד:
- להפשיר ג'ל מטריקס aliquot (100 μl) בשעה 4 מעלות צלזיוס במשך לפחות 1.5 שעות. לדלל 1:10 ב הבינוני של הנשר שונה Dulbecco; עם 4,500 מ"ג / גלוקוז L, 4 המ"מ L- גלוטמין, ו -110 מ"ג / מיליליטר נתרן פירובט (DMEM). שמור את הג'ל מטריקס על 4 מעלות צלזיוס בכל העת. הערה: שינויי טמפרטורה פתאומיים יגרמו ציפוי אחיד והיווצרות גבישים.
- שמור את פתרון ג'ל מטריקס המדולל על קרח במשך 15 דקות.
- טרום צמרמורת micropipette 20 μl במשך 10 דקות.
- שים שקופיות קאמריות 8 היטב לתוך צלחת פטרי 100 מ"מ ולהעביר את הצלחת על גבי משטח קר (לדוגמא חבילת מקפיא) למשך 10 דקות.
- השתמש micropipette מראש צונן לשים טיפה של ג'ל מטריקס 10 μl בכל טוב. שמור את צלחת פטרי על פני השטח הקרים לפחות עוד 7 דקות (איור 1 א).
- להסיר לחלוטין את הג'ל מטריקס הנותר (איור 1), ולייבש את הבארות על 37 מעלות צלזיוס למשך לילה.
2. שרירי Dissection של הראש (Masseter, Digastric, וLevator Veli Palatini)
- לפני הנתיחה, להכין 50 מיליליטר של פוספט שנאגרו מלוח (PBS) בתוספת 2% פניצילין, סטרפטומיצין (P / S). שמור על קרח.
- לאחר המתת חסד של עכברוש אחד צעיר מבוגר (9 שבועות) עם CO 2 / O 2, לערוף את הראש ולהסיר את העור מהראש. העבר את הראש לPBS קר כקרח בתוספת 2% P / S בשפופרת 50 מיליליטר.
- שריר המלעס (הנגזר מקשת branchial 1)
- מניחים את הראש עם צד אחד עד על כרית סיליקון ולתקן עם n המזרקeedles (איור 2 א).
- זהה את בלוטת הפרוטיד ועצב פנים (איור 2 א). לחשוף את fascia העמוק מכסה את הבלוטה. חותך את fascia ולהסיר את הבלוטה באמצעות מספריים לנתיחה. זהה את תעלת השמע החיצונית. עקוב אחר עצב הפנים מנקב stylomastoid ולהסיר בזהירות את הסניפים זמניים, הזיגומטית, ולחי עם להב מס '15 אזמל.
- לשחרר את הראש השטחי של השריר המלעס ידי הסרת fascia. לזהות ראשי שני שטחיים ועמוקים של השריר המלעס. עקוב אחר הראש השטחי עד אָלָל tendinous העבה שלה הוכנס בתהליך הזיגומטית של הלסת העליונה.
- הפרד את הגיד ממקורו בתהליך הזיגומטית עם מלקחיים ישר. לחתוך אותו בסכין אזמל מס '15 או מספריים לנתיחה ובזהירות חיים זה (איור 2).
- לנתח את הראש השטחי של masseter עד כניסתה בזווית וחצי הנחותה של tהוא רוחב פני השטח של Ramus של הלסת התחתונה עם מס '15 להב סכין מנתחים (איור 2 ג). עכשיו, להסיר לחלוטין את השריר.
- בטן אחורית של שריר digastric (הנגזרת מקשת 2 nd branchial)
- מניחים את הראש במצב שכיבה על משטח סיליקון ולתקן עם מזרקים (איור 3 א).
- הסר את השומן תת עורי שמעל שני sublingual ובלוטות submandibular. בשלב הבא, להסיר את fascia ובלוטות באמצעות מספריים לנתיחה השטחיים. לחשוף את השרירים digastric (קדמית ואחורית בטן).
- החזק את הגיד הקדמי של הבטן האחורית עם מלקחיים ישר, לחתוך אותו, ולנתח אותו בזהירות עד שמקורו בבולת התוף (איור 3). לעשות את אותו הדבר בצד הנגדי.
- שריר Levator palatini Veli (הנגזר מקשת branchial 4)
- לאחר הנתיחה של הבטן האחורית של שריר digastric, למקם את השרירים stylohyoid, למשוך אותו לרוחב, ולהסיר אותו (איור 4 א) בזהירות.
- למקם את הגיד של palatini Veli Levator שמחדיר בבולת התוף (איור 4 א). לנתח את זה בזהירות ולחתוך אותו משני הצדדים.
- חפש את קנה הנשימה והוושט שפועל מאחוריו. הרם את הוושט, ולחשוף את הלוע, הגרון וחיך הרך.
- למקם את האזור של החיך הרך שבי palatini Veli Levator מוכנס ולחתוך אותו רופפים (איור 4).
הערה: מייד לאחר נתיחה, להסיר בזהירות גיד ורקמות חיבור מכל שריר מתחת למיקרוסקופ סטריאו. לצלול כל הדגימות במהירות באתנול 70%, ולהעביר אותם לPBS קר כקרח בתוספת 2% P / S בשפופרת 15 מיליליטר.
3. בידוד של תאי לווין
- בצע את שלבי ההכנה הבאות לבידוד SC מ 3 קבוצות של שרירים:
- הכן 7.5 מיליליטר של pronase 0.1% בDMEM. סנן את הפתרון דרך פילטר 0.22 מיקרומטר. טרום חם הפתרון על 37 מעלות צלזיוס באמבט מים במשך 10 דקות לפני הבידוד.
- הכן 35 מיליליטר של DMEM בתוספת 10% על סוסים סרום (HS) ו -1% P / S. טרום חם גם על 37 מעלות צלזיוס באמבט מים.
- הכן 15 מיליליטר מדיום התרבות אשר מורכב DMEM בתוספת 20% בסרום שור עוברי (FBS), 10% HS, 1% P / S ו 1% תמצית עובר עוף (CEE). טרום חם על 37 מעלות צלזיוס באמבט מים.
- שש טפטפות טרום מעיל פלסטיק (10 מיליליטר) עם HS ויבש במשך לפחות 10 דקות לפני השימוש.
- בשכונה התרבות, להעביר כל שריר לתוך באר של צלחת 6-היטב. שימוש במספריים לנתיחה, לחתוך את השריר בחתיכות קטנות של כ -2 מ"מ. היזהר שלא לקצץ את הרקמה יותר מדי.
- בזהירות להוסיף 2.5 מיליליטר של 0.1% פתרון pronase היטב כל אחד ולדגור על 37 מעלות צלזיוס במשך 60 דקות. נער בעדינות את הצלחת אחרי 20, 40, ו -60 דקות. הערה: duratio המדויקn של הדגירה תלויה בגורמים כמו גיל ומתח של בעלי החיים.
- צג מתחת למיקרוסקופ. בדוק את שברי השריר ולהפסיק את עיכול אנזימטי כאשר חבילות הסיבים לקבל מראה רפוי (איור 5).
- להוסיף 2.5 מיליליטר של DMEM בתוספת HS 10% ו -1% P / S. העבר לצינור 15 מיליליטר ו צנטריפוגות הצינורות ב 400 XG במשך 5 דקות. בטל supernatant ידי decantation.
- הוסף 5 מיליליטר DMEM בתוספת HS 10% ו -1% P / S. פיפטה הפתרון למעלה ולמטה עם פיפטה 10 מיליליטר פלסטיק (טחינה דקה) לפחות 20 פעמים כדי homogenize הרקמה.
- בצנטריפוגה הצינורות ב XG 200 במשך 4 דקות. לאסוף את supernatant ולהעביר לתוך צינור 15 מיליליטר.
- הוסף 5 מיליליטר DMEM בתוספת HS 10% ו -1% P / S. פיפטה שוב עם טפטפת פלסטיק 10 מיליליטר עד שברי הרקמות עוברת בקלות דרך פיפטה.
- בצנטריפוגה הצינורות ב XG 200 במשך 4 דקות ולאסוף את supernatant בצינור 15 מיליליטר.
- Put מסננת תא (40 מיקרומטר) על צינור 50 מ"ל ולהעביר את supernatant המכיל את התאים ניתקו על המסנן. לשטוף עם DMEM 1 מיליליטר להתאוששות תא מקסימאלי.
- צנטריפוגה הצינורות XG ב 1000 עבור 10 דקות וזורקים supernatant עם pipet.
- Resuspend גלולה במדיום תרבות 300 μl ולספור את התאים בhemocytometer.
4. התמיינות של תאי לווין בכתמים תאי מטריקס ג'ל
- לדלל את ההשעיה התא להשיג 1.5 x 10 3 תאים ב 10 μl של מדיום התרבות.
- אבטח את הכיסויים של שקופיות תאים עם קלטת ולסמן את הנקודות עם טוש שחור בצד התחתון של זכוכית האובייקט.
- באמצעות micropipette, לשים טיפה של השעיה תא 10 μl על מקום ג'ל מטריקס. בדוק תחת מיקרוסקופ אם הירידה של השעיה תא הושמה כהלכה במקום. דגירה במשך שש שעות על 37 מעלות צלזיוס.
- זהירly להוסיף 400 μl של מדיום התרבות (DMEM בתוספת 20% FBS, 10% HS, 1% P / S CEE ו -1%) ודגירה במשך שלושה ימים על 37 מעלות צלזיוס.
הערה: בשלב זה, SC מבודד טרי חשופים לטראומה מסיבית (תקציר האנזימטית וטחינה דקה קשה) והם צריכים להתאושש. נא לא להפריע לתאים במהלך שלושת הימים הראשונים 37. בשלב הבא, מדיום התרבות יכול להיות שונה בהתאם לסוג של ניסוי.
ניתן נזרעו כתמי מטריקס ג'ל עם צפיפות גבוהה של תאים (1.5-2.5 x 10 3/20 μl) עבור assay בידול. תרבות בינונית (DMEM בתוספת 20% FBS, 10% HS, 1% P / S ו 1% תמצית עובר עוף) יכול להיות מוחלף בכל יום שלישי. - לחלופין, אם הרחבה וחולפת היא רצויה לבצע את השלבים הבאים:
- להפשיר ג'ל מטריקס aliquot (500 μl) בשעה 4 מעלות צלזיוס במשך לפחות 1.5 שעות. לדלל 1:10 ב DMEM ולבצע את ההמלצות בנקודה 1.1.1.
- טרום צמרמורת פיפטה 10 מיליליטר במשך 10 דקות ב 4 ו# 176; ג.
- העבר את שלוש צלוחיות T75 על גבי משטח קר (לדוגמא חבילת מקפיא) למשך 10 דקות.
- השתמש פיפטה מראש צונן לשים 1 מיליליטר ג'ל מטריקס לכל בקבוק. בדוק שהשטח מכוסה לחלוטין. שמור את צלוחיות על פני השטח הקרים לפחות עוד 7 דקות (איור 1 א).
- להסיר לחלוטין את הג'ל מטריקס נותר עם פיפטה 10 מיליליטר, ולייבש את הבארות על 37 מעלות צלזיוס במשך שעה 1.
- לאחר הספירה, resuspend SCS המבודדים הטרי ב 10 מיליליטר של מדיום תרבות (DMEM בתוספת 20% FBS, 10% HS, 1% P / S ו 1% תמצית עובר עוף) וזרע בצלוחיות T75 מצופה מראש.
- אחרי שלושה ימים, לשנות הבינוני (ובכל יום שלישי) עד מפגש 80% הוא הגיע. לpassaging, לשטוף את צלוחיות T75 שלוש פעמים עם PBS. הבא להוסיף 1 מיליליטר 0.25% פתרון טריפסין ודגירה של שלוש דקות על 37 מעלות צלזיוס. גלול ב9 מיליליטר של מדיום התרבות (DMEM בתוספת 20% FBS, 10% HS, 1% P / Sו 1% תמצית עובר עוף) וצנטריפוגות ב XG 200 במשך 5 דקות. בטל supernatant. לאחר הספירה, resuspend 1 x 10 6 תאים ב1,000 μl של מדיום התרבות ולהקפיא את התאים.
Materials
| Name | Company | Catalog Number | Comments |
| Hypodermic Needle 25 G 0.5 x 25 m | BD Microlance | 300400 | |
| Dissecting scissors | Braun | BC154R | |
| Micro forceps straight | Braun | BD330R | |
| Surgical Scalpel Blade No. 15 | Swann-Morton | 0205 | |
| Alcohol 70% | Denteck | 2,010,005 | |
| Permanox Slide, 8 Chamber | Thermo Scientific | 177445 | |
| 6 well cell culture plate | Greiner bio-one | 657160 | |
| Cell Culture Dishes (100 x 20 mm) | Greiner bio-one | 664160 | |
| 15 ml sterile conical centrifuge tube | BD Biosciences | 352097 | |
| 50 ml sterile conical centrifuge tube | BD Biosciences | 352098 | |
| Cell strainer (40 μm) | Gibco | 431750 | |
| 10 ml serological pipette | Greiner bio-one | 607180 | |
| 20 µl FT20 | Greiner bio-one | 774288 | |
| Matrigel, Phenol-Red Free | BD Biosciences | 356237 | 10 ml |
| Pronase | Calbiochem | 53702 | 10 KU |
| Phosphate Buffered Saline | Gibco | 14190-144 | 500 ml |
| Dulbecco's Modified Eagle Medium, high glucose, GlutaMAX Supplement, pyruvate | Gibco | 10569-010 | 500 ml |
| Fetal Bovine Serum | Fisher Scientific | 3600511 | 500 ml |
| Horse Serum | Gibco | 26050088 | 500 ml |
| Penicillin-Streptomycin (10,000 U/ml) | Gibco | 15140-122 | 100 ml |
| Chicken Embryo Extract | MP Biomedicals | 2850145 | 20 ml |
References
- Gritli-Linde, A. Molecular control of secondary palate development. Developmental Biology. 301, 309-326 (2007).
- Marrinan, E. M., LaBrie, R. A., Mulliken, J. B. Velopharyngeal function in nonsyndromic cleft palate: relevance of surgical technique, age at repair, and cleft type. The Cleft Palate-Craniofacial Journal. 35, 95-100 (1998).
- Morris, H. L. Velopharyngeal competence and primary cleft palate surgery, 1960-1971: a critical review. The Cleft Palate Journal. 10, 62-71 (1973).
- Mossey, P. A., Little, J., Munger, R. G., Dixon, M. J., Shaw, W. C. Cleft lip and palate. Lancet. 374, 1773-1785 (2009).
- Boorman, J. G., Sommerlad, B. C. Musculus uvulae and levator palati: their anatomical and functional relationship in velopharyngeal closure. British Journal of Plastic Surgery. 38, 333-338 (1985).
- Bae, Y. C., Kim, J. H., Lee, J., Hwang, S. M., Kim, S. S. Comparative study of the extent of palatal lengthening by different methods. Annals of Plastic Surgery. 48, 359-362 (2002).
- Braithwaite, F., Maurice, D. G. The importance of the levator palati muscle in cleft palate closure. British Journal of Plastic Surgery. 21, 60-62 (1968).
- Inman, D. S., Thomas, P., Hodgkinson, P. D., Reid, C. A. Oro-nasal fistula development and velopharyngeal insufficiency following primary cleft palate surgery--an audit of 148 children born between 1985 and 1997. British Journal of Plastic Surgery. 58, 1051-1054 (2005).
- Phua, Y. S., de Chalain, T. Incidence of oronasal fistulae and velopharyngeal insufficiency after cleft palate repair: an audit of 211 children born between 1990 and 2004. The Cleft Palate-Craniofacial Journal. 45, 172-178 (1990).
- Kirschner, R. E., et al. Cleft-palate repair by modified Furlow double-opposing Z-plasty: the Children's Hospital of Philadelphia experience. Plastic and Reconstructive Surgery. 104, 1998-2010 (1999).
- Mauro, A. Satellite cell of skeletal muscle fibers. The Journal of Biophysical and Biochemical Cytology. 9, 493-495 (1961).
- Yablonka-Reuveni, Z. The skeletal muscle satellite cell: still young and fascinating at 50. The Journal of Histochemistry and Cytochemistry. 59, 1041-1059 (2011).
- Ten Broek, R. W., Grefte, S., Von den Hoff, J. W. Regulatory factors and cell populations involved in skeletal muscle regeneration. Journal of Cellular Physiology. 224, 7-16 (2010).
- Danoviz, M. E., Yablonka-Reuveni, Z. Skeletal muscle satellite cells: background and methods for isolation and analysis in a primary culture system. Methods in Molecular Biology. 798, 21-52 (2012).
- Seale, P., et al. Pax7 is required for the specification of myogenic satellite cells. Cell. 102, 777-786 (2000).
- Yablonka-Reuveni, Z., et al. The transition from proliferation to differentiation is delayed in satellite cells from mice lacking MyoD. Developmental Biology. 210, 440-455 (1999).
- Zammit, P. S., Partridge, T. A., Yablonka-Reuveni, Z. The skeletal muscle satellite cell: the stem cell that came in from the cold. The Journal of Histochemistry And Cytochemistry. 54, 1177-1191 (2006).
- Andres, V., Walsh, K. Myogenin expression, cell cycle withdrawal, and phenotypic differentiation are temporally separable events that precede cell fusion upon myogenesis. The Journal of Cell Biology. 132, 657-666 (1996).
- Fukushima, K., et al. The use of an antifibrosis agent to improve muscle recovery after laceration. The American Journal of Sports Medicine. 29, 394-402 (2001).
- Grefte, S., Kuijpers-Jagtman, A. M., Torensma, R., Von den Hoff, J. W. Skeletal muscle fibrosis: the effect of stromal-derived factor-1α-loaded collagen scaffolds. Regenerative Medicine. 5, 737-747 (2010).
- Jackson, W. M., Nesti, L. J., Tuan, R. S. Potential therapeutic applications of muscle-derived mesenchymal stem and progenitor cells. Expert Opinion on Biological Therapy. 10, 505-517 (2010).
- Sato, K., et al. Improvement of muscle healing through enhancement of muscle regeneration and prevention of fibrosis. Muscle, & Nerve. 28, 365-372 (2003).
- Tatsumi, R., Anderson, J. E., Nevoret, C. J., Halevy, O., Allen, R. E. HGF/SF is present in normal adult skeletal muscle and is capable of activating satellite cells. Developmental Biology. 194, 114-128 (1998).
- Stuelsatz, P., et al. Extraocular muscle satellite cells are high performance myo-engines retaining efficient regenerative capacity in dystrophin deficiency. Developmental biology. , (2014).
- Ono, Y., Boldrin, L., Knopp, P., Morgan, J. E., Zammit, P. S. Muscle satellite cells are a functionally heterogeneous population in both somite-derived and branchiomeric muscles. Developmental Biology. 337, 29-41 (2010).
- Pavlath, G. K., et al. Heterogeneity among muscle precursor cells in adult skeletal muscles with differing regenerative capacities. Developmental Dynamics. 212, 495-508 (1998).
- Koo, S. H., Cunningham, M. C., Arabshahi, B., Gruss, J. S., Grant, J. H. 3rd The transforming growth factor-beta 3 knock-out mouse: an animal model for cleft palate. Plastic and Reconstructive Surgery. 108, 938-948 (2001).
- Fara, M., Brousilova, M. Experiences with early closure of velum and later closure of hard palate. Plastic and Reconstructive Surgery. 44, 134-141 (1969).
- Lindman, R., Paulin, G., Stal, P. S. Morphological characterization of the levator veli palatini muscle in children born with cleft palates. The Cleft Palate-Craniofacial Journal. 38, 438-448 (2001).
- Hanes, M. C., et al. Contractile properties of single permeabilized muscle fibers from congenital cleft palates and normal palates of Spanish goats. Plastic and Reconstructive Surgery. 119, 1685-1694 (2007).
- Rader, E. P., et al. Contraction-induced injury to single permeabilized muscle fibers from normal and congenitally-clefted goat palates. The Cleft Palate-Craniofacial Journal. 44, 216-222 (2007).
- Rader, E. P., et al. Effect of cleft palate repair on the susceptibility to contraction-induced injury of single permeabilized muscle fibers from congenitally-clefted goat palates. The Cleft Palate-Craniofacial Journal. 45, 113-120 (2008).
- Macpherson, P. C., Dennis, R. G., Faulkner, J. A. Sarcomere dynamics and contraction-induced injury to maximally activated single muscle fibres from soleus muscles of rats. The Journal of Physiology. 500 (Pt 2), 523-533 (1997).
- Koch, K. H., Grzonka, M. A., Koch, J. The pathology of the velopharyngeal musculature in cleft palates). Annals of Anatomy. 181, 123-126 (1999).
- Fara, M., Dvorak, J. Abnormal anatomy of the muscles of palatopharyngeal closure in cleft palates: anatomical and surgical considerations based on the autopsies of 18 unoperated cleft palates. Plastic and Reconstructive Surgery. 46, 488-497 (1970).
- Carvajal Monroy, P. L., Grefte, S., Kuijpers-Jagtman, A. M., Wagener, F. A., Von den Hoff, J. W. Strategies to Improve Regeneration of the Soft Palate Muscles After Cleft Palate Repair. Tissue Engineering. Part B, Reviews. , (2012).
- Grefte, S., Kuijpers, M. A., Kuijpers-Jagtman, A. M., Torensma, R., Von den Hoff, J. W. Myogenic capacity of muscle progenitor cells from head and limb muscles. European Journal of Oral Sciences. 120, 38-45 (2012).
- Grefte, S., Vullinghs, S., Kuijpers-Jagtman, A. M., Torensma, R., Von den Hoff, J. W. Matrigel but not collagen I, maintains the differentiation capacity of muscle derived cells in vitro. Biomedical Materials. 7, 055004 (2012).
- Kastner, S., Elias, M. C., Rivera, A. J., Yablonka-Reuveni, Z. Gene expression patterns of the fibroblast growth factors and their receptors during myogenesis of rat satellite cells. The Journal of Histochemistry and Cytochemistry. 48, 1079-1096 (2000).
- Yablonka-Reuveni, Z., Quinn, L. S., Nameroff, M. Isolation and clonal analysis of satellite cells from chicken pectoralis muscle. Developmental Biology. 119, 252-259 (1987).
- Sherwood, R. I., et al. Isolation of adult mouse myogenic progenitors: functional heterogeneity of cells within and engrafting skeletal muscle. Cell. 119, 543-554 (2004).
- Gilbert, P. M., et al. Substrate elasticity regulates skeletal muscle stem cell self-renewal in culture. Science. 329, 1078-1081 (2010).
- Motohashi, N., Asakura, Y., Asakura, A. Isolation culture, and transplantation of muscle satellite cells. Journal of Visualized Experiments. , (2014).
- Sciote, J. J., Horton, M. J., Rowlerson, A. M., Link, J. Specialized cranial muscles: how different are they from limb and abdominal muscles. Cells, Tissues, Organs. 174, 73-86 (2003).
- Rowlerson, A., Mascarello, F., Veggetti, A., Carpene, E. The fibre-type composition of the first branchial arch muscles in Carnivora and Primates. Journal of Muscle Research and Cell Motility. 4, 443-472 (1983).
- Muller, J., et al. Comparative evolution of muscular dystrophy in diaphragm, gastrocnemius and masseter muscles from old male mdx mice. Journal of Muscle Research and Cell Motility. 22, 133-139 (2001).
- Feldman, J. L., Stockdale, F. E. Skeletal muscle satellite cell diversity: satellite cells form fibers of different types in cell culture. Developmental Biology. 143, 320-334 (1991).
- Schmalbruch, H., Hellhammer, U. The number of nuclei in adult rat muscles with special reference to satellite cells. The Anatomical Record. 189, 169-175 (1977).
- Gibson, M. C., Schultz, E. The distribution of satellite cells and their relationship to specific fiber types in soleus and extensor digitorum longus muscles. The Anatomical Record. 202, 329-337 (1982).
- Carvajal Monroy, P. L., et al. A rat model for muscle regeneration in the soft palate. PloS One. 8, e59193 (2013).
Erratum
Formal Correction: Erratum: Isolation and Characterization of Satellite Cells from Rat Head Branchiomeric Muscles
Posted by JoVE Editors on 10/01/2015.
Citeable Link.
An erratum was issue for Isolation and Characterization of Satellite Cells from Rat Head Branchiomeric Muscles. The fourth figure was updated to explain the isolation of the LVP better.
Steps 2.5.3 and 2.5.4 were updated from:
2.5.3. Look for the trachea and the esophagus that runs behind it. Lift the esophagus, and expose the pharynx, larynx and the soft palate.
2.5.4. Localize the area of the soft palate where the levator veli palatini is inserted and cut it loose (Figure 4B).
to
2.5.3. Look for the trachea and the esophagus that runs behind it. Lift the esophagus, and expose the pharynx and the larynx.
2.5.4 Localize and dissect the area of the superior pharyngeal constrictor muscle. Identify the levator veli palatini and cut it at both sides (Figure 4B).
Figure 4 and its legend were updated from:
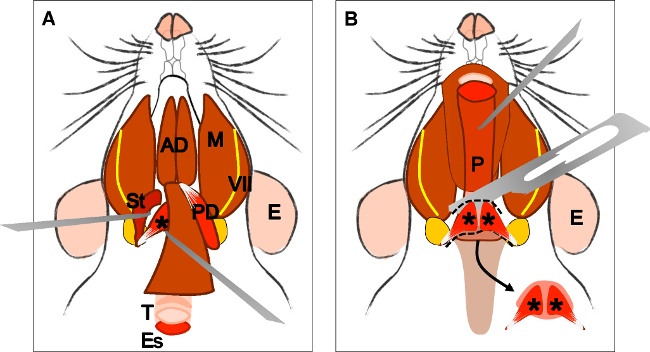
Figure 4: Dissection of the levator veli palatini muscle. (A) General view after dissection of the digastric muscle (posterior belly). Stylohyoid muscle (St) and tendon of the levator veli palatini can be localized. Note the trachea (T) and esophagus (Es) running behind it. (B) After lifting the trachea and the esophagus the pharynx (P) is exposed. The insertion of the levator veli palatini into the soft palate is now visible. The arrow indicates the dissected soft palate with the levator veli palatini muscles at both sides. E: ear, St: stylohyoid muscle, VII: facial nerve, M: masseter muscle, AD: anterior belly digastric muscle, PD: posterior belly digastric muscle, T: trachea, Es: esophagus, P: Pharynx, *levator veli palatini muscle.
to
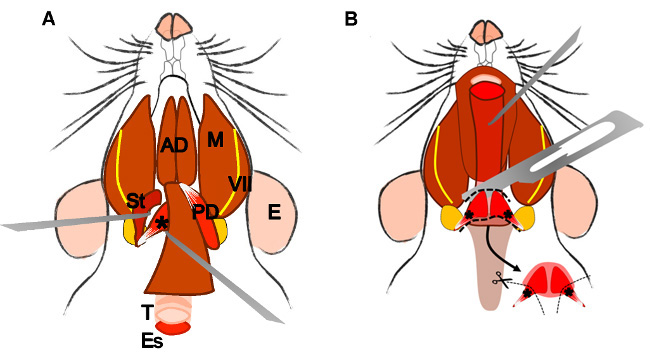
Figure 4: Dissection of the levator veli palatini muscle. (A) General view after dissection of the digastric muscle (posterior belly). Stylohyoid muscle (St) and tendon of the levator veli palatini can be localized. Note the trachea (T) and esophagus (Es) running behind it. (B) After lifting the trachea and the esophagus the pharynx (P) is exposed. The levator veli palatini that runs laterally towards the soft palate is now visible. The arrow indicates the dissected superior pharyngeal constrictor muscle; note the levator veli palatini muscles at both sides. E: ear, St: stylohyoid muscle, VII: facial nerve, M: masseter muscle, AD: anterior belly digastric muscle, PD: posterior belly digastric muscle, T: trachea, Es: esophagus, P: Pharynx, *levator veli palatini muscle.



