ERRATUM NOTICE
Important: There has been an erratum issued for this article. Read more …
Summary
Este protocolo describe el aislamiento de las células satélite de músculos de la cabeza branchiomeric de una rata 9 semanas de edad. Los músculos se originan a partir de diferentes arcos branquiales. Posteriormente, las células satélite son cultivadas en un recubrimiento de punto de tamaño de milímetro para estudiar su diferenciación. Este enfoque evita la expansión y pases de las células satélite.
Introduction
Acerca de 1: 500 a 1: 1.000 recién nacidos presentan una hendidura que implica el labio y / o paladar (CLP); por lo tanto esta es la malformación congénita más común en los seres humanos 1. Los músculos del paladar blando son fundamentales para el funcionamiento del paladar blando durante el habla, la deglución y la succión. Si una hendidura del paladar blando está presente, estos músculos se insertan anormalmente en el extremo posterior del hueso palatal.
El paladar blando se mueve hacia arriba y hacia abajo durante el discurso, evitando que escape el aire por la nariz. Los niños con una hendidura en el paladar no tienen esta función de control que resulta en un fenómeno conocido como la disfunción velofaríngea 2,3. Aunque los protocolos de tratamiento son variables, la reparación quirúrgica del paladar blando se lleva a cabo en la primera infancia (6-36 meses de edad) 4. Los músculos anormalmente insertadas del paladar blando pueden ser corregidas quirúrgicamente 5-7, sin embargo, la disfunción velofaríngea persiste en 7% a 30%de los pacientes 2,3,8-10.
La capacidad del músculo esquelético para regenerar a través de la acción de las células satélite (SCS) está bien establecida 11,12. A su lesión muscular, SC se activan y migran al sitio de la lesión. A continuación, proliferan, se diferencian y se fusionan para formar nuevas fibras musculares o reparación dañado los 13. Quiescentes SC expresan el factor de transcripción Pax7 14,15, mientras que su progenie, los mioblastos proliferantes, expresa, además, el factor de determinación miogénica 1 (MyoD) 16. Mioblastos diferenciadores comienzan a expresar miogenina (MyoG) 17. La diferenciación terminal de los mioblastos se caracteriza por la formación de miofibras, y la expresión de proteínas de músculos específicos tales como la cadena pesada de la miosina (MyHC) 16,18.
Recientemente, varias estrategias se han utilizado en la medicina regenerativa para mejorar la regeneración del músculo de los músculos de las extremidades 19-23. Estudios específicos sobremúsculos de la cabeza branchiomeric también son importantes, ya que se demostró recientemente que se diferencian de los otros músculos en varios aspectos 24. En contraste con los músculos de las extremidades, se ha sugerido que los músculos de la cabeza branchiomeric contienen menos SCs 25, se regeneran más lento, y el tejido conectivo más fibrosa se forma después de la lesión 26 Además, la proliferación de las SC de músculos de la cabeza branchiomeric también expresar otros factores de transcripción. Por ejemplo, Tcf21, un factor de transcripción para la formación muscular craneofacial se expresa fuertemente en la regeneración de los músculos de la cabeza, pero apenas en la regeneración de los músculos de las extremidades 25. Los músculos del paladar blando de los pacientes CLP son generalmente más pequeños y menos bien organizado en comparación con los músculos palatinos normales 27,28. Fibras lentas y rápidas están presentes en los músculos del paladar blando, pero las fibras lentas son más abundantes. En contraste, los músculos hendido contienen una mayor proporción de fibras rápidas y también un suministro capilar reducidoen comparación con los músculos del paladar blando normales 29-31. Fibras rápidas son más propensos a las lesiones inducidas por la contracción-31-33. La mala alimentación capilar acompaña también puede promover la fibrosis 34,35. Todos estos aspectos pueden contribuir a la mala regeneración de los músculos del paladar blando después del cierre leporino quirúrgica 36. En vista de esto, un protocolo para el aislamiento y caracterización de músculo cabeza branchiomeric SCS es crucial. Esto ofrece la posibilidad de estudiar SC biología de músculos de la cabeza branchiomeric. Además, las nuevas terapias basadas en la ingeniería de tejidos se pueden desarrollar para promover la regeneración muscular después de la cirugía en CLP y otras condiciones que comprometen la zona craneofacial.
En general, SCs se pueden obtener después de la disociación del tejido muscular 14. Picado, digestión enzimática, y trituración en general están obligados a liberar las SC de su nicho. SCs se puede purificar por pre-chapado en los platos sin revestir 14,37,38, fractionation en Percoll 39,40, célula o fluorescent- o magnético de clasificación 41-43. Aquí presentamos un nuevo protocolo económico y rápido para el aislamiento de las células satélite de músculos de la cabeza branchiomeric de ratas adultas jóvenes. Este protocolo se basa en un manuscrito anterior 14 y adaptado específicamente para las pequeñas muestras de tejido. El aislamiento de los comités permanentes de los músculos representativas procedentes de la 1 °, 2 ° y 4 arcos branquiales th se describen. Después del aislamiento, bajo número de células satélite se cultivan en los puntos de gel de matriz extracelular de tamaño milímetro para estudiar su diferenciación. Este enfoque evita la necesidad de la ampliación y los pases de los SC.
Protocol
Todos los experimentos descritos en este documento fueron aprobados por la Junta local de Experimentación Animal de la Universidad de Radboud Nijmegen, en conformidad con las leyes y reglamentos (RU-diciembre 2013 a 205) Holandés.
1. Manchas Gel Matrix extracelular
- Realice los siguientes pasos un día antes del aislamiento:
- Descongelar una alícuota de gel de matriz extracelular (100 l) a 4 ° C durante al menos 1,5 h. Diluir 1:10 en medio de Eagle modificado por Dulbecco; con 4,500 mg / L de glucosa, 4 mM L-glutamina, y 110 mg / ml de piruvato de sodio (DMEM). Mantener el gel de la matriz extracelular a 4 ° C en todo momento. Nota: Los cambios de temperatura bruscos resultarán en recubrimiento desigual y la formación de cristales.
- Mantenga la solución de gel matriz extracelular diluido en hielo durante 15 min.
- Pre-enfriar una micropipeta 20 l durante 10 minutos.
- Ponga portaobjetos de cámara de 8 pocillos en una placa de Petri de 100 mm y transferir el plato sobre una superficie fría (por ejemplo, un acumulador de frío) durante 10 min.
- Utilice la micropipeta pre-enfriado para poner una gota de 10 l de gel de matriz extracelular en cada pocillo. Mantenga la placa de Petri en la superficie fría durante al menos otros 7 min (Figura 1).
- Eliminar completamente el gel matriz extracelular restante (Figura 1B), y secar los pozos a 37 ° C durante la noche.
2. La disección de la cabeza Músculos (maseteros, digástrico y elevador velo del paladar)
- Antes de la disección, preparar 50 ml de solución salina tamponada con fosfato (PBS) suplementado con 2% de penicilina-estreptomicina (P / S). Mantenga en hielo.
- Después de la eutanasia de una rata adulta joven (9 semanas) con CO 2 / O 2, decapitar la cabeza y quitar la piel de la cabeza. Transferir la cabeza para helado de PBS suplementado con 2% P / S en un tubo de 50 ml.
- Músculo masetero (derivado de la primera arco branquial)
- Coloque la cabeza con un lado en una almohadilla de silicona y fijar con hipodérmica needles (Figura 2A).
- Identificar la glándula parótida y el nervio facial (Figura 2A). Exponer la fascia profunda que cubre la glándula. Cortar la fascia y extirpar la glándula con unas tijeras de disección. Identificar el conducto auditivo externo. Trace el nervio facial desde el agujero estilomastoideo y retirar con cuidado las ramas temporales, cigomáticos, y bucales con una hoja de bisturí No. 15.
- Liberar la cabeza superficial del músculo masetero quitando la fascia. Identificar cabezas tanto superficial y profunda del músculo masetero. Seguir la pista a la cabeza superficial hasta su gruesa aponeurosis tendinosa insertada en el proceso cigomático del maxilar.
- Separar el tendón desde su origen en el proceso cigomático con unas pinzas rectas. Cortar con una hoja de bisturí No. 15 o tijeras de disección y cuidadosamente la vida (Figura 2B).
- Disecar la cabeza superficial del masetero hasta su inserción en el ángulo y la mitad inferior de la tél lateral superficie de la rama de la mandíbula con una hoja de bisturí No. 15 (Figura 2C). Ahora, eliminar completamente el músculo.
- Vientre posterior del músculo digástrico (derivado del arco branquial 2º)
- Coloque la cabeza en una posición supina sobre la almohadilla de silicona y fijar con agujas hipodérmicas (Figura 3A).
- Retire la grasa subcutánea que recubre tanto sublingual y glándulas submandibulares. A continuación, retire la fascia superficial y glándulas utilizando tijeras de disección. Exponer el músculo digástrico (anterior y vientre posterior).
- Sostenga el tendón anterior del vientre posterior con unas pinzas rectas, cortar y diseccionar cuidadosamente hasta su origen en la bulla timpánica (Figura 3B). Haga lo mismo en el lado contralateral.
- Músculo elevador del velo palatino (derivado del arco branquial cuarto)
- Después de la disección del vientre posterior del músculo digástrico, Localizar el músculo estilohioideo, tire de él lateralmente, y retire con cuidado (Figura 4A).
- Localizar el tendón del músculo elevador del velo palatino que se inserta en la bulla timpánica (Figura 4A). Diseccionar cuidadosamente y cortarla en ambos lados.
- Busque la tráquea y el esófago que corre detrás de él. Levante el esófago, y exponer la faringe, la laringe y el paladar blando.
- Localizar la zona del paladar blando donde se inserta el músculo elevador del velo palatino y cortar suelto (Figura 4B).
Nota: Directamente después de la disección, retire con cuidado los tendones y tejido conectivo de cada músculo bajo el microscopio estereoscópico. Sumergir todas las muestras rápidamente en etanol al 70%, y transferirlos a PBS enfriado con hielo suplementado 2% P / S en un tubo de 15 ml.
3. Aislamiento de las células satélite
- Lleve a cabo los siguientes pasos de preparación para SC aislamiento de 3 grupos de músculos:
- Preparar 7,5 ml de 0,1% de pronasa en DMEM. Se filtra la solución a través de un filtro de 0,22 micras. Pre-calentar la solución a 37 ° C en un baño de agua durante 10 min antes del aislamiento.
- Preparar 35 ml de DMEM suplementado con 10% de suero de caballo (HS) y 1% P / S. También pre-caliente a 37 ° C en un baño de agua.
- Preparar 15 ml de medio de cultivo que consta de DMEM suplementado con suero bovino fetal al 20% (FBS), 10% HS, 1% P / S y 1% de extracto de embrión de pollo (CEE). Pre-caliente a 37 ° C en un baño de agua.
- Pre-coat seis pipetas de plástico (10 ml) con HS y seco durante al menos 10 minutos antes de su uso.
- En la campana de cultivo, transferir cada músculo en un pocillo de una placa de 6 pocillos. Usando las tijeras de disección, corte el músculo en pequeños trozos de unos 2 mm. Tenga cuidado de no picar el tejido demasiado.
- Añadir con cuidado 2,5 ml de solución de pronasa 0,1% a cada pocillo e incubar a 37 ° C durante 60 min. Agite suavemente la placa después de 20, 40 y 60 min. Nota: El duratio exactan de la incubación depende de factores como la edad y la tensión de los animales.
- Monitorear bajo el microscopio. Compruebe los fragmentos musculares y detener la digestión enzimática cuando los haces de fibras consiguen una apariencia aflojado (Figura 5).
- Añadir 2,5 ml de DMEM suplementado con 10% HS y 1% P / S. Transferir a un tubo de 15 ml y centrifugar los tubos a 400 xg durante 5 min. Eliminar el sobrenadante por decantación.
- Añadir 5 ml de DMEM suplementado con 10% HS y 1% P / S. Pipetear la solución hacia arriba y abajo con una pipeta de 10 ml de plástico (trituración) durante al menos 20 veces para homogeneizar el tejido.
- Centrifugar los tubos a 200 g durante 4 min. Recoger el sobrenadante y transferir a un tubo de 15 ml.
- Añadir 5 ml de DMEM suplementado con 10% HS y 1% P / S. Pipeta de nuevo con una pipeta de plástico de 10 ml hasta que los fragmentos de tejido pasa fácilmente a través de la pipeta.
- Centrifugar los tubos a 200 xg durante 4 min y recoger el sobrenadante en un tubo de 15 ml.
- Put un filtro de células (40 micras) en un tubo de 50 ml y transferir el sobrenadante que contiene las células disociadas en el filtro. Lavar con 1 ml de DMEM para la recuperación celular máxima.
- Centrifugar los tubos a 1.000 xg durante 10 min y descartar el sobrenadante con una pipeta.
- Resuspender el precipitado en 300 l de medio de cultivo y contar las células en un hemocitómetro.
4. La diferenciación de las células satélite en Spots matriz de gel extracelular
- Diluir la suspensión de células para obtener 1,5 x 10 3 células en 10 l de medio de cultivo.
- Asegure las tapas de las cámaras de diapositivas con cinta y marcar los puntos con un marcador negro en la parte inferior del vidrio objeto.
- Usando una micropipeta, poner una gota de suspensión celular 10 l en el punto de gel matriz extracelular. Compruebe bajo el microscopio si la gota de suspensión celular se ha colocado correctamente en el lugar. Incubar durante seis horas a 37 ° C.
- CuidadosoLy Agregar 400 l de medio de cultivo (DMEM suplementado con 20% FBS, 10% HS, 1% P / S y 1% CEE) y se incuba durante tres días a 37 ° C.
Nota: En este punto, recién aisladas SC se somete a un trauma masivo (digestión enzimática y duro trituración) y que necesitan para recuperarse. No molestar las células durante los tres primeros días 37. A continuación, el medio de cultivo se puede cambiar dependiendo del tipo de experimento.
Las manchas de gel de la matriz extracelular pueden ser sembradas con una densidad celular alta (1.5 hasta 2.5 x 10 3/20 l) para el ensayo de diferenciación. El medio de cultivo (DMEM suplementado con 20% FBS, 10% HS, 1% P / S y 1% de extracto de embrión de pollo) se puede sustituir cada tercer día. - Alternativamente, si se desea una ampliación y pasar siga los siguientes pasos:
- Descongelar una alícuota de gel de matriz extracelular (500 l) a 4 ° C durante al menos 1,5 h. Diluir 1:10 en DMEM y siga las recomendaciones en el punto 1.1.1.
- Pre-enfriar una pipeta de 10 ml durante 10 min a 4 y# 176; C.
- Transferencia tres matraces T75 sobre una superficie fría (por ejemplo, un acumulador de frío) durante 10 min.
- Utilice la pipeta previamente enfriado a poner 1 ml de gel de matriz extracelular en cada frasco. Compruebe que la superficie está cubierta por completo. Mantenga los frascos en la superficie fría durante al menos otros 7 min (Figura 1).
- Eliminar completamente el gel matriz extracelular restante con una pipeta de 10 ml, y secar los pozos a 37 ° C durante 1 hora.
- Después de contar, resuspender las SCs recién aisladas en 10 ml de medio de cultivo (DMEM suplementado con 20% FBS, 10% HS, 1% P / S y 1% de extracto de embrión de pollo) y de semillas en los matraces T75 pre-revestido.
- Después de tres días, cambiar el medio (y cada tercer día) hasta 80% de confluencia se alcanza. Para los pases, lavar los frascos T75 tres veces con PBS. A continuación, agregue 1 ml de 0,25% de solución de tripsina y se incuba durante tres minutos a 37 ° C. Resuspender en 9 ml de medio de cultivo (DMEM suplementado con 20% FBS, 10% HS, 1% P / Sy 1% de extracto de embrión de pollo) y centrifugar a 200 xg durante 5 min. Eliminar el sobrenadante. Después de contar, resuspender 1 x 10 6 células en 1000 l de medio de cultivo y la congelación de las células.
Representative Results
El uso de este protocolo, el músculo masetero (un lado) rinde 0,8-1 x 10 6 células, el músculo digástrico (vientre posterior) rinde 1,5-2 x 10 5 células, y los rendimientos del músculo elevador del velo palatino 1-1,5 x 10 5 células. Los rendimientos celulares dependen del tipo muscular, tensión, y la edad del animal. Para la comparación entre los tres grupos de músculos, SCS recién aisladas se sembraron a la misma densidad celular (1,5 x 10 3/10 l). Directamente después del aislamiento, más de 90% de las células recién aisladas expresar Pax7 (Figura 6).
Día 4, 7 y 10 culturas fueron teñidas con anticuerpos contra Pax7, MyoD, MyoG y MyHC inmunotinción. Cinco campos arbitrarios fueron contados por cultivo usando un objetivo 20X. Al día 4 Pax 7 y Myo D se expresa en todos los grupos musculares (Figuras 6 y 7 y 8), sin embargo la progenie de SatCs del masetero y los músculos digástrico comienzan exprescantar miogenina antes que el velo del elevador palatino muscular (Figura 9). En el día 10, la expresión de MyoG está fuertemente reducido en todos los grupos (Figura 9). Pocos días después de la siembra en los puntos de gel de matriz extracelular, las células proliferantes comienzan a fusionarse y formar miotubos multi-nucleadas, que expresan la cadena pesada de la miosina. Miotubos pequeños son claramente visibles en el día 7 (Figura 10). En el día 10, espasmos de los miotubos se puede observar (Video 1).

Figura 1:. Manchas de gel de matriz extracelular en un portaobjetos de cámara (A) para una fácil manipulación, coloque la diapositiva cámara de 8 pocillos en una placa de Petri de 100 mm. Pipetear 10 l de gel de matriz extracelular en cada cámara y lo puso en una superficie fría (7 min). (B) de diapositivas Cámara después del exceso de matriz extracelular gse elimina el.

Figura 2:. La disección del músculo masetero (A) Cabeza del animal en una vista lateral. Oído (E), la glándula parótida (P) y el nervio facial (VII). (B) tendinosa aponeurosis (Te) de la cabeza superficial del músculo masetero (Ms) y el músculo temporal (T). Separar el tendón de su inserción con un fórceps. (C) diseccionar cuidadosamente el músculo hasta su inserción en la rama de la mandíbula. E: oído, P: glándula parótida, VII: nervio facial, T: músculo temporal, Ms: cabeza superficial del músculo masetero, Te: tendón, Mp: profunda cabeza del músculo masetero.

Figura 3: Disección del vientre posterior del músculo digástrico (.A) Jefe del animal en posición supina. Localizar la glándula submandibular (Mx), músculo masetero (M), el nervio facial (VII) y el músculo esternocleidomastoideo (ECM). Retire la glándula submandibular. (B) Localizar la parte anterior del músculo digástrico (AD) y vientre posterior (PD). Con unas pinzas rectas, tome el tendón anterior del vientre posterior, cortar y diseccionar cuidadosamente hasta su origen en la bulla timpánica (ty). E: oído, Sg: glándula submandibular, VII: nervio facial, M: músculo masetero, SMC: músculo esternocleidomastoideo, AD: músculo digástrico vientre anterior, PD: músculo digástrico vientre posterior, Ty: bulla timpánica.

Figura 4:. La disección del músculo elevador del velo palatino (A) Vista general después de la disección del músculo digástrico (vientre posterior). Músculo estilohioideo (St) y el tendón del músculo elevadorvelo palatino puede ser localizada. Nota la tráquea (T) y el esófago (Es) que se ejecuta detrás de él. (B) Después de levantar la tráquea y el esófago de la faringe (P) está expuesta. La inserción del músculo elevador del velo palatino en el paladar blando es ahora visible. La flecha indica el paladar blando diseccionado con los músculos del velo palatino elevador en ambos lados. E: oído, St: músculo estilohioideo, VII: nervio facial, M: músculo masetero, AD: músculo digástrico vientre anterior, PD: músculo digástrico vientre posterior, T: tráquea, Es: esófago, P: faringe, * músculo elevador del velo palatino .

Figura 5: Aspecto del tejido muscular (A) antes y (B) después de la digestión enzimática con pronasa. Tenga en cuenta que haces musculares parecen estar aflojado después de la digestión enzimática.
Figura 6: Pax 7 inmunotinción SCs recién aislados, aplicadas a gel de matriz extracelular en el extremo de aislamiento (aproximadamente 6 horas después de la digestión inicial del tejido).. Cinco campos arbitrarios se contaron usando un objetivo de 10X con un promedio de 210 células por campo. Aproximadamente el 90% de las células son Pax 7 positiva. DAPI: azul, Pax7: rojo. Barra de escala, 100 micras.

Figura 7:. Pax 7, MyoD inmunotinción Día 4, 7 y 10 cultivos se tiñeron con anticuerpos contra Pax7, y la inmunotinción MyoD. (A - C) y (D - F) fotomicrografías representativas de días 4 y 7 culturas del músculo masetero. (G y H + y + MyoD núcleos por campo microscópico se contó y se expresó como un porcentaje del número total de núcleos (DAPI). DAPI: azul, Pax7: rojo, y MyoD: verde. Escalas bar, 100 micras. Haga clic aquí para ver una versión más grande de esta figura.

Figura 8:. Distribución de Pax7 ± / ± MyoD en cultivos de células mononucleadas en cultivos de músculo masetero palatina, digástrico y del velo del elevador (A - C) Día 4, 7 y 10 culturas fueron teñidas con anticuerpos contra Pax7 y inmunotinción MyoD. El número total de células se basa en el número de total de núcleos (DAPI). (D) la cuantificación de datos de Pax7 ± / MyoD ± cells. Haga clic aquí para ver una versión más grande de esta figura.

Figura 9:. Inmunotinción miogenina Día 4, 7 y 10 cultivos se tiñeron con anticuerpos contra miogenina. (A - D) microfotografías representativas de días 4 y 7 de las culturas del músculo elevador del velo palatino. (E) El número de MyoG + núcleos por campo microscópico se contó y se expresó como un porcentaje del número total de núcleos (DAPI). Cuantificación (F) Los datos de las células MyoG +. DAPI: azul, miogenina: verde. Escalas bar, 100 micras. Haga clic aquí para ver una versión más grande de esta figure.

Figura 10:. Miosina pesada cadena inmunotinción Día 4, 7 y 10 culturas fueron teñidas con anticuerpos contra la cadena pesada de la miosina (MyHC). Microfotografías representativas de días 4, 7 y 10 culturas de la (DIG) músculo digástrico. En el día 7, pequeñas miotubos están presentes, mientras que al día 10 miotubos largas y bien organizados son evidentes. Escalas bar, 200 micras. Haga clic aquí para ver una versión más grande de esta figura.
Video 1:.. Myotube crispar ejemplos de dos campos representativos con miotubos espasmos se muestran para el día 10 culturas de músculo digástrico Por favor haga clic aquí para ver el vídeo.
Discussion
SCs de diferentes músculos de la cabeza branchiomeric fueron aisladas de uno de 9 semanas de edad, de rata Wistar y se cultivaron directamente en puntos de gel de matriz extracelular sin expansión previa y pases. Después del aislamiento, las células se contaron y se sembraron a la misma densidad celular. Para el aislamiento paralelo de tres músculos diferentes, este método tarda aproximadamente 4 hr. Para evitar la contaminación cultura, un paso crítico es el lavado rápido de alcohol al 70% después de la disección de los músculos.
Durante el aislamiento SC es importante para cortar el tejido muscular en trozos pequeños (alrededor de 2 mm), pero evitar demasiado picado como esto se traducirá en un pequeño rendimiento celular debido a daño celular. Además, la duración de la digestión enzimática se debe comprobar cuidadosamente bajo el microscopio para evitar daños mayores. El objetivo de la digestión es para disociar las miofibras. Desde hace más de 90% de las células aisladas expresar Pax7, no se requiere purificación adicional (Figuras 6-8).Esto evita etapas de purificación adicionales en otros métodos tales como pre-chapado en los platos sin revestir 14,37,38, fraccionamiento en Percoll 39,40, célula o fluorescent- o magnético clasificación 41,43. Para la trituración es esencial para inducir cizallamiento entre los fragmentos de tejido y la abertura de la punta de la pipeta ya que esto permite la liberación mecánica de la SC. Si la trituración con una pipeta de 10 ml (dentro punta Diámetro: 1 mm) es difícil, unos 5 ml (dentro de la punta de diámetro: 2 mm) de la pipeta se pueden utilizar por primera vez. Alternativamente, pipetas Pasteur de vidrio se pueden cortar en el diámetro deseado y ser usado. Este método es simple, eficiente y permite el aislamiento simultáneo de SC de diferentes muestras de músculo.
Las placas de cultivo para SCs también se pueden recubrir con gelatina o colágeno, pero nuestros estudios anteriores muestran que el gel de la matriz extracelular es mucho mejor para el mantenimiento del potencial miogénico que el colágeno 38. Las manchas de gel de matriz extracelular detamaño milímetro (10 l / Ø 2 mm o 20 l / Ø 4 mm) permite el estudio de la proliferación y diferenciación de las SC con un número limitado de células. Para el ensayo de diferenciación de aproximadamente 8 a 20 veces menos células son requeridos en comparación con una placa de 24 pocillos (Ø 15,6 mm), y aproximadamente 80 a 200 veces menos en comparación con 35 mm placas de Petri (Ø 35 mm) 14,38.
Desde gel de matriz extracelular es caro, este método también es más rentable. Además, los portaobjetos de cámara pueden ser reemplazados por cubierta de plástico se desliza para reducir aún más los costes. Para la preparación del gel de la matriz extracelular de spots de secado durante la noche de los portaobjetos de cámara es esencial. Como los puntos de gel de matriz extracelular son transparentes, es necesario marcar los puntos en la parte inferior con una luz frontal. Las cámaras de diapositivas se fijan en una placa de Petri para una fácil manipulación. La expansión del cultivo celular no es necesario, que ofrece la posibilidad de estudiar la SC de Smaller músculos o muestras de músculos pequeños. Alternativamente, por ejemplo, para la PCR o músculo construye si se necesitan más células, las castas recién aisladas primero se pueden expandir en frascos T75 como se indicó anteriormente.
SC aislado utilizando este protocolo no son adecuados para la purificación adicional con citometría de flujo inmediatamente después de aislamiento. La digestión con pronasa provoca extensa digestión de la superficie de antígenos de 14. Suero de caballo y suero fetal bovino que se utilizan para el cultivo de células primero deben caracterizarse adecuadamente antes del aislamiento, como diferentes números de lote afectados diferencialmente la proliferación y diferenciación de mioblastos.
En los últimos años, hay un interés creciente en los músculos derivados de los arcos branquiales y el mesodermo cabeza (por ejemplo, los músculos extraoculares) 24. Se ha demostrado claramente que los músculos de la cabeza y las extremidades poseen muy diferentes propiedades. Masetero músculo de animales viejos parece volverner su capacidad regenerativa en comparación con los músculos de las extremidades 25,26. SC de los músculos extraoculares poseen una robusta capacidad de proliferación y diferenciación comparable a las SC de músculos de la cabeza, y muestran un potencial mayor que el injerto extremidad muscular SC 24.
La composición de la distribución del tipo de fibra y la miosina varía entre los grupos musculares y también entre especies. Los músculos se originan en el primer arco branquial en los seres humanos contienen fibras tanto lento y rápido (subtipos IIA y IIX), myosins neonatales y myosins típicos para desarrollar músculo cardíaco. En roedores estos músculos contienen aproximadamente 95% IIA fibras rápidas miosina y IIb) 44-46. Los estudios sobre los músculos aviar muestran que SCs de tipos de fibras musculares diferente varían en la capacidad de diferenciación. SC de fibras rápidas sólo se diferencian en las fibras musculares rápidas, mientras que los comités permanentes de fibras lentas pueden diferenciarse en dos tipos de fibras 47. Además, el porcentaje de SCs en el músculo rápidofibras es menor que en las fibras musculares lentas 48,49. Esto indica que la distribución del tipo de fibra se debe tener en cuenta para los estudios sobre los músculos en la zona craneofacial. Al igual que los músculos del paladar hendido, la LVP en roedores contiene casi exclusivamente fibras rápidas 50. Por esa razón, las SC de la LVP son adecuados para los estudios pre-clínicos en el campo de la fisura palatina.
Este protocolo ofrece nuevas posibilidades para estudiar las SC derivadas de músculos de la cabeza branchiomeric u otros músculos más pequeños o muestras de los músculos más pequeños. Esto facilitará el desarrollo de nuevas terapias para mejorar la regeneración de los músculos en el área maxilofacial en condiciones tales como paladar hendido, sino también en otras condiciones que afectan a los músculos más pequeños.
Materials
| Name | Company | Catalog Number | Comments |
| Hypodermic Needle 25 G 0.5 x 25 m | BD Microlance | 300400 | |
| Dissecting scissors | Braun | BC154R | |
| Micro forceps straight | Braun | BD330R | |
| Surgical Scalpel Blade No. 15 | Swann-Morton | 0205 | |
| Alcohol 70% | Denteck | 2,010,005 | |
| Permanox Slide, 8 Chamber | Thermo Scientific | 177445 | |
| 6 well cell culture plate | Greiner bio-one | 657160 | |
| Cell Culture Dishes (100 x 20 mm) | Greiner bio-one | 664160 | |
| 15 ml sterile conical centrifuge tube | BD Biosciences | 352097 | |
| 50 ml sterile conical centrifuge tube | BD Biosciences | 352098 | |
| Cell strainer (40 μm) | Gibco | 431750 | |
| 10 ml serological pipette | Greiner bio-one | 607180 | |
| 20 µl FT20 | Greiner bio-one | 774288 | |
| Matrigel, Phenol-Red Free | BD Biosciences | 356237 | 10 ml |
| Pronase | Calbiochem | 53702 | 10 KU |
| Phosphate Buffered Saline | Gibco | 14190-144 | 500 ml |
| Dulbecco's Modified Eagle Medium, high glucose, GlutaMAX Supplement, pyruvate | Gibco | 10569-010 | 500 ml |
| Fetal Bovine Serum | Fisher Scientific | 3600511 | 500 ml |
| Horse Serum | Gibco | 26050088 | 500 ml |
| Penicillin-Streptomycin (10,000 U/ml) | Gibco | 15140-122 | 100 ml |
| Chicken Embryo Extract | MP Biomedicals | 2850145 | 20 ml |
References
- Gritli-Linde, A. Molecular control of secondary palate development. Developmental Biology. 301, 309-326 (2007).
- Marrinan, E. M., LaBrie, R. A., Mulliken, J. B. Velopharyngeal function in nonsyndromic cleft palate: relevance of surgical technique, age at repair, and cleft type. The Cleft Palate-Craniofacial Journal. 35, 95-100 (1998).
- Morris, H. L. Velopharyngeal competence and primary cleft palate surgery, 1960-1971: a critical review. The Cleft Palate Journal. 10, 62-71 (1973).
- Mossey, P. A., Little, J., Munger, R. G., Dixon, M. J., Shaw, W. C. Cleft lip and palate. Lancet. 374, 1773-1785 (2009).
- Boorman, J. G., Sommerlad, B. C. Musculus uvulae and levator palati: their anatomical and functional relationship in velopharyngeal closure. British Journal of Plastic Surgery. 38, 333-338 (1985).
- Bae, Y. C., Kim, J. H., Lee, J., Hwang, S. M., Kim, S. S. Comparative study of the extent of palatal lengthening by different methods. Annals of Plastic Surgery. 48, 359-362 (2002).
- Braithwaite, F., Maurice, D. G. The importance of the levator palati muscle in cleft palate closure. British Journal of Plastic Surgery. 21, 60-62 (1968).
- Inman, D. S., Thomas, P., Hodgkinson, P. D., Reid, C. A. Oro-nasal fistula development and velopharyngeal insufficiency following primary cleft palate surgery--an audit of 148 children born between 1985 and 1997. British Journal of Plastic Surgery. 58, 1051-1054 (2005).
- Phua, Y. S., de Chalain, T. Incidence of oronasal fistulae and velopharyngeal insufficiency after cleft palate repair: an audit of 211 children born between 1990 and 2004. The Cleft Palate-Craniofacial Journal. 45, 172-178 (1990).
- Kirschner, R. E., et al. Cleft-palate repair by modified Furlow double-opposing Z-plasty: the Children's Hospital of Philadelphia experience. Plastic and Reconstructive Surgery. 104, 1998-2010 (1999).
- Mauro, A. Satellite cell of skeletal muscle fibers. The Journal of Biophysical and Biochemical Cytology. 9, 493-495 (1961).
- Yablonka-Reuveni, Z. The skeletal muscle satellite cell: still young and fascinating at 50. The Journal of Histochemistry and Cytochemistry. 59, 1041-1059 (2011).
- Ten Broek, R. W., Grefte, S., Von den Hoff, J. W. Regulatory factors and cell populations involved in skeletal muscle regeneration. Journal of Cellular Physiology. 224, 7-16 (2010).
- Danoviz, M. E., Yablonka-Reuveni, Z. Skeletal muscle satellite cells: background and methods for isolation and analysis in a primary culture system. Methods in Molecular Biology. 798, 21-52 (2012).
- Seale, P., et al. Pax7 is required for the specification of myogenic satellite cells. Cell. 102, 777-786 (2000).
- Yablonka-Reuveni, Z., et al. The transition from proliferation to differentiation is delayed in satellite cells from mice lacking MyoD. Developmental Biology. 210, 440-455 (1999).
- Zammit, P. S., Partridge, T. A., Yablonka-Reuveni, Z. The skeletal muscle satellite cell: the stem cell that came in from the cold. The Journal of Histochemistry And Cytochemistry. 54, 1177-1191 (2006).
- Andres, V., Walsh, K. Myogenin expression, cell cycle withdrawal, and phenotypic differentiation are temporally separable events that precede cell fusion upon myogenesis. The Journal of Cell Biology. 132, 657-666 (1996).
- Fukushima, K., et al. The use of an antifibrosis agent to improve muscle recovery after laceration. The American Journal of Sports Medicine. 29, 394-402 (2001).
- Grefte, S., Kuijpers-Jagtman, A. M., Torensma, R., Von den Hoff, J. W. Skeletal muscle fibrosis: the effect of stromal-derived factor-1α-loaded collagen scaffolds. Regenerative Medicine. 5, 737-747 (2010).
- Jackson, W. M., Nesti, L. J., Tuan, R. S. Potential therapeutic applications of muscle-derived mesenchymal stem and progenitor cells. Expert Opinion on Biological Therapy. 10, 505-517 (2010).
- Sato, K., et al. Improvement of muscle healing through enhancement of muscle regeneration and prevention of fibrosis. Muscle, & Nerve. 28, 365-372 (2003).
- Tatsumi, R., Anderson, J. E., Nevoret, C. J., Halevy, O., Allen, R. E. HGF/SF is present in normal adult skeletal muscle and is capable of activating satellite cells. Developmental Biology. 194, 114-128 (1998).
- Stuelsatz, P., et al. Extraocular muscle satellite cells are high performance myo-engines retaining efficient regenerative capacity in dystrophin deficiency. Developmental biology. , (2014).
- Ono, Y., Boldrin, L., Knopp, P., Morgan, J. E., Zammit, P. S. Muscle satellite cells are a functionally heterogeneous population in both somite-derived and branchiomeric muscles. Developmental Biology. 337, 29-41 (2010).
- Pavlath, G. K., et al. Heterogeneity among muscle precursor cells in adult skeletal muscles with differing regenerative capacities. Developmental Dynamics. 212, 495-508 (1998).
- Koo, S. H., Cunningham, M. C., Arabshahi, B., Gruss, J. S., Grant, J. H. 3rd The transforming growth factor-beta 3 knock-out mouse: an animal model for cleft palate. Plastic and Reconstructive Surgery. 108, 938-948 (2001).
- Fara, M., Brousilova, M. Experiences with early closure of velum and later closure of hard palate. Plastic and Reconstructive Surgery. 44, 134-141 (1969).
- Lindman, R., Paulin, G., Stal, P. S. Morphological characterization of the levator veli palatini muscle in children born with cleft palates. The Cleft Palate-Craniofacial Journal. 38, 438-448 (2001).
- Hanes, M. C., et al. Contractile properties of single permeabilized muscle fibers from congenital cleft palates and normal palates of Spanish goats. Plastic and Reconstructive Surgery. 119, 1685-1694 (2007).
- Rader, E. P., et al. Contraction-induced injury to single permeabilized muscle fibers from normal and congenitally-clefted goat palates. The Cleft Palate-Craniofacial Journal. 44, 216-222 (2007).
- Rader, E. P., et al. Effect of cleft palate repair on the susceptibility to contraction-induced injury of single permeabilized muscle fibers from congenitally-clefted goat palates. The Cleft Palate-Craniofacial Journal. 45, 113-120 (2008).
- Macpherson, P. C., Dennis, R. G., Faulkner, J. A. Sarcomere dynamics and contraction-induced injury to maximally activated single muscle fibres from soleus muscles of rats. The Journal of Physiology. 500 (Pt 2), 523-533 (1997).
- Koch, K. H., Grzonka, M. A., Koch, J. The pathology of the velopharyngeal musculature in cleft palates). Annals of Anatomy. 181, 123-126 (1999).
- Fara, M., Dvorak, J. Abnormal anatomy of the muscles of palatopharyngeal closure in cleft palates: anatomical and surgical considerations based on the autopsies of 18 unoperated cleft palates. Plastic and Reconstructive Surgery. 46, 488-497 (1970).
- Carvajal Monroy, P. L., Grefte, S., Kuijpers-Jagtman, A. M., Wagener, F. A., Von den Hoff, J. W. Strategies to Improve Regeneration of the Soft Palate Muscles After Cleft Palate Repair. Tissue Engineering. Part B, Reviews. , (2012).
- Grefte, S., Kuijpers, M. A., Kuijpers-Jagtman, A. M., Torensma, R., Von den Hoff, J. W. Myogenic capacity of muscle progenitor cells from head and limb muscles. European Journal of Oral Sciences. 120, 38-45 (2012).
- Grefte, S., Vullinghs, S., Kuijpers-Jagtman, A. M., Torensma, R., Von den Hoff, J. W. Matrigel but not collagen I, maintains the differentiation capacity of muscle derived cells in vitro. Biomedical Materials. 7, 055004 (2012).
- Kastner, S., Elias, M. C., Rivera, A. J., Yablonka-Reuveni, Z. Gene expression patterns of the fibroblast growth factors and their receptors during myogenesis of rat satellite cells. The Journal of Histochemistry and Cytochemistry. 48, 1079-1096 (2000).
- Yablonka-Reuveni, Z., Quinn, L. S., Nameroff, M. Isolation and clonal analysis of satellite cells from chicken pectoralis muscle. Developmental Biology. 119, 252-259 (1987).
- Sherwood, R. I., et al. Isolation of adult mouse myogenic progenitors: functional heterogeneity of cells within and engrafting skeletal muscle. Cell. 119, 543-554 (2004).
- Gilbert, P. M., et al. Substrate elasticity regulates skeletal muscle stem cell self-renewal in culture. Science. 329, 1078-1081 (2010).
- Motohashi, N., Asakura, Y., Asakura, A. Isolation culture, and transplantation of muscle satellite cells. Journal of Visualized Experiments. , (2014).
- Sciote, J. J., Horton, M. J., Rowlerson, A. M., Link, J. Specialized cranial muscles: how different are they from limb and abdominal muscles. Cells, Tissues, Organs. 174, 73-86 (2003).
- Rowlerson, A., Mascarello, F., Veggetti, A., Carpene, E. The fibre-type composition of the first branchial arch muscles in Carnivora and Primates. Journal of Muscle Research and Cell Motility. 4, 443-472 (1983).
- Muller, J., et al. Comparative evolution of muscular dystrophy in diaphragm, gastrocnemius and masseter muscles from old male mdx mice. Journal of Muscle Research and Cell Motility. 22, 133-139 (2001).
- Feldman, J. L., Stockdale, F. E. Skeletal muscle satellite cell diversity: satellite cells form fibers of different types in cell culture. Developmental Biology. 143, 320-334 (1991).
- Schmalbruch, H., Hellhammer, U. The number of nuclei in adult rat muscles with special reference to satellite cells. The Anatomical Record. 189, 169-175 (1977).
- Gibson, M. C., Schultz, E. The distribution of satellite cells and their relationship to specific fiber types in soleus and extensor digitorum longus muscles. The Anatomical Record. 202, 329-337 (1982).
- Carvajal Monroy, P. L., et al. A rat model for muscle regeneration in the soft palate. PloS One. 8, e59193 (2013).
Tags
Biología del Desarrollo Número 101 músculos de la cabeza músculo elevador del velo palatino muscular músculo digástrico el músculo masetero las células satélite células primarias de aislamiento paladar hendido la medicina regenerativa la ingeniería de tejidos las células madre diferenciación miofibrasErratum
Formal Correction: Erratum: Isolation and Characterization of Satellite Cells from Rat Head Branchiomeric Muscles
Posted by JoVE Editors on 10/01/2015.
Citeable Link.
An erratum was issue for Isolation and Characterization of Satellite Cells from Rat Head Branchiomeric Muscles. The fourth figure was updated to explain the isolation of the LVP better.
Steps 2.5.3 and 2.5.4 were updated from:
2.5.3. Look for the trachea and the esophagus that runs behind it. Lift the esophagus, and expose the pharynx, larynx and the soft palate.
2.5.4. Localize the area of the soft palate where the levator veli palatini is inserted and cut it loose (Figure 4B).
to
2.5.3. Look for the trachea and the esophagus that runs behind it. Lift the esophagus, and expose the pharynx and the larynx.
2.5.4 Localize and dissect the area of the superior pharyngeal constrictor muscle. Identify the levator veli palatini and cut it at both sides (Figure 4B).
Figure 4 and its legend were updated from:
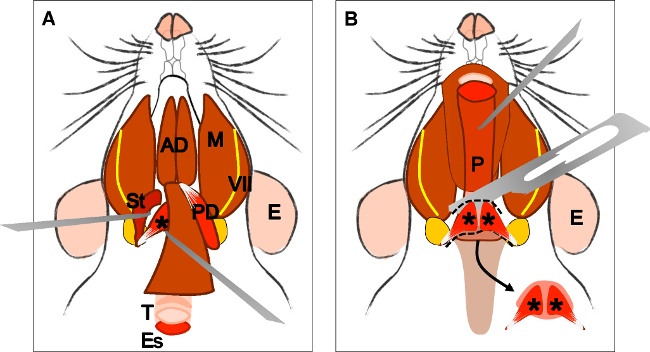
Figure 4: Dissection of the levator veli palatini muscle. (A) General view after dissection of the digastric muscle (posterior belly). Stylohyoid muscle (St) and tendon of the levator veli palatini can be localized. Note the trachea (T) and esophagus (Es) running behind it. (B) After lifting the trachea and the esophagus the pharynx (P) is exposed. The insertion of the levator veli palatini into the soft palate is now visible. The arrow indicates the dissected soft palate with the levator veli palatini muscles at both sides. E: ear, St: stylohyoid muscle, VII: facial nerve, M: masseter muscle, AD: anterior belly digastric muscle, PD: posterior belly digastric muscle, T: trachea, Es: esophagus, P: Pharynx, *levator veli palatini muscle.
to
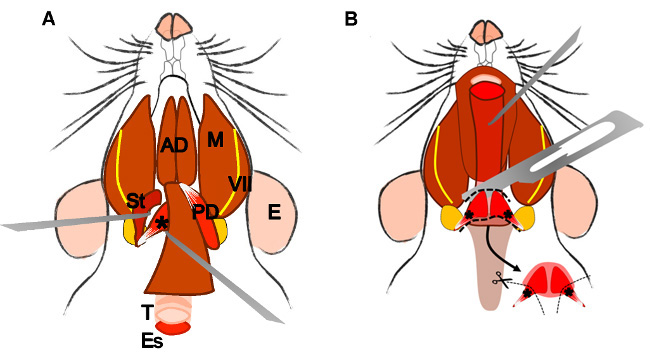
Figure 4: Dissection of the levator veli palatini muscle. (A) General view after dissection of the digastric muscle (posterior belly). Stylohyoid muscle (St) and tendon of the levator veli palatini can be localized. Note the trachea (T) and esophagus (Es) running behind it. (B) After lifting the trachea and the esophagus the pharynx (P) is exposed. The levator veli palatini that runs laterally towards the soft palate is now visible. The arrow indicates the dissected superior pharyngeal constrictor muscle; note the levator veli palatini muscles at both sides. E: ear, St: stylohyoid muscle, VII: facial nerve, M: masseter muscle, AD: anterior belly digastric muscle, PD: posterior belly digastric muscle, T: trachea, Es: esophagus, P: Pharynx, *levator veli palatini muscle.



