ERRATUM NOTICE
Important: There has been an erratum issued for this article. Read more …
Summary
Este protocolo descreve o isolamento de células de satélite a partir de músculos da cabeça branquiométrico de um rato 9 semanas de idade. Os músculos são originários de diferentes arco branquial. Subsequentemente, as células satélites são cultivadas em um revestimento local de tamanho milímetros para estudar a sua diferenciação. Esta abordagem evita a expansão e passagem em células de satélite.
Introduction
Cerca de 1: 500 a 1: 1.000 recém-nascidos apresentam uma fissura envolvendo o lábio e / ou palato (CLP); assim, esta é a malformação congênita mais comum em humanos uma. Os músculos do palato mole são essenciais para o funcionamento do palato mole durante a fala, deglutição e sucção. Se uma fenda do palato mole está presente, estes músculos são anormalmente inserido na extremidade posterior do osso palatino.
O palato mole move para cima e para baixo durante a fala, impedindo que o ar escape através do nariz. Crianças com uma fenda no palato não têm essa função de controle, resultando em um fenômeno conhecido como disfunção velofaríngea 2,3. Embora os protocolos de tratamento são variáveis, a reparação cirúrgica do palato mole tem lugar na primeira infância (6-36 meses de idade) 4. Os músculos anormalmente inseridos do palato mole pode ser corrigido cirurgicamente 5-7, no entanto, disfunção velopharyngeal persistir em 7% a 30%dos pacientes 2,3,8-10.
A capacidade do músculo esquelético para regenerar-se através da acção de células satélites (SCS) está bem estabelecida 11,12. Após a lesão muscular, SCs são activados e migram para o local da lesão. Eles então proliferar, diferenciar, e se fundem para formar novas fibras musculares ou reparar danificado os 13. Quiescentes SCs expressam o fator de transcrição Pax7 14,15, enquanto a sua progênie, os mioblastos proliferação, adicionalmente expressar o fator de determinação miogênica 1 (MyoD) 16. Mioblastos diferenciadores começam a expressar miogenina (MyoG) 17. A diferenciação terminal de mioblastos é marcada pela formação de miofibras, e a expressão de proteínas específicas de músculo, tais como cadeia pesada de miosina (MyHC) 16,18.
Recentemente, várias estratégias têm sido utilizadas em medicina regenerativa para melhorar a regeneração do músculo dos músculos do membro 19-23. Estudos específicos sobremúsculos da cabeça branquiométrico também são importantes, pois foi demonstrado recentemente que eles diferem de outros músculos em vários aspectos 24. Em contraste com os músculos dos membros, tem sido sugerido que os músculos da cabeça branquiométrico contêm menos SCs 25, regenerar mais lento, e tecido conjuntivo mais fibrosa é formada após a lesão 26 Além disso, a proliferação de músculos SCs cabeça branquiométrico também expressar outros factores de transcrição. Por exemplo, Tcf21, um fator de transcrição para a formação muscular craniofacial é fortemente expresso na regeneração de músculos da cabeça, mas dificilmente na regeneração de músculos dos membros 25. Os músculos do palato mole de pacientes CLP são geralmente menores e menos bem organizada em comparação com músculos palatinos normais 27,28. Fibras lentas e rápidas estão presentes nos músculos do palato mole, mas as fibras lentas são mais abundantes. Em contraste, os músculos fissura contêm uma maior proporção de fibras rápidas e também uma fonte capilar reduzidaem comparação com os músculos do palato mole normais 29-31. Fibras rápidas são mais propensas a contração induzida por lesão 31-33. O pobre suprimento capilar de acompanhamento também pode promover a fibrose 34,35. Todos estes aspectos podem contribuir para o mau regeneração dos músculos moles do palato após o fecho cirúrgico fenda 36. Em vista disso, um protocolo para o isolamento e caracterização de músculo cabeça branquiométrico SCs é crucial. Isto proporciona a possibilidade de estudar a biologia dos músculos SC cabeça branquiométrico. Além disso, novas terapias com base em engenharia de tecidos podem ser desenvolvidos para promover a regeneração muscular após a cirurgia em CRE e outras condições comprometedoras da área craniofacial.
Em geral, SCs pode ser obtido após dissociação do tecido muscular 14. Picar, digestão enzimática e trituração geralmente são obrigados a liberar SCs de seu nicho. SCs pode ser purificado por meio de pré-plaqueamento em placas não revestidas 14,37,38, fractionation em Percoll 39,40, célula ou fluorescent- ou triagem magnética 41-43. Aqui nós apresentamos um novo protocolo econômico e rápido para o isolamento de células satélites de músculos da cabeça branquiométrico de ratos adultos jovens. Este protocolo baseia-se num manuscrito anterior 14 e especificamente adaptado para pequenas amostras de tecido. O isolamento de SCs de músculos representativos provenientes do 1 º, 2 º e 4 º arcos branquiais são descritos. Após o isolamento, baixo número de células satélites são cultivadas em gel matriz extracelular manchas de tamanho milímetro para estudar a sua diferenciação. Esta abordagem evita a necessidade para a expansão e passaging de SCs.
Protocol
Todos os experimentos aqui descritos foram aprovados pelo Conselho local para Experimentação Animal da Radboud University Nijmegen, em conformidade com as leis e regulamentos (RU-dezembro 2013-205) Holandês.
1. Pontos de Matriz Extracelular gel
- Execute os seguintes passos um dia antes do isolamento:
- Descongelar uma aliquota extracelular matriz de gel (100 mL) a 4 ° C durante pelo menos 1,5 h. Diluir a 1:10 em meio de Eagle modificado por Dulbecco; com 4500 mg / L de glicose, 4 mM de L-glutamina, e 110 mg / ml de piruvato de sódio (DMEM). Manter o gel da matriz extracelular, a 4 ° C em todos os momentos. Nota: mudanças bruscas de temperatura irá resultar em revestimento irregular e formação de cristais.
- Manter a solução em gel de matriz extracelular diluído em gelo durante 15 min.
- Pré-descontrair uma micropipeta 20 l para 10 min.
- Coloque lâminas de câmaras de 8 poços para uma placa de Petri de 100 milímetros e transferir o prato sobre uma superfície fria (por exemplo, um pacote de congelador) durante 10 min.
- Utilizar a micropipeta pré-arrefecido a colocar uma gota de 10 ul de gel de matriz extracelular em cada cavidade. Manter a placa de Petri sobre a superfície fria durante pelo menos uma outra de 7 min (Figura 1A).
- Remover completamente o restante gel de matriz extracelular (Figura 1B), e secar os poços, a 37 ° C durante a noite.
2. Dissecção de Cabeça Músculos (músculo masseter, digástrico, e músculo levantador do véu palatino)
- Antes de dissecção, preparar 50 ml de solução salina tamponada com fosfato (PBS) suplementada com 2% de Penicilina-Estreptomicina (P / S). Manter em gelo.
- Após a eutanásia de um rato adulto jovem (9 semanas) com CO 2 / O 2, decapitar a cabeça e retire a pele da cabeça. Transferir a cabeça de PBS arrefecido em gelo suplementado com 2% de P / S em um tubo de 50 ml.
- Músculo masseter (derivado do primeiro arco branquial)
- Coloque a cabeça com um lateral-se sobre uma almofada de silicone e corrigir com hipodérmica needles (Figura 2A).
- Identificar a glândula parótida e nervo facial (Figura 2A). Expor a fascia profunda cobrindo a glândula. Corte a fáscia e remover a glândula usando tesouras de dissecação. Identificar o conduto auditivo externo. Trace o nervo facial do forame estilomastóideo e retire cuidadosamente os ramos temporais, zigomáticos, e bucais com uma lâmina de bisturi n ° 15.
- Livre a cabeça superficial do músculo masseter, removendo a fáscia. Identificar cabeças tanto superficial e profunda do músculo masseter. Traçar a cabeça superficial até sua aponeurosis tendinosa grossa inserido no processo zigomático da maxila.
- Separa-se o tendão a partir da sua origem no processo de zigomática com uma pinça rectas. Cortá-la com uma lâmina de bisturi n º 15 ou tesouras de dissecação e cuidadosamente vida dele (Figura 2B).
- Dissecar a cabeça superficial do músculo masseter até sua inserção no ângulo e metade inferior de tele Superfície lateral do ramo da mandíbula com uma lâmina de bisturi n ° 15 (Figura 2C). Agora, remover completamente o músculo.
- Ventre posterior do músculo digástrico (derivado do 2º branquial arco)
- Coloque a cabeça em uma posição supina sobre a almofada de silicone e corrigir com agulhas hipodérmicas (Figura 3A).
- Retire a gordura subcutânea que recobre tanto sublingual e submandibular. Em seguida, remova a fáscia superficial e glândulas usando tesouras de dissecação. Expor o músculo digástrico (anterior e posterior da barriga).
- Segure o tendão anterior do ventre posterior com uma pinça reta, cortá-la, e dissecá-lo cuidadosamente até sua origem na bula timpânica (Figura 3B). Fazer a mesma no lado contralateral.
- Levator músculo do véu palatino (derivado do quarto arco branquial)
- Após a dissecção do ventre posterior do músculo digástrico, Localizar o músculo stylohyoid, puxe-o lateralmente e, cuidadosamente, remova-a (Figura 4A).
- Localize o tendão do músculo levantador do véu palatino que insere na bula timpânica (Figura 4A). Dissecá-lo com cuidado e corte-o em ambos os lados.
- Procure a traquéia eo esôfago que corre atrás dele. Levantar o esófago, e expor a faringe, laringe e o palato mole.
- Localize a área do palato mole, onde é inserido o levantador do véu palatino e cortá-lo solto (Figura 4B).
Nota: Diretamente após a dissecação, remova cuidadosamente tendões e tecido conjuntivo de cada músculo sob o microscópio estéreo. Submerge todas as amostras rapidamente em etanol a 70%, e transferi-los para PBS arrefecido em gelo suplementado 2% de P / S em um tubo de 15 ml.
3. Isolamento de células satélites
- Execute as seguintes etapas de preparação para SC isolamento a partir de 3 grupos de músculos:
- Prepare a 7,5 ml de 0,1% de pronase em DMEM. Filtrar a solução através de um filtro de 0,22 um. Pré-aquecer a solução a 37 ° C num banho de água durante 10 minutos antes do isolamento.
- Preparar 35 ml de DMEM suplementado com 10% de Soro de Cavalo (HS) e 1% de P / S. Também pré-aquecer a 37 ° C num banho de água.
- Preparar 15 ml de meio de cultura, que consiste em DMEM suplementado com 20% de soro fetal de bovino (FBS), 10% HS, 1% de P / S e 1% de extracto de embrião de galinha (CEE). Pré-aquecer a 37 ° C num banho de água.
- Pré-revestimento seis pipetas de plástico (10 ml) com HS e secas durante pelo menos 10 minutos antes da utilização.
- Na capa de cultura, transferir cada músculo em um poço de uma placa de 6 poços. Usando as tesouras de dissecação, cortados do músculo em pedaços pequenos de cerca de 2 mm. Tenha cuidado para não picar o tecido muito.
- Adiciona-se cuidadosamente 2,5 ml de solução de pronase a 0,1% a cada poço e incuba-se a 37 ° C durante 60 min. Agite ligeiramente a placa após 20, 40 e 60 min. Nota: O duratio exatan da incubação depende de fatores como idade e estirpe dos animais.
- Monitorar sob o microscópio. Confira os fragmentos musculares e parar a digestão enzimática quando os feixes de fibras ter uma aparência solta (Figura 5).
- Adicionar 2,5 ml de DMEM suplementado com 10% de HS e 1% de P / S. Transferir para um tubo de 15 ml e centrifugar os tubos a 400 xg durante 5 min. Descartar o sobrenadante por decantação.
- Adicionar 5 ml de DMEM suplementado com 10% de HS e 1% de P / S. Pipetar a solução para cima e para baixo com uma pipeta de 10 ml em plástico (trituração) por pelo menos 20 vezes para homogeneizar o tecido.
- Centrifugar os tubos a 200 xg durante 4 min. Recolhe-se o sobrenadante e transferir para um tubo de 15 ml.
- Adicionar 5 ml de DMEM suplementado com 10% de HS e 1% de P / S. Pipeta de novo com uma pipeta de plástico de 10 mL até os fragmentos de tecido passa facilmente através da pipeta.
- Centrifugar os tubos a 200 xg durante 4 minutos e recolher o sobrenadante num tubo de 15 ml.
- Put um filtro de células (40 ^ M) para um tubo de 50 ml e transfere-se o sobrenadante contendo as células dissociadas sobre o filtro. Lavar com 1 ml DMEM para a recuperação das células máxima.
- Centrifugar os tubos a 1000 x g durante 10 minutos e descarta-se o sobrenadante com uma pipeta.
- Ressuspender o sedimento em 300 ul de meio de cultura e contar as células num hemocitómetro.
4. A diferenciação das células satélites em Spots de Matriz Extracelular Tapetes
- Dilui-se a suspensão de células para se obter 1,5 x 10 3 células em 10 ul de meio de cultura.
- Fixe as tampas das câmaras de slides com fita e marcar os pontos com um marcador preto no lado inferior do vidro objeto.
- Usando uma micropipeta, coloque uma gota de suspensão de células 10 ul para o ponto gel matriz extracelular. Verificar se ao microscópio a gota da suspensão de células foi colocada correctamente no local. Incubar durante seis horas a 37 ° C.
- Cuidadosoly adicionar 400 uL de meio de cultura (DMEM suplementado com FBS a 20%, 10% HS, 1% de P / S a 1% e CEE) e incuba-se durante três dias a 37 ° C.
Nota: Neste ponto, recentemente isoladas SC são submetidos a um trauma severo (digestão enzimática e trituração dura) e que eles precisam para se recuperar. Não perturbar as células durante os primeiros três dias 37. A seguir, o meio de cultura pode ser alterada dependendo do tipo de experiência.
Os pontos de gel da matriz extracelular podem ser semeadas com uma densidade celular elevada (1,5-2,5 x 10 3/20 l) para o ensaio de diferenciação. O meio de cultura (DMEM suplementado com FBS a 20%, 10% HS, 1% de P / S e 1% de extracto de embrião de galinha) pode ser substituído a cada três dias. - Alternativamente, se a expansão ea passagem é desejada seguir os seguintes passos:
- Descongelar uma aliquota extracelular matriz de gel (500 mL) a 4 ° C durante pelo menos 1,5 h. Diluir 1:10 em DMEM e siga as recomendações no ponto 1.1.1.
- Pré-arrefecer uma pipeta de 10 mL durante 10 min a 4 &# 176; C.
- Transferir três frascos T75 sobre uma superfície fria (por exemplo, um pacote de congelador) durante 10 min.
- Use a pipeta pré-refrigerados para colocar 1 ml de gel de matriz extracelular em cada frasco. Verifique se a superfície é coberta completamente. Manter os frascos sobre a superfície fria durante pelo menos uma outra de 7 min (Figura 1A).
- Remover completamente o gel matriz extracelular restante com uma pipeta de 10 ml, e secar os poços, a 37 ° C durante 1 h.
- Após a contagem, ressuspender as SCs isolados de fresco em 10 ml de meio de cultura (DMEM suplementado com FBS a 20%, 10% HS, 1% de P / S e 1% de extracto de embrião de galinha) e as sementes em frascos T75 pré-revestidos.
- Depois de três dias, alterar a forma (e cada terceiro dia) até 80% de confluência é atingido. Para passaging, lavar os frascos T75 três vezes com PBS. Em seguida adicionar 1 ml de solução de tripsina a 0,25% e incubar durante três minutos a 37 ° C. Ressuspender em 9 ml de meio de cultura (DMEM suplementado com FBS a 20%, 10% HS, 1% de P / Se 1% de extracto de embrião de galinha) e centrifugar a 200 xg durante 5 min. Desprezar o sobrenadante. Após a contagem, ressuspender 1 x 10 6 células em 1000 uL de meio de cultura e congelar as células.
Representative Results
Usando este protocolo, o músculo masseter (um lado) produz 0,8-1 x 10 6 células, o músculo digástrico (barriga posterior) produz 1,5-2 x 10 5 células, e levator veli rendimentos musculares palatini 1-1,5 x 10 5 células. Rendimentos celulares dependem do tipo muscular, estirpe e idade do animal. Para a comparação entre os três grupos musculares, SCs isolados de fresco foram semeadas à mesma densidade de células (1,5 x 10 3/10 ul). Imediatamente após o isolamento, mais de 90% das células recentemente isoladas expressam Pax7 (Figura 6).
Dia 4, 7 e 10 culturas foram coradas com anticorpos contra Pax7, MyoD, MyoG e MyHC immunostaining. Cinco campos arbitrários foram contadas por cultura usando uma objetiva de 20X. No dia 4 Pax 7 e Myo D é expresso em todos os grupos musculares (Figuras 6 e 7 e 8), porém a descendência de SatCs do masseter e os músculos digástrico começar exprescante miogenina mais cedo do que o músculo levantador do véu palatino (Figura 9). No dia 10, a expressão de MyoG é fortemente reduzida em todos os grupos (Figura 9). Alguns dias após a semeadura das manchas do gel matriz extracelular, as células em proliferação começar a fundir e formar miotubos multi-nucleadas, que expressam miosina de cadeia pesada. Pequenas miotubos são claramente visíveis no dia 7 (Figura 10). No dia 10, espasmos dos myotubes pode ser observada (Video 1).

Figura 1:. Manchas extracelulares da matriz de gel em uma lâmina de câmara (A) Para a manipulação fácil, colocar a corrediça câmara de 8 poços para uma placa de Petri 100 milímetros. Pipeta 10 ul gel matriz extracelular em cada câmara e coloque-o sobre uma superfície fria (7 min). (B) Câmara slide após o excesso de matriz extracelular gel é removido.

Figura 2:. Dissecção do músculo masseter (A) Cabeça do animal em uma visão lateral. Orelha (E), a glândula parótida (P) e do nervo facial (VII). (B) tendíneas aponeurosis (Te) da cabeça superficial do músculo masseter (Ms) e do músculo temporal (T). Separa-se a sua inserção a partir de tendão com um fórceps. (C) dissecar cuidadosamente o músculo até sua inserção no ramo da mandíbula. E: orelha, P: glândula parótida, VII: nervo facial, T: músculo temporal, Ms: cabeça superficial do músculo masseter, Te: tendão, Mp: cabeça profunda do músculo masseter.

Figura 3: Dissecção do ventre posterior do músculo digástrico (.A) Cabeça do animal em decúbito dorsal. Localizar a glândula submandibular (SG), músculo masseter (M), nervo facial (VII) e músculo esternocleidomastóideo (SCM). Remover a glândula submandibular. (B) Localize o anterior digástrico muscular (AD) e ventre posterior (DP). Com uma pinça reta, tomar o tendão anterior do ventre posterior, cortá-lo e dissecá-lo cuidadosamente até sua origem na bula timpânica (ty). E: orelha, Sg: glândula submandibular, VII: nervo facial, M: músculo masseter, SMC: esternocleidomastoideu, AD: barriga músculo digástrico anterior, PD: músculo digástrico ventre posterior, Ty: bula timpânica.

Figura 4:. Dissecção do músculo elevador do véu palatino (A) Vista geral após a dissecação do músculo digástrico (ventre posterior). Músculo stylohyoid (St) e tendão do músculo levantadorvéu palatino pode ser localizada. Nota da traquéia (T) e esôfago (Es) correndo atrás dele. (B) Depois de levantar a traqueia e o esófago da faringe (P) fica exposto. A inserção do músculo levantador do véu palatino no palato mole é agora visível. A seta indica o palato mole dissecados com os músculos palatino levator Veli em ambos os lados. E: orelha, St: músculo stylohyoid, VII: nervo facial, M: músculo masseter, AD: barriga músculo digástrico anterior, PD: músculo digástrico ventre posterior, T: traqueia, Es: esôfago, P: faringe, * levator músculo do véu palatino .

Figura 5: Aparência do tecido muscular (A) antes e (B), após a digestão enzimática com pronase. Note-se que feixes musculares parecem ser solta após a digestão enzimática.
Figura 6: 7 Pax imunocoloração SCs recentemente isoladas, aplicado a gel de matriz extracelular no final do isolamento (cerca de 6 horas após a digestão inicial do tecido).. Cinco campos arbitrárias foram contadas utilizando uma objectiva de 10x com uma média de 210 células por campo. Aproximadamente 90% das células são positivas Pax 7. DAPI: azul, Pax7: vermelho. Barra de escala, 100 mm.

Figura 7:. Pax 7, MyoD immunostaining Dia 4, 7 e 10 culturas foram coradas com anticorpos contra Pax7 e MyoD immunostaining. (A - C) e (D - F) fotomicrografias representativas dos dias 4 e 7 a partir de culturas do músculo masséter. (L e H + e MyoD + núcleos por campo microscópico, foi contado e expresso como uma percentagem do número total de núcleos (DAPI). DAPI: azul, Pax7: vermelho, e MyoD: verde. Escalas bar, 100 mm. Por favor clique aqui para ver uma versão maior desta figura.

Figura 8:. Distribuição de Pax7 ± / ± MyoD em culturas de células mononucleares nas culturas a partir do músculo masseter palatina, digástrico e levator veli (A - C) Dia 4, 7 e 10 culturas foram coradas com anticorpos contra Pax7 e MyoD immunostaining. O número total de células é baseada na do número total de núcleos (DAPI). (D) quantificação de dados de Pax7 ± / ± cel MyoDls. Por favor clique aqui para ver uma versão maior desta figura.

Figura 9:. Immunostaining Miogenina Dia 4, 7 e 10 culturas foram coradas com anticorpos contra Miogenina. (A - D) fotomicrografias representativas dos dias 4 e 7 culturas do músculo levantador do véu palatino. (E) O número de MyoG + núcleos por campo microscópico, foi contado e expresso como uma percentagem do número total de núcleos (DAPI). Quantificação (F) Dados de células MyoG +. DAPI: azul, Miogenina: verde. Escalas bar, 100 mm. Por favor clique aqui para ver uma versão maior desta figure.

Figura 10:. Myosin Cadeia Pesada immunostaining Dia 4, 7 e 10 culturas foram coradas com anticorpos contra a cadeia pesada de miosina (MyHC). Fotomicrografias representativas dos dias 4, 7 e 10 culturas do músculo digástrico (DIG). No dia 7, as pequenas myotubes estão presentes, enquanto no dia 10 myotubes longas e bem organizados são evidentes. Escalas bar, 200 um. Por favor clique aqui para ver uma versão maior desta figura.
Vídeo 1:.. Miotubo contraindo Exemplos de dois campos representativos com myotubes contraindo são mostrados para o dia 10 culturas de músculo digástrico Por favor clique aqui para ver este vídeo.
Discussion
SCs de diferentes músculos da cabeça branquiométrico foram isolados a partir de um de 9 semanas de idade de ratos Wistar e cultivadas directamente em manchas de gel de matriz extracelular sem a expansão e passagem em antes. Após o isolamento, as células foram contadas e semeadas à mesma densidade celular. Para o isolamento paralela de três músculos diferentes, este método leva cerca de 4 horas. Para evitar a contaminação da cultura, um passo crítico é a rápida lavagem em álcool a 70% após a dissecação dos músculos.
Durante SC isolamento é importante para cortar o tecido muscular em pequenos pedaços (cerca de 2 mm), mas evitar o excesso de picagem pois isso irá resultar num rendimento de célula pequena por causa de danos celulares. Além disso, a duração da digestão enzimática deve ser verificado cuidadosamente sob o microscópio para evitar mais danos. O objectivo da digestão é de dissociar as miofibras. Uma vez que mais de 90% das células isoladas expressam Pax7, não é necessária mais purificação (Figuras 6-8).Isto evita passos de purificação adicionais em outros métodos, tais como pré-plaqueamento em placas não revestidas 14,37,38, fraccionamento em Percoll 39,40, célula ou fluorescent- ou triagem magnética 41,43. Por trituração é essencial induzir cisalhamento entre os fragmentos de tecido e a abertura da ponta da pipeta como este permite que a libertação mecânica do SC. Se a trituração com uma pipeta 10 ml (dentro de ponta diâmetro: 1 mm), é difícil, de 5 ml (dentro ponta diâmetro: 2 mm) pipeta pode ser utilizada pela primeira vez. Alternativamente, pipetas de Pasteur de vidro pode ser cortado no diâmetro desejado e ser utilizado. Este método é simples, eficiente e permite o isolamento em simultâneo de SC a partir de diferentes amostras do músculo.
As placas de cultura para SCS também pode ser revestida com gelatina ou colagénio, mas os nossos estudos anteriores mostram que o gel de matriz extracelular é muito melhor para a manutenção do potencial miogénica de colagénio 38. As manchas extracelulares da matriz de geltamanho milímetros (10 ul / S de 2 mm ou 20 ul de E / S 4 mm) permite o estudo da proliferação e diferenciação de SCS com um número limitado de células. Para o ensaio de diferenciação de cerca de 8 a 20 vezes menos células são necessários em comparação com uma placa de 24 poços (Ø 15,6 milímetros), e cerca de 80 a 200 vezes menos comparado até 35 mm pratos Petri (Ø 35 mm) 14,38.
Desde gel de matriz extracelular é caro, este método também é mais eficiente em termos de custos. Além disso, as lâminas de câmara pode ser substituído por cobertura de plástico desliza para reduzir ainda mais os custos. Para a preparação do gel matriz extracelular acaba de secagem durante a noite das lâminas de câmaras é essencial. À medida que as manchas de gel de matriz extracelulares são transparentes, é necessário marcar os pontos no lado inferior utilizando iluminação traseira. As câmaras de slides são fixados em uma placa de Petri para a manipulação fácil. A expansão adicional de cultura de células não é necessário, o que oferece a possibilidade de estudar o SCs de smalLER músculos ou amostras musculares pequenos. Alternativamente, por exemplo, para PCR ou músculo constrói se são necessários mais células, as SCs de isolados de fresco pode ser primeiro expandida em frascos T75, tal como indicado acima.
SCs isolado utilizando este protocolo, não são adequados para a purificação adicional com a citometria de fluxo imediatamente após o isolamento. A digestão com pronase provoca extensa digestão de antigénios da superfície 14. De soro de cavalo e soro fetal bovino que são utilizados para a cultura de células tem de primeiro ser adequadamente caracterizados, antes do isolamento, como diferentes números de lote diferencialmente afectada mioblastos proliferação e diferenciação.
Nos últimos anos, há um crescente interesse nos músculos derivados dos arcos branquiais e da mesoderme da cabeça (por exemplo, os músculos extra-oculares) 24. Tem sido claramente demonstrado que músculos da cabeça e dos membros possuem propriedades altamente diferentes. Músculo masséter de animais velhos parece retain sua capacidade regenerativa, em comparação com os músculos dos membros 25,26. SCs dos músculos extra-oculares possuem uma robusta capacidade de proliferação e diferenciação comparável ao SCs de músculos da cabeça, e mostrar um potencial maior do que o enxerto muscular de membros SCs 24.
A composição de distribuição do tipo de fibra e miosina varia entre os grupos musculares e também entre as espécies. Músculos originários a partir do primeiro arco branquial em humanos contêm fibras tanto lentas e rápidas (IIA e IIX subtipos), myosins neonatais e myosins típicos para o desenvolvimento de músculo cardíaco. Em roedores estes músculos contêm cerca de 95% IIA fibras rápidas miosina e IIb) 44-46. Estudos sobre os músculos aviário mostram que a SCS a partir de diferentes tipos de fibras musculares variar em capacidade de diferenciação. SCs de fibras rápidas única diferenciar em fibras musculares rápidas, enquanto SCs de fibras lentas podem se diferenciar em ambos os tipos de fibras 47. Além disso, a percentagem de CT no músculo rápidofibras é menor do que na fibras musculares lentas 48,49. Isto indica que a distribuição do tipo de fibra deve ser tida em conta para os estudos sobre os músculos na área craniofacial. Similar aos músculos fenda palatina, o LVP em roedores contém quase exclusivamente fibras rápidas 50. Por essa razão, SCs da LVP são adequados para estudos pré-clínicos no campo da fenda palatina.
Este protocolo oferece novas possibilidades para estudar SCs derivadas de músculos da cabeça branquiométrico ou outros músculos menores ou amostras de músculos menores. Isto irá facilitar o desenvolvimento de novas terapias para melhorar a regeneração dos músculos da região maxilofacial em condições tais como fenda palatina mas também em outras condições que afectam os músculos menores.
Materials
| Name | Company | Catalog Number | Comments |
| Hypodermic Needle 25 G 0.5 x 25 m | BD Microlance | 300400 | |
| Dissecting scissors | Braun | BC154R | |
| Micro forceps straight | Braun | BD330R | |
| Surgical Scalpel Blade No. 15 | Swann-Morton | 0205 | |
| Alcohol 70% | Denteck | 2,010,005 | |
| Permanox Slide, 8 Chamber | Thermo Scientific | 177445 | |
| 6 well cell culture plate | Greiner bio-one | 657160 | |
| Cell Culture Dishes (100 x 20 mm) | Greiner bio-one | 664160 | |
| 15 ml sterile conical centrifuge tube | BD Biosciences | 352097 | |
| 50 ml sterile conical centrifuge tube | BD Biosciences | 352098 | |
| Cell strainer (40 μm) | Gibco | 431750 | |
| 10 ml serological pipette | Greiner bio-one | 607180 | |
| 20 µl FT20 | Greiner bio-one | 774288 | |
| Matrigel, Phenol-Red Free | BD Biosciences | 356237 | 10 ml |
| Pronase | Calbiochem | 53702 | 10 KU |
| Phosphate Buffered Saline | Gibco | 14190-144 | 500 ml |
| Dulbecco's Modified Eagle Medium, high glucose, GlutaMAX Supplement, pyruvate | Gibco | 10569-010 | 500 ml |
| Fetal Bovine Serum | Fisher Scientific | 3600511 | 500 ml |
| Horse Serum | Gibco | 26050088 | 500 ml |
| Penicillin-Streptomycin (10,000 U/ml) | Gibco | 15140-122 | 100 ml |
| Chicken Embryo Extract | MP Biomedicals | 2850145 | 20 ml |
References
- Gritli-Linde, A. Molecular control of secondary palate development. Developmental Biology. 301, 309-326 (2007).
- Marrinan, E. M., LaBrie, R. A., Mulliken, J. B. Velopharyngeal function in nonsyndromic cleft palate: relevance of surgical technique, age at repair, and cleft type. The Cleft Palate-Craniofacial Journal. 35, 95-100 (1998).
- Morris, H. L. Velopharyngeal competence and primary cleft palate surgery, 1960-1971: a critical review. The Cleft Palate Journal. 10, 62-71 (1973).
- Mossey, P. A., Little, J., Munger, R. G., Dixon, M. J., Shaw, W. C. Cleft lip and palate. Lancet. 374, 1773-1785 (2009).
- Boorman, J. G., Sommerlad, B. C. Musculus uvulae and levator palati: their anatomical and functional relationship in velopharyngeal closure. British Journal of Plastic Surgery. 38, 333-338 (1985).
- Bae, Y. C., Kim, J. H., Lee, J., Hwang, S. M., Kim, S. S. Comparative study of the extent of palatal lengthening by different methods. Annals of Plastic Surgery. 48, 359-362 (2002).
- Braithwaite, F., Maurice, D. G. The importance of the levator palati muscle in cleft palate closure. British Journal of Plastic Surgery. 21, 60-62 (1968).
- Inman, D. S., Thomas, P., Hodgkinson, P. D., Reid, C. A. Oro-nasal fistula development and velopharyngeal insufficiency following primary cleft palate surgery--an audit of 148 children born between 1985 and 1997. British Journal of Plastic Surgery. 58, 1051-1054 (2005).
- Phua, Y. S., de Chalain, T. Incidence of oronasal fistulae and velopharyngeal insufficiency after cleft palate repair: an audit of 211 children born between 1990 and 2004. The Cleft Palate-Craniofacial Journal. 45, 172-178 (1990).
- Kirschner, R. E., et al. Cleft-palate repair by modified Furlow double-opposing Z-plasty: the Children's Hospital of Philadelphia experience. Plastic and Reconstructive Surgery. 104, 1998-2010 (1999).
- Mauro, A. Satellite cell of skeletal muscle fibers. The Journal of Biophysical and Biochemical Cytology. 9, 493-495 (1961).
- Yablonka-Reuveni, Z. The skeletal muscle satellite cell: still young and fascinating at 50. The Journal of Histochemistry and Cytochemistry. 59, 1041-1059 (2011).
- Ten Broek, R. W., Grefte, S., Von den Hoff, J. W. Regulatory factors and cell populations involved in skeletal muscle regeneration. Journal of Cellular Physiology. 224, 7-16 (2010).
- Danoviz, M. E., Yablonka-Reuveni, Z. Skeletal muscle satellite cells: background and methods for isolation and analysis in a primary culture system. Methods in Molecular Biology. 798, 21-52 (2012).
- Seale, P., et al. Pax7 is required for the specification of myogenic satellite cells. Cell. 102, 777-786 (2000).
- Yablonka-Reuveni, Z., et al. The transition from proliferation to differentiation is delayed in satellite cells from mice lacking MyoD. Developmental Biology. 210, 440-455 (1999).
- Zammit, P. S., Partridge, T. A., Yablonka-Reuveni, Z. The skeletal muscle satellite cell: the stem cell that came in from the cold. The Journal of Histochemistry And Cytochemistry. 54, 1177-1191 (2006).
- Andres, V., Walsh, K. Myogenin expression, cell cycle withdrawal, and phenotypic differentiation are temporally separable events that precede cell fusion upon myogenesis. The Journal of Cell Biology. 132, 657-666 (1996).
- Fukushima, K., et al. The use of an antifibrosis agent to improve muscle recovery after laceration. The American Journal of Sports Medicine. 29, 394-402 (2001).
- Grefte, S., Kuijpers-Jagtman, A. M., Torensma, R., Von den Hoff, J. W. Skeletal muscle fibrosis: the effect of stromal-derived factor-1α-loaded collagen scaffolds. Regenerative Medicine. 5, 737-747 (2010).
- Jackson, W. M., Nesti, L. J., Tuan, R. S. Potential therapeutic applications of muscle-derived mesenchymal stem and progenitor cells. Expert Opinion on Biological Therapy. 10, 505-517 (2010).
- Sato, K., et al. Improvement of muscle healing through enhancement of muscle regeneration and prevention of fibrosis. Muscle, & Nerve. 28, 365-372 (2003).
- Tatsumi, R., Anderson, J. E., Nevoret, C. J., Halevy, O., Allen, R. E. HGF/SF is present in normal adult skeletal muscle and is capable of activating satellite cells. Developmental Biology. 194, 114-128 (1998).
- Stuelsatz, P., et al. Extraocular muscle satellite cells are high performance myo-engines retaining efficient regenerative capacity in dystrophin deficiency. Developmental biology. , (2014).
- Ono, Y., Boldrin, L., Knopp, P., Morgan, J. E., Zammit, P. S. Muscle satellite cells are a functionally heterogeneous population in both somite-derived and branchiomeric muscles. Developmental Biology. 337, 29-41 (2010).
- Pavlath, G. K., et al. Heterogeneity among muscle precursor cells in adult skeletal muscles with differing regenerative capacities. Developmental Dynamics. 212, 495-508 (1998).
- Koo, S. H., Cunningham, M. C., Arabshahi, B., Gruss, J. S., Grant, J. H. 3rd The transforming growth factor-beta 3 knock-out mouse: an animal model for cleft palate. Plastic and Reconstructive Surgery. 108, 938-948 (2001).
- Fara, M., Brousilova, M. Experiences with early closure of velum and later closure of hard palate. Plastic and Reconstructive Surgery. 44, 134-141 (1969).
- Lindman, R., Paulin, G., Stal, P. S. Morphological characterization of the levator veli palatini muscle in children born with cleft palates. The Cleft Palate-Craniofacial Journal. 38, 438-448 (2001).
- Hanes, M. C., et al. Contractile properties of single permeabilized muscle fibers from congenital cleft palates and normal palates of Spanish goats. Plastic and Reconstructive Surgery. 119, 1685-1694 (2007).
- Rader, E. P., et al. Contraction-induced injury to single permeabilized muscle fibers from normal and congenitally-clefted goat palates. The Cleft Palate-Craniofacial Journal. 44, 216-222 (2007).
- Rader, E. P., et al. Effect of cleft palate repair on the susceptibility to contraction-induced injury of single permeabilized muscle fibers from congenitally-clefted goat palates. The Cleft Palate-Craniofacial Journal. 45, 113-120 (2008).
- Macpherson, P. C., Dennis, R. G., Faulkner, J. A. Sarcomere dynamics and contraction-induced injury to maximally activated single muscle fibres from soleus muscles of rats. The Journal of Physiology. 500 (Pt 2), 523-533 (1997).
- Koch, K. H., Grzonka, M. A., Koch, J. The pathology of the velopharyngeal musculature in cleft palates). Annals of Anatomy. 181, 123-126 (1999).
- Fara, M., Dvorak, J. Abnormal anatomy of the muscles of palatopharyngeal closure in cleft palates: anatomical and surgical considerations based on the autopsies of 18 unoperated cleft palates. Plastic and Reconstructive Surgery. 46, 488-497 (1970).
- Carvajal Monroy, P. L., Grefte, S., Kuijpers-Jagtman, A. M., Wagener, F. A., Von den Hoff, J. W. Strategies to Improve Regeneration of the Soft Palate Muscles After Cleft Palate Repair. Tissue Engineering. Part B, Reviews. , (2012).
- Grefte, S., Kuijpers, M. A., Kuijpers-Jagtman, A. M., Torensma, R., Von den Hoff, J. W. Myogenic capacity of muscle progenitor cells from head and limb muscles. European Journal of Oral Sciences. 120, 38-45 (2012).
- Grefte, S., Vullinghs, S., Kuijpers-Jagtman, A. M., Torensma, R., Von den Hoff, J. W. Matrigel but not collagen I, maintains the differentiation capacity of muscle derived cells in vitro. Biomedical Materials. 7, 055004 (2012).
- Kastner, S., Elias, M. C., Rivera, A. J., Yablonka-Reuveni, Z. Gene expression patterns of the fibroblast growth factors and their receptors during myogenesis of rat satellite cells. The Journal of Histochemistry and Cytochemistry. 48, 1079-1096 (2000).
- Yablonka-Reuveni, Z., Quinn, L. S., Nameroff, M. Isolation and clonal analysis of satellite cells from chicken pectoralis muscle. Developmental Biology. 119, 252-259 (1987).
- Sherwood, R. I., et al. Isolation of adult mouse myogenic progenitors: functional heterogeneity of cells within and engrafting skeletal muscle. Cell. 119, 543-554 (2004).
- Gilbert, P. M., et al. Substrate elasticity regulates skeletal muscle stem cell self-renewal in culture. Science. 329, 1078-1081 (2010).
- Motohashi, N., Asakura, Y., Asakura, A. Isolation culture, and transplantation of muscle satellite cells. Journal of Visualized Experiments. , (2014).
- Sciote, J. J., Horton, M. J., Rowlerson, A. M., Link, J. Specialized cranial muscles: how different are they from limb and abdominal muscles. Cells, Tissues, Organs. 174, 73-86 (2003).
- Rowlerson, A., Mascarello, F., Veggetti, A., Carpene, E. The fibre-type composition of the first branchial arch muscles in Carnivora and Primates. Journal of Muscle Research and Cell Motility. 4, 443-472 (1983).
- Muller, J., et al. Comparative evolution of muscular dystrophy in diaphragm, gastrocnemius and masseter muscles from old male mdx mice. Journal of Muscle Research and Cell Motility. 22, 133-139 (2001).
- Feldman, J. L., Stockdale, F. E. Skeletal muscle satellite cell diversity: satellite cells form fibers of different types in cell culture. Developmental Biology. 143, 320-334 (1991).
- Schmalbruch, H., Hellhammer, U. The number of nuclei in adult rat muscles with special reference to satellite cells. The Anatomical Record. 189, 169-175 (1977).
- Gibson, M. C., Schultz, E. The distribution of satellite cells and their relationship to specific fiber types in soleus and extensor digitorum longus muscles. The Anatomical Record. 202, 329-337 (1982).
- Carvajal Monroy, P. L., et al. A rat model for muscle regeneration in the soft palate. PloS One. 8, e59193 (2013).
Tags
Biologia do Desenvolvimento edição 101 músculos da cabeça levantador do véu palatino muscular músculo digástrico músculo masseter as células satélites células primárias de isolamento fenda palatina medicina regenerativa a engenharia de tecidos células estaminais diferenciação myofibersErratum
Formal Correction: Erratum: Isolation and Characterization of Satellite Cells from Rat Head Branchiomeric Muscles
Posted by JoVE Editors on 10/01/2015.
Citeable Link.
An erratum was issue for Isolation and Characterization of Satellite Cells from Rat Head Branchiomeric Muscles. The fourth figure was updated to explain the isolation of the LVP better.
Steps 2.5.3 and 2.5.4 were updated from:
2.5.3. Look for the trachea and the esophagus that runs behind it. Lift the esophagus, and expose the pharynx, larynx and the soft palate.
2.5.4. Localize the area of the soft palate where the levator veli palatini is inserted and cut it loose (Figure 4B).
to
2.5.3. Look for the trachea and the esophagus that runs behind it. Lift the esophagus, and expose the pharynx and the larynx.
2.5.4 Localize and dissect the area of the superior pharyngeal constrictor muscle. Identify the levator veli palatini and cut it at both sides (Figure 4B).
Figure 4 and its legend were updated from:
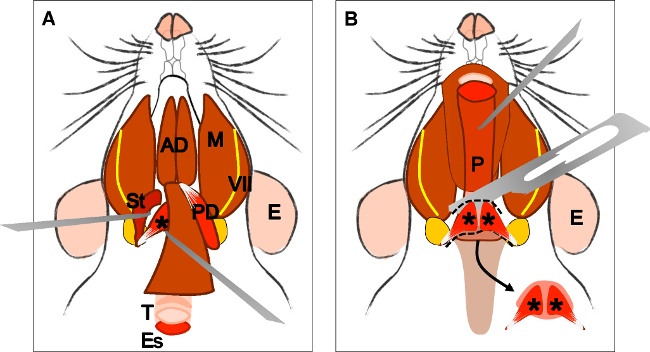
Figure 4: Dissection of the levator veli palatini muscle. (A) General view after dissection of the digastric muscle (posterior belly). Stylohyoid muscle (St) and tendon of the levator veli palatini can be localized. Note the trachea (T) and esophagus (Es) running behind it. (B) After lifting the trachea and the esophagus the pharynx (P) is exposed. The insertion of the levator veli palatini into the soft palate is now visible. The arrow indicates the dissected soft palate with the levator veli palatini muscles at both sides. E: ear, St: stylohyoid muscle, VII: facial nerve, M: masseter muscle, AD: anterior belly digastric muscle, PD: posterior belly digastric muscle, T: trachea, Es: esophagus, P: Pharynx, *levator veli palatini muscle.
to
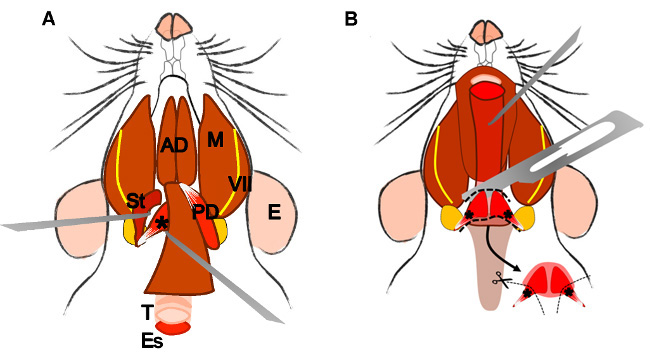
Figure 4: Dissection of the levator veli palatini muscle. (A) General view after dissection of the digastric muscle (posterior belly). Stylohyoid muscle (St) and tendon of the levator veli palatini can be localized. Note the trachea (T) and esophagus (Es) running behind it. (B) After lifting the trachea and the esophagus the pharynx (P) is exposed. The levator veli palatini that runs laterally towards the soft palate is now visible. The arrow indicates the dissected superior pharyngeal constrictor muscle; note the levator veli palatini muscles at both sides. E: ear, St: stylohyoid muscle, VII: facial nerve, M: masseter muscle, AD: anterior belly digastric muscle, PD: posterior belly digastric muscle, T: trachea, Es: esophagus, P: Pharynx, *levator veli palatini muscle.



