ERRATUM NOTICE
Important: There has been an erratum issued for this article. Read more …
Summary
Bu protokol, 9 haftalık farenin branchiomeric merkez kas uydu hücreleri izolasyonunu anlatmaktadır. kaslar, farklı brankiyal kemerlerin kaynaklanmaktadır. Daha sonra, uydu hücreleri farklılaşma çalışma milimetre boyutta bir Noktası kaplama üzerinde kültürlenmiştir. Bu yaklaşım, uydu hücrelerinin genişleme ve pasajlanmasını önler.
Introduction
Yaklaşık 1: 500-1: 1000 yenidoğan dudak ve / veya damak (CLP) içeren yarık gösterirler; Böylece bu insanlarda 1 en sık doğumsal anomalidir. yumuşak damak kasları konuşma, yutma ve emme sırasında yumuşak damak işleyişi için kritik öneme sahiptir. Yumuşak damak yarık varsa, bu kaslar anormal damak kemiğinin arka ucuna yerleştirilir.
yumuşak damak burundan kaçmak için havanın önlenmesi, konuşması sırasında yukarı ve aşağı hareket eder. Damakta bir yarık olan çocuklar velofaringeal disfonksiyonu 2,3 olarak bilinen bir fenomen sonuçlanan bu kontrol fonksiyonu yoktur. Tedavi protokolleri değişken olmasına rağmen, yumuşak damağın cerrahi onarımı erken çocukluk (yaş 6-36 ay) 4 gerçekleşir. yumuşak damak anormal eklenen kasları cerrahi 5-7 düzeltilebilir, ancak velofaringeal disfonksiyon% 30% 7 devamHastaların 2,3,8-10 evi.
Uydu hücreleri (SCS) aksiyonu sayesinde yeniden oluşturmak için iskelet kası kabiliyeti de 11,12 kurulur. Kas hasarı üzerine, SCs aktive edilir ve yaralanma yerinde göç ederler. Daha sonra, çoğalırlar farklılaştırmak ve yeni myofibers veya onarım hasarlı olanları 13 oluşturmak için sigorta. Onların soyu, çoğalan miyoblastlar, ayrıca miyojenik belirleme faktörü 1 (MyoD) 16 ifade ederken hareketsiz SC'ler, transkripsiyon faktörü Pax7 14,15 ifade eder. Farklılaşan miyoblastlar 17 (MyoG) myogenin ifade başlar. miyoblastların terminal farklılaşma myofibers oluşumu ve bu miyozin ağır zincir (MyHC) 16,18 kas özel proteinlerin ekspresyonu ile işaretlenir.
Son zamanlarda, çeşitli stratejiler bacak kasları 19-23 kas rejenerasyonu arttırmak için rejeneratif tıpta kullanılmaktadır. Üzerine özel çalışmalarSon zamanlarda onlar çeşitli yönleriyle 24 diğer kasların farklı olduğu gösterilmiştir çünkü branchiomeric baş kasları da önemlidir. Bacak kaslarının aksine, bu branchiomeric kası az SC'ler 25 içeren yavaş yeniden, daha lifli bir bağ dokusu, aynı zamanda, diğer transkripsiyon faktörlerini ifade branchiomeric kafası kaslardan SC'ler çoğalan Buna ek olarak, yaralanma 26 sonrası meydana geldiği önerilmiştir. Örneğin, Tcf21 kraniofasiyel kas oluşumu için bir transkripsiyon faktörü kuvvetli baş kasları rejenere ancak pek bacak kasları 25 yenileyici olarak ifade edilir. CLP hastaların yumuşak damak kasları genellikle daha küçük ve daha az normal bir damak kasları 27,28 oranla iyi organize bulunmaktadır. Yavaş ve hızlı lifler hem yumuşak damak kasları mevcut ama yavaş lifler daha boldur. Buna karşılık, yarık kaslar da daha yüksek bir hızla liflerin oranı ve azaltılmış kılcal kaynağı ihtivaNormal yumuşak damak kasları 29-31 ile karşılaştırıldığında. Hızlı lifler daralma kaynaklı yaralanma 31-33 daha yatkındır. Ekteki kötü kılcal kaynağı da fibrozis 34,35 teşvik edebilir. Bütün bu yönleriyle cerrahi yarık kapatılması 36 sonra yumuşak damak kaslarının zayıf rejenerasyon katkıda bulunabilir. Bu göz önüne alındığında, branchiomeric baş kas SC'ler izolasyonu ve karakterizasyonu için bir protokol önemlidir. Bu branchiomeric baş kasların SC biyolojisi okumak için imkanı sağlar. Buna ek olarak, doku mühendisliği dayalı yeni tedaviler CLP ve kraniofasial alanı ödün diğer koşullarda ameliyat sonrası kas rejenerasyonu teşvik etmek geliştirilebilir.
Genel olarak, SCs kas dokusunun 14 ayırmadan sonra elde edilebilir. Kıyma, enzimatik sindirim, ve toz haline getirme genellikle niş SC'ler serbest bırakmak için gereklidir. SC'ler FR, kaplanmamış yemekler 14,37,38 ilgili ön plaka ile saflaştırılabiliractionation Percoll 39,40 tarihinde, fluorescent- veya manyetik veya hücre 41-43 sıralama. Burada genç erişkin sıçanların branchiomeric baş kasları uydu hücrelerin izolasyonu için yeni bir ekonomik ve hızlı bir protokol mevcut. Bu protokol daha önce el yazması 14 ve özellikle de küçük bir doku örnekleri için uyarlanmış dayanır. 1 st, 2 nci ve 4. branşiyal kemerlerin kaynaklanan temsili kaslar SC'ler izolasyonu açıklanmıştır. İzolasyondan sonra, uydu hücreleri düşük sayıda kendi farklılaşma çalışma milimetre büyüklüğü hücre dışı matris jel noktalar üzerinde kültürlenmiştir. Bu yaklaşım, SC'ler genişlemesi ve geçiş için gereksinimi ortadan kaldırır.
Protocol
Burada tarif Bütün deneyler Hollandalı yasa ve yönetmeliklere (RU-Aralık 2013-205) uyarınca Radboud Üniversitesi Nijmegen Hayvan Deneyleri Yerel Kurulu tarafından onaylanmıştır.
1. Ekstrasellüler Matriks Jel Spotlar
- Izolasyon önce aşağıdaki adımları bir gün gerçekleştirin:
- En az 1.5 saat için 4 ° C'de bir kısım hücre dışı matris jel (100 ul) çözülme. Dulbecco tadil edilmiş Eagle ortamı içinde 1:10 seyreltilir; 4500 mg / L glikoz, 4 mM L-glutamin ve 110 mg / ml sodyum piruvat (DMEM) ile. Her zaman, 4 ° C 'de hücre dışı matris jel tutun. Not: ani ısı değişimleri homojen olmayan kaplama ve kristal oluşumu ile sonuçlanacaktır.
- 15 dakika boyunca buz üzerinde seyreltilmiş hücre dışı matris jel çözeltisi tutun.
- 10 dakika boyunca 20 ul mikropipet önceden soğuk.
- 100 mm Petri kabı içine 8 oyuklu odasının slaytlar koyun ve 10 dakika boyunca soğuk bir yüzey (örneğin, bir dondurucu paket) üzerine yemek aktarın.
- Her bir 10 ul hücre dışı matriks jeli bir damla koymak önceden soğutulmuş mikropipet kullanın. En az bir 7 dakika (Şekil 1A) soğuk bir yüzey üzerinde Petri tutun.
- Tamamen geri kalan hücre dışı matris jel (Şekil 1B) kaldırmak ve bir gece boyunca 37 ° C'de kuyu kurutun.
2. Diseksiyon Başkanı kasları (Masseter, Digastrik ve levator Veli Palatini)
- Diseksiyon önce, fosfat tamponlu tuz çözeltisi,% 2 Penisilin-Streptomisin (P / S) ile desteklenmiş (PBS), 50 ml hazırlar. Buz üzerinde tutun.
- CO 2 / O 2 ile bir genç erişkin sıçan (9 hafta) ötanazi sonra, başını başını kesmek ve kafa deri kaldırmak. Buz soğukluğunda PBS kafa aktarın 50 ml'lik bir tüp içinde% 2, P / S ile takviye edilmiştir.
- (1 brankial kemer türetilmiş) masseter kas
- Bir silikon pad üzerinde bir tarafı yukarı ile baş koyun ve derialtı n düzeltmekeedles (Şekil 2A).
- Parotis bezi ve fasial sinir (Şekil 2A) tanımlayın. Bezi kapsayan derin fasya Açığa. Fasya kesin ve diseksiyon makas kullanılarak bezini çıkarın. Dış kulak yoluna tanımlayın. Stylomastoid foramenden yüz siniri Trace ve dikkatli bir neşter bıçağı sayılı 15, zamansal elmacık ve yanak dalları çıkarın.
- Fasya kaldırarak masseter kas yüzeysel kafasını boşaltın. Masseter kas yüzeysel ve derin hem de kafaları tanımlayın. Maksilla elmacık sürecinde takılı kalın tendon aponeurosis kadar yüzeysel kafa Trace.
- Düz forseps ile elmacık sürecinde kökeninden gelen tendon ayırın. Bir neşter bıçak sayılı 15 veya diseksiyon makas ve dikkatlice hayatın o (Şekil 2B) ile kesin.
- Kendi açıyla yerleştirilmesi ve t alt yarısına kadar masseter yüzeysel kafa teşriho bir neşter bıçağı sayılı 15 (Şekil 2C) ile mandibulanın ramus yüzeyini yanal. Şimdi tamamen kas çıkarın.
- (2. brankiyal kemer türetilmiş) digastricus'un arka göbek
- Silikon pad üzerinde yatar pozisyonda başını yerleştirin ve derialtı iğneler (Şekil 3A) ile sabitleyin.
- Dilaltı ve submandibular bezlerin hem örten cilt altı yağ çıkarın. Sonraki yüzeysel fasya ve diseksiyon makas kullanılarak bezleri kaldırın. Digastrik kas (anterior ve posterior karın) Açığa.
- Düz bir forseps ile arka karın ön tendonu tutun kesti ve timpanik bulla (Şekil 3B) aslına kadar dikkatlice incelemek. Karşı tarafta aynı yapın.
- (4th brankial kemer türetilmiş) levator veli palatini kas
- Digastricus'un arka göbek diseksiyonu sonrasıYanal çekin, Stylohyoid kas lokalize ve dikkatle (Şekil 4A) çıkarın.
- Timpanik bulla (Şekil 4A) de ekler levator veli palatini tendon yerelleştirilmesine. Dikkatle inceleyin ve her iki tarafta kesti.
- Trakea ve arkasında çalışan yemek borusu arayın. Özofagus kaldırın ve yutak, gırtlak ve yumuşak damak maruz kalmaktadır.
- Levator veli palatini takıldığında yumuşak damak alanını lokalize ve gevşek (Şekil 4B) kesti.
Not: Doğrudan diseksiyonu sonrası, dikkatlice stereo mikroskop altında her kas tendon ve bağ doku kaldırmak. Etanol% 70 hızlı bir şekilde tüm örnekler daldırın ve buz gibi soğuk PBS aktarmak bir 15 ml tüp içinde% 2, P / S ilave.
Uydu Hücreleri 3. İzolasyon
- Kas 3 gruba SC izolasyonu için aşağıdaki hazırlık adımları gerçekleştirin:
- DMEM içinde% 0.1 Pronaz 7.5 ml hazırlayın. 0.22 um'lik bir filtre ile solüsyon filtre. Izolasyondan önce, 10 dakika için bir su banyosu içinde 37 ° C'da, çözelti önceden ısıtın.
- Hazırlama% 10 at serumu (HS) ve% 1 P / S ile takviye edilmiş DMEM içinde 35 mi. Ayrıca ön-sıcak 37 ° C'de bir su banyosu içinde.
- % 20 fetal sığır serumu (FBS), 10% HS,% 1 P / S ve% 1 tavuk embriyo ekstraktı (CEE) ile desteklenmiş DMEM oluşur 15 ml kültür ortamı hazırlayın. Bir su banyosu içinde 37 ° C 'de sıcak bir ön.
- Ön kaplama altı plastik pipetler kullanımdan önce en az 10 dakika boyunca HS ile (10 mi) ve kuru.
- Kültür kaput, 6-çukurlu plaka içinde bir kuyu içine, her kas aktarın. Diseksiyon makas kullanılarak, yaklaşık 2 mm küçük parçalar halinde kas kesti. Doku çok kıyma için dikkatli olun.
- Dikkatli bir şekilde her kuyuya% 0.1 Pronaz çözeltisi 2.5 ml ilave edilir ve 60 dakika boyunca 37 ° C'de inkübe edin. Yavaşça 20, 40 ve 60 dakika sonra plaka sallayın. Not: Tam duratioİnkübasyondan n hayvanların yaş ve gerginlik gibi faktörlere bağlıdır.
- Mikroskop altında izleyin. Kas parçaları kontrol edin ve lifler demetleri bir gevşek görünüm (Şekil 5) olsun enzimatik sindirim durdurun.
- DMEM 2.5 mi,% 10 HS ve% 1 P / S ilave ekleyin. 5 dakika boyunca 400 x g'de 15 ml'lik bir tüp ve santrifüj tüpleri aktarın. Dekantasyon yoluyla süpernatant atın.
- % 10 HS ve% 1 P / S ile desteklenmiş 5 ml DMEM ekleyin. Doku homojenize için yukarı ve aşağı bir 10 ml plastik pipet (öğütüldükten) ile en az 20 kez çözüm pipetle.
- 4 dakika boyunca 200 x g'de tüpler santrifüjleyin. Süpernatan toplamak ve 15 ml'lik bir tüp içine aktarılır.
- % 10 HS ve% 1 P / S ile desteklenmiş 5 ml DMEM ekleyin. Pipet tekrar doku parçaları kadar 10 ml plastik pipet pipet aracılığıyla kolayca geçer.
- 4 dakika boyunca 200 x g'de santrifüj tüpleri ve 15 ml bir tüp içinde supernatant toplamak.
- P50 ml'lik bir tüp üzerine hücre süzgeç (40 mikron) ut ve filtre üzerine ayrışmış hücreleri içeren süpernatant aktarın. Maksimal hücre kurtarma için 1 ml DMEM ile yıkayın.
- 10 dakika boyunca 1.000 xg'de tüpler Santrifüj ve bir pipet ile süpernatant atın.
- 300 ul kültür ortamı içinde pelet yeniden süspanse edin ve bir hemositometrede hücreleri sayın.
Ekstrasellüler Matriks Jel Spotlar Uydu Hücreleri 4. Farklılaşma
- Kültür ortamında 10 ml içinde 1.5 x 10 3 hücreleri elde etmek için bir hücre süspansiyonu ile seyreltilir.
- Bantla odaları slaytlar kapakları Güvenli ve nesne camın alt tarafında siyah bir işaretleyici ile noktalar işaretleyin.
- Bir mikropipet kullanarak, hücre dışı matris jel nokta üzerine 10 ul hücre süspansiyonu bir damla koydu. Hücre süspansiyonu damla yerinde doğru yerleştirilmiş olup olmadığını mikroskop altında kontrol edin. 37 ° C'de altı saat boyunca inkübe edin.
- Dikkatlily kültür ortamında (% 20 FBS ile takviye edilmiş DMEM,% 10 HS,% 1 P / S ve% 1 OA) 400 ul ve 37 ° C'de üç gün süre ile inkübe edilir.
Not: Bu noktada, taze izole SC kitlesel travma (enzimatik sindirimi ve sert triturasyondan) tabi ve kurtarmak için ihtiyacı vardır. Ilk üç gün 37. Sonraki boyunca hücrelerin rahatsız etme, kültür ortamı, deney tipine bağlı olarak değiştirilebilir.
hücre dışı matris jel lekeleri farklılaşma deneyinde yüksek bir hücre yoğunluğuna (1.5-2.5 x 10 3/20 ul) ile tohumlanır edilebilir. Kültür ortamı (DMEM% 20 FBS,% 10 HS,% 1 P / S ve% 1 tavuk embriyo ekstresi ile takviye edilmiş), her üç günde bir ikame edilmiş olabilir. - Genişleme ve geçen isteniyorsa Alternatif olarak, bir sonraki adımları izleyin:
- En az 1.5 saat için 4 ° C'de bir kısım hücre dışı matris jel (500 ul) çözülme. DMEM 01:10 seyreltin ve nokta 1.1.1 önerileri uygulayın.
- 4 ve 10 dakika boyunca 10 ml'lik bir pipet önceden soğuk# 176; C.
- 10 dakika boyunca soğuk bir yüzey (örneğin, bir dondurucu paket) üzerine üç adet T75 balonlarına aktarın.
- Her balona 1 ml hücre dışı matriks jel koymak önceden soğutulmuş pipet kullanın. Yüzeyi tamamen kapalı olup olmadığını kontrol edin. En azından başka 7 dk (Şekil 1A) için soğuk yüzey üzerinde şişeler tutun.
- Tamamen 10 ml pipet kalan hücre dışı matris jel kaldırmak ve 1 saat boyunca 37 ° C'de kuyu kurutun.
- Sayılmasından sonra, kültür ortamı önceden kaplanmış T75 şişelerinde tohum (% 20 FBS,% 10 HS,% 1 P / S ve% 1 tavuk embriyo ekstresi ile takviye edilmiş DMEM), 10 ml taze izole edilmiş SC'ler yeniden süspanse edin.
- Üç gün sonra,% 80 izdiham kadar orta (ve her üçüncü gün) değiştirebilirsiniz ulaşılır. Geçirilmesi için PBS ile T75 balonlarına üç kez yıkayın. Sonraki 1 mL% 0.25 tripsin solüsyonu ekleyin ve 37 ° C'de üç dakika boyunca inkübe edin. Kültür ortamının 9 ml içinde süspanse edin (DMEM,% 10 HS,% 1 P / S,% 20 FBS ile takviye edilmişve% 1 tavuk embriyo özü) ve 5 dakika 200 x g'de santrifüje tabi tutun. Süpernatantı atın. Sayılmasından sonra, kültür ortamı 1000 ul içinde 1 x 10 6 hücre tekrar süspansiyon ve hücreler dondurma.
Representative Results
Bu protokolü kullanarak, masseter kası (tek taraf) 0.8-1 x 10 6 hücre, digastrik kas (arka göbek) 1.5-2 x 10 5 hücre verimleri ve levator veli palatini kas verimi 1-1.5 x 10 5 hücre verir. Hücre verimleri hayvanın kas tipi, zorlanma ve yaş bağlıdır. Üç kas grupları arasında karşılaştırma için, yeni izole edilmiş SC'ler aynı hücre yoğunluğu (1.5 x 10 3/10 ul) tohumlanmıştır. Doğrudan izolasyonundan sonra, yeni izole edilmiş hücrelerin% 90'ından fazlası Pax7 (Şekil 6) ifade etmektedir.
Gün 4, 7 ve 10 kültürleri Pax7, MyoD, MyoG ve MyHC immün karşı antikorlar ile boyandı. Beş rasgele alanları bir 20x objektif kullanarak kültür başına sayılmıştır. 4. günde Pax 7 ve Myo D tüm kas grupları olarak ifade edilir (Şekil 6 ve 7 ve 8), masseter ve digastrik kaslardan SATC nin ancak döl Expres başlarmyogenin önce levator veli palatini kası (Şekil 9) daha şarkı. 10. günde, MyoG sentezlenmesi güçlü Tüm gruplarda (Şekil 9) azalır. Birkaç gün hücre dışı matris jel noktalar üzerinde tohumlama sonra, hızla çoğalan hücreleri sigorta ve miyozin ağır zincir ifade eden çok çekirdekli miyotüpler, oluşmaya başlar. Küçük miyotüpleri günde 7 (Şekil 10) açıkça görebilir. 10. günde, miyotüplerinin seğirmesi (video 1) görülebilir.

Şekil 1:. Bir oda slayt Ekstraselüler matriks jel noktalar (A) kolay manipülasyon için, 100 mm Petri kabı içine 8-iyi odasının slayt yerleştirin. Pipet 10 ul hücre dışı matriks her odasında jel ve soğuk bir yüzeye (7 dk) üzerine koydu. (B) aşırı hücre dışı matris g sonrasında Odası slaytEl kaldırılır.

Şekil 2:. Lateral görünümde hayvanın maseter kası Diseksiyon (A) Baş. Kulak (E), parotis bezi (P) ve fasial sinir (VII). (B) maseter kası (Ms) ve temporal kas (T) yüzeysel kafasının tendineae aponevrozu (Te). Bir forseps ile ekleme gelen tendon ayırın. (C) dikkatlice mandibula ramus onun ekleme kadar kas teşrih. E: kulak, P: parotis, VII: fasial sinir, T: Temporal kas, Ms: masseter kas, Te yüzeysel başkanı: tendon, Mp: masseter kas derin başkanı.

Şekil 3: digastricus'un arka karın diseksiyonu (.Bir yatar pozisyonda hayvanın A) Başkanı. Submandibular bezi (Tr), masseter kası (M), fasial sinir (VII) ve SKM kas (SCM) yerelleştirilmesine. Submandibular bezi çıkarın. (B) digastrik kas anterior (AD) ve posterior karın (PD) yerelleştirilmesine. Düz forseps ile, arka karnının ön tendonu almak onu kesmek ve timpanik bulla (ty), aslına kadar dikkatlice incelemek. E: kulak, Sg: submandibular bez, VII: fasial sinir, M: masseter kası, SMC: sternocleidomastoid kas, AD: ön göbek digastrik kas, PD: arka göbek digastrik kas, Ty: Kulak bül.

Şekil 4:. Levator veli palatini kas diseksiyonu (A) digastricus'un (arka göbek) diseksiyonu sonrası genel görünümü. Stylohyoid kası (St) ve levator tendonveli palatini lokalize edilebilir. Bunun arkasında çalışan trakea (T) ve yemek borusu (Es) unutmayın. Trakea ve farenks (P) maruz yemek borusu kaldırılmasından sonra (B). yumuşak damak içine levator veli palatini sokulması artık görünür. ok her iki tarafta levator veli palatini kasları ile disseke yumuşak damak gösterir. E: kulak, St: Stylohyoid kas, VII: fasial sinir, M: masseter kası, AD: ön göbek digastrik kas, PD: arka göbek digastrik kas, T: trakea, Es: özofagus, P: Yutak, * levator veli palatini kası .

Şekil 5: Pronaz ile enzimatik sindirme önce sonra kas dokusunda (A) Görüntü ve (B). Kas demetleri enzimatik sindirimi sonra gevşetti gibi göründüğüne dikkat edin.
Şekil 6: Pax 7 immün izolasyon sonunda hücre dışı matris jel tatbik Taze izole SC'ler (yaklaşık 6 saat, ilk doku sindirilmesinden sonra).. Beş rasgele alanları alan başına 210 hücre ortalama 10X objektif kullanılarak sayıldı. Hücrelerin yaklaşık% 90 pozitif Pax 7 vardır. DAPI: mavi, Pax7: Kırmızı. Ölçek çubuğu, 100 mikron.

Şekil 7:. Pax 7, MyoD immün Gün 4, 7 ve 10 kültürleri Pax7 karşı antikorlar ve MyoD immün boyandı. (A - C) ve (D - F) 4 gün arasında Temsil edici fotomikrografikler ve maseter kası 7 kültürleri. (G ve H + ve MyoD + mikroskobik alan başına çekirdek sayısı sayılmış ve çekirdeklerin sayısı (DAPI) bir yüzdesi olarak ifade edildi. DAPI: mavi, Pax7: kırmızı, ve MyoD: yeşil. Ölçekler bar, 100 mikron. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.

Şekil 8:. Masseter, digastrik ve levator veli palatin kas kültürlerde tek çekirdekli hücrelerden kültürlerinde Pax7 ± / MyoD ± dağılımı (A - C) Gün 4, 7 ve 10 kültürleri Pax7 karşı antikorlar ve MyoD immün boyandı. Toplam hücre sayısı, çekirdeklerin sayısı (DAPI) dayanmaktadır. (D) cel ± Pax7 ± / myod Veri ölçümüls. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.

Şekil 9:. Myogenin immün Gün 4, 7 ve 10 kültürleri Myogenin karşı antikorlar ile boyandı. (A - D) Temsili günde 4 fotomikrografları ve levator veli palatin kası 7 kültürler. (E) MyoG + mikroskobik alan başına çekirdek sayısı sayılmış ve çekirdeklerin sayısı (DAPI) bir yüzdesi olarak ifade edildi. MyoG + hücreleri (F) veri miktar. DAPI: mavi, Myogenin: yeşil. Ölçekler bar, 100 mikron. Bu figur büyük halini görmek için tıklayınıze.

Şekil 10:. Miyozin ağır zincir immün Gün 4, 7 ve 10 kültürleri miyozin ağır zincir (MyHC) karşı antikorlar ile boyandı. Temsili günde 4, 7 fotomikrografları ve digastrik (DIG) kas 10 kültürler. Günde 10 uzun ve iyi organize miyotüpleri belirgin iken 7. günde, küçük miyotüpleri mevcuttur. Ölçekler bar, 200 mikron. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
Video 1.:. Miyotüp seğirmesi seğirmesi miyotüplerinin iki temsilci alanların örnekleri günü için digastricus'un 10 kültürleri gösterilir Bu videoyu görmek için lütfen buraya tıklayınız.
Discussion
Farklı branchiomeric kafa kaslardan SC'ler önce genişleme ve Pasajlanması olmadan tek 9 haftalık Wistar sıçan ve hücre dışı matris jel noktalar doğrudan kültüre izole edilmiştir. İzolasyondan sonra, hücreler sayılmış ve aynı hücre yoğunluğunda tohumlanır. Üç farklı kas paralel izolasyonu için, bu yöntem, yaklaşık 4 saat sürer. Kültür kirlenmesini önlemek için, kritik bir adımdır kasların diseksiyonu sonrası alkol% 70 hızlı yıkama olduğunu.
SC izolasyonu sırasında küçük parçalar halinde kas dokusu (yaklaşık 2 mm) kesilmiş fakat bu, bir hücre hasarı küçük hücreli verimle sonuçlanacak şekilde çok Kıyma önlemek için önemlidir. Ayrıca, enzimatik sindirim süresi daha fazla zarar görmesini önlemek için mikroskop altında dikkatlice kontrol edilmelidir. sindirim amacı myofibers ayırmak olduğunu. İzole hücrelerin% 90'ından fazlası Pax7 ifade için, başka bir saflaştırma (Şekil 6-8) gereklidir.Bu tür Percoll 39,40 üzerinde kaplanmamış yemekleri 14,37,38 öncesi kaplama, fraksiyon gibi diğer yöntemlerle ekstra arıtma adımlarını önler, fluorescent- veya manyetik veya hücre 41,43 sıralama. Toz haline için, bu SC'ler mekanik serbest bırakılmasına izin doku parçaları ve pipet ucu açıklığı arasında kesme yaratmaması için gereklidir. (İç çapı: 1 mm), 10 ml bir pipet ile toz haline getirme durumunda zor, (İç çapı: 2 mm) 5 ml'lik bir pipetten, ilk kullanılabilir. Seçenek olarak ise, bir cam Pasteur pipet arzu edilen çapta kesilebilir ve kullanılabilir. Bu yöntem, etkili basit ve farklı kas örnekleri SC eş zamanlı izolasyonu sağlar.
SC'ler için kültür plakaları da jelatin ya da kolajen ile kaplanmış olabilir, ama daha önceki çalışmalar, hücre dışı matris jel kollajen 38 daha miyojenik potansiyelinin korunması için çok daha iyi olduğunu göstermektedir. hücre dışı matriks jel noktalarmilimetre boyutu (10 ul / Ø 2 mm veya 20 ul / Ø 4 mm) çoğalması ve hücrelerin sınırlı sayıda olan SC'ler farklılaşma çalışma sağlar. Farklılaşma deneyi için yaklaşık 8-20 kat daha az hücre, bir 24 oyuklu plaka (çap 15,6 mm) ile karşılaştırıldığında gereklidir ve daha az yaklaşık 80-200 kat 35 mm Petri kapları (çap: 35 mm) 14,38 ile karşılaştırıldığında.
Hücre dışı matris jel pahalı olduğundan, bu yöntem aynı zamanda daha maliyet-etkin olduğunu. Buna ek olarak, bölmeli lamlar plastik örtü ile ikame edilmiş olabilir daha maliyetlerini azaltmak için kayar. Hücre dışı matriks jel hazırlanması için oda slaytlar gecede kurutma esastır görür. Hücre dışı matris jel noktalar saydam olarak, aydınlatma geri kullanılarak alt tarafındaki yeri işaretlemek için gereklidir. odaları slaytlar kolay manipülasyon için bir Petri kabındaki sabittir. Daha fazla hücre kültürü genişletme Smal SCS çalışma imkanı sunduğu gerekli değildir,kasları veya küçük kas örnekleri Ler. Seçenek olarak, PCR ya da kas için, örneğin daha fazla hücre gerekli ise, yukarıda belirtildiği gibi, yeni izole edilmiş SC'ler ilk T75 şişelerinde genişletilebilir oluşturur.
SC'ler Bu protokol kullanılarak izole hemen sonra akış sitometrisi ile daha fazla saflaştırılması için uygun değildir izole edilmiştir. Pronaz ile sindirme yüzeyinin geniş sindirimi 14 antijenleri neden olur. Farklı lot numaraları farklı şekilde miyoblastlar proliferasyonunu ve farklılaşmasını etkilenen hücre kültürü için kullanılan at serumu ve fetal inek serumu ilk düzgün, izolasyondan önce, özelliği olmalıdır.
Son yıllarda, brankial kemerler ve baş mezoderm (örneğin göz dışı kaslar) 24 türetilen kasların artan bir ilgi var. Açıkça baş ve bacak kasları çok farklı özelliklere sahip olduğu gösterilmiştir. Eski hayvanlardan masseter kası yeniden görünüyorbacak kasları 25,26 ile karşılaştırıldığında onların rejeneratif kapasitesini tain. Göz dışı kaslarının gelen SC'ler kafa kaslardan SC'ler karşılaştırılabilir sağlam bir çoğalma ve farklılaşma kapasitesine sahip ve bacak kas SC'ler 24 daha büyük engraftmınt potansiyeli gösteriyor.
lif tipi dağılımı ve miyozin kompozisyonu, kas grupları arasında ve aynı zamanda türler arasında değişmektedir. İnsanlarda ilk branşiyal kemer kaynaklanan Kaslar kalp kası geliştirmek için tipik yavaş ve hızlı hem de lifler (alt tiplerini IIA ve IIX), yenidoğan miyosinler ve miyosinler içerirler. Kemirgenlerde bu kaslar yaklaşık% 95 hızlı lifler miyozin IIA ve IIb) 44-46 içerirler. Kuş kaslar üzerinde yapılan çalışmalar, farklı kas lifi türlerinden SC'ler farklılaşma kapasitesi değişir olduğunu göstermektedir. Yavaş liflerden SC'ler hem elyaf türleri 47 ayırt süre hızlı lifler SC'ler sadece hızlı kas lifleri ayırt. Buna ek olarak, hızlı bir kas SC'ler yüzdesilifler, düşük kas lifleri 48,49 daha düşüktür. Bu lif tipi dağılımı kraniofasyal alanda kasları üzerinde çalışmalar için dikkate alınması gerektiğini göstermektedir. Yarık damak kasları benzer kemirgenlerde LVP hızlı optikleri 50 neredeyse sadece içerir. Bu nedenle, LVP gelen SC'ler yarık damak alanı içindeki ön-klinik çalışmalar için uygundur.
Bu protokol branchiomeric baş kas veya diğer küçük kaslar veya daha küçük kaslar örneklerinden elde edilen SC'ler incelemek için yeni imkanlar sunuyor. Bu tür yarık damak olarak değil, aynı zamanda daha küçük kasları etkileyen diğer koşullarda şartlarda maksillofasiyal bölgedeki kasların yenilenmesini artırmak için yeni tedavilerin geliştirilmesini kolaylaştıracaktır.
Materials
| Name | Company | Catalog Number | Comments |
| Hypodermic Needle 25 G 0.5 x 25 m | BD Microlance | 300400 | |
| Dissecting scissors | Braun | BC154R | |
| Micro forceps straight | Braun | BD330R | |
| Surgical Scalpel Blade No. 15 | Swann-Morton | 0205 | |
| Alcohol 70% | Denteck | 2,010,005 | |
| Permanox Slide, 8 Chamber | Thermo Scientific | 177445 | |
| 6 well cell culture plate | Greiner bio-one | 657160 | |
| Cell Culture Dishes (100 x 20 mm) | Greiner bio-one | 664160 | |
| 15 ml sterile conical centrifuge tube | BD Biosciences | 352097 | |
| 50 ml sterile conical centrifuge tube | BD Biosciences | 352098 | |
| Cell strainer (40 μm) | Gibco | 431750 | |
| 10 ml serological pipette | Greiner bio-one | 607180 | |
| 20 µl FT20 | Greiner bio-one | 774288 | |
| Matrigel, Phenol-Red Free | BD Biosciences | 356237 | 10 ml |
| Pronase | Calbiochem | 53702 | 10 KU |
| Phosphate Buffered Saline | Gibco | 14190-144 | 500 ml |
| Dulbecco's Modified Eagle Medium, high glucose, GlutaMAX Supplement, pyruvate | Gibco | 10569-010 | 500 ml |
| Fetal Bovine Serum | Fisher Scientific | 3600511 | 500 ml |
| Horse Serum | Gibco | 26050088 | 500 ml |
| Penicillin-Streptomycin (10,000 U/ml) | Gibco | 15140-122 | 100 ml |
| Chicken Embryo Extract | MP Biomedicals | 2850145 | 20 ml |
References
- Gritli-Linde, A. Molecular control of secondary palate development. Developmental Biology. 301, 309-326 (2007).
- Marrinan, E. M., LaBrie, R. A., Mulliken, J. B. Velopharyngeal function in nonsyndromic cleft palate: relevance of surgical technique, age at repair, and cleft type. The Cleft Palate-Craniofacial Journal. 35, 95-100 (1998).
- Morris, H. L. Velopharyngeal competence and primary cleft palate surgery, 1960-1971: a critical review. The Cleft Palate Journal. 10, 62-71 (1973).
- Mossey, P. A., Little, J., Munger, R. G., Dixon, M. J., Shaw, W. C. Cleft lip and palate. Lancet. 374, 1773-1785 (2009).
- Boorman, J. G., Sommerlad, B. C. Musculus uvulae and levator palati: their anatomical and functional relationship in velopharyngeal closure. British Journal of Plastic Surgery. 38, 333-338 (1985).
- Bae, Y. C., Kim, J. H., Lee, J., Hwang, S. M., Kim, S. S. Comparative study of the extent of palatal lengthening by different methods. Annals of Plastic Surgery. 48, 359-362 (2002).
- Braithwaite, F., Maurice, D. G. The importance of the levator palati muscle in cleft palate closure. British Journal of Plastic Surgery. 21, 60-62 (1968).
- Inman, D. S., Thomas, P., Hodgkinson, P. D., Reid, C. A. Oro-nasal fistula development and velopharyngeal insufficiency following primary cleft palate surgery--an audit of 148 children born between 1985 and 1997. British Journal of Plastic Surgery. 58, 1051-1054 (2005).
- Phua, Y. S., de Chalain, T. Incidence of oronasal fistulae and velopharyngeal insufficiency after cleft palate repair: an audit of 211 children born between 1990 and 2004. The Cleft Palate-Craniofacial Journal. 45, 172-178 (1990).
- Kirschner, R. E., et al. Cleft-palate repair by modified Furlow double-opposing Z-plasty: the Children's Hospital of Philadelphia experience. Plastic and Reconstructive Surgery. 104, 1998-2010 (1999).
- Mauro, A. Satellite cell of skeletal muscle fibers. The Journal of Biophysical and Biochemical Cytology. 9, 493-495 (1961).
- Yablonka-Reuveni, Z. The skeletal muscle satellite cell: still young and fascinating at 50. The Journal of Histochemistry and Cytochemistry. 59, 1041-1059 (2011).
- Ten Broek, R. W., Grefte, S., Von den Hoff, J. W. Regulatory factors and cell populations involved in skeletal muscle regeneration. Journal of Cellular Physiology. 224, 7-16 (2010).
- Danoviz, M. E., Yablonka-Reuveni, Z. Skeletal muscle satellite cells: background and methods for isolation and analysis in a primary culture system. Methods in Molecular Biology. 798, 21-52 (2012).
- Seale, P., et al. Pax7 is required for the specification of myogenic satellite cells. Cell. 102, 777-786 (2000).
- Yablonka-Reuveni, Z., et al. The transition from proliferation to differentiation is delayed in satellite cells from mice lacking MyoD. Developmental Biology. 210, 440-455 (1999).
- Zammit, P. S., Partridge, T. A., Yablonka-Reuveni, Z. The skeletal muscle satellite cell: the stem cell that came in from the cold. The Journal of Histochemistry And Cytochemistry. 54, 1177-1191 (2006).
- Andres, V., Walsh, K. Myogenin expression, cell cycle withdrawal, and phenotypic differentiation are temporally separable events that precede cell fusion upon myogenesis. The Journal of Cell Biology. 132, 657-666 (1996).
- Fukushima, K., et al. The use of an antifibrosis agent to improve muscle recovery after laceration. The American Journal of Sports Medicine. 29, 394-402 (2001).
- Grefte, S., Kuijpers-Jagtman, A. M., Torensma, R., Von den Hoff, J. W. Skeletal muscle fibrosis: the effect of stromal-derived factor-1α-loaded collagen scaffolds. Regenerative Medicine. 5, 737-747 (2010).
- Jackson, W. M., Nesti, L. J., Tuan, R. S. Potential therapeutic applications of muscle-derived mesenchymal stem and progenitor cells. Expert Opinion on Biological Therapy. 10, 505-517 (2010).
- Sato, K., et al. Improvement of muscle healing through enhancement of muscle regeneration and prevention of fibrosis. Muscle, & Nerve. 28, 365-372 (2003).
- Tatsumi, R., Anderson, J. E., Nevoret, C. J., Halevy, O., Allen, R. E. HGF/SF is present in normal adult skeletal muscle and is capable of activating satellite cells. Developmental Biology. 194, 114-128 (1998).
- Stuelsatz, P., et al. Extraocular muscle satellite cells are high performance myo-engines retaining efficient regenerative capacity in dystrophin deficiency. Developmental biology. , (2014).
- Ono, Y., Boldrin, L., Knopp, P., Morgan, J. E., Zammit, P. S. Muscle satellite cells are a functionally heterogeneous population in both somite-derived and branchiomeric muscles. Developmental Biology. 337, 29-41 (2010).
- Pavlath, G. K., et al. Heterogeneity among muscle precursor cells in adult skeletal muscles with differing regenerative capacities. Developmental Dynamics. 212, 495-508 (1998).
- Koo, S. H., Cunningham, M. C., Arabshahi, B., Gruss, J. S., Grant, J. H. 3rd The transforming growth factor-beta 3 knock-out mouse: an animal model for cleft palate. Plastic and Reconstructive Surgery. 108, 938-948 (2001).
- Fara, M., Brousilova, M. Experiences with early closure of velum and later closure of hard palate. Plastic and Reconstructive Surgery. 44, 134-141 (1969).
- Lindman, R., Paulin, G., Stal, P. S. Morphological characterization of the levator veli palatini muscle in children born with cleft palates. The Cleft Palate-Craniofacial Journal. 38, 438-448 (2001).
- Hanes, M. C., et al. Contractile properties of single permeabilized muscle fibers from congenital cleft palates and normal palates of Spanish goats. Plastic and Reconstructive Surgery. 119, 1685-1694 (2007).
- Rader, E. P., et al. Contraction-induced injury to single permeabilized muscle fibers from normal and congenitally-clefted goat palates. The Cleft Palate-Craniofacial Journal. 44, 216-222 (2007).
- Rader, E. P., et al. Effect of cleft palate repair on the susceptibility to contraction-induced injury of single permeabilized muscle fibers from congenitally-clefted goat palates. The Cleft Palate-Craniofacial Journal. 45, 113-120 (2008).
- Macpherson, P. C., Dennis, R. G., Faulkner, J. A. Sarcomere dynamics and contraction-induced injury to maximally activated single muscle fibres from soleus muscles of rats. The Journal of Physiology. 500 (Pt 2), 523-533 (1997).
- Koch, K. H., Grzonka, M. A., Koch, J. The pathology of the velopharyngeal musculature in cleft palates). Annals of Anatomy. 181, 123-126 (1999).
- Fara, M., Dvorak, J. Abnormal anatomy of the muscles of palatopharyngeal closure in cleft palates: anatomical and surgical considerations based on the autopsies of 18 unoperated cleft palates. Plastic and Reconstructive Surgery. 46, 488-497 (1970).
- Carvajal Monroy, P. L., Grefte, S., Kuijpers-Jagtman, A. M., Wagener, F. A., Von den Hoff, J. W. Strategies to Improve Regeneration of the Soft Palate Muscles After Cleft Palate Repair. Tissue Engineering. Part B, Reviews. , (2012).
- Grefte, S., Kuijpers, M. A., Kuijpers-Jagtman, A. M., Torensma, R., Von den Hoff, J. W. Myogenic capacity of muscle progenitor cells from head and limb muscles. European Journal of Oral Sciences. 120, 38-45 (2012).
- Grefte, S., Vullinghs, S., Kuijpers-Jagtman, A. M., Torensma, R., Von den Hoff, J. W. Matrigel but not collagen I, maintains the differentiation capacity of muscle derived cells in vitro. Biomedical Materials. 7, 055004 (2012).
- Kastner, S., Elias, M. C., Rivera, A. J., Yablonka-Reuveni, Z. Gene expression patterns of the fibroblast growth factors and their receptors during myogenesis of rat satellite cells. The Journal of Histochemistry and Cytochemistry. 48, 1079-1096 (2000).
- Yablonka-Reuveni, Z., Quinn, L. S., Nameroff, M. Isolation and clonal analysis of satellite cells from chicken pectoralis muscle. Developmental Biology. 119, 252-259 (1987).
- Sherwood, R. I., et al. Isolation of adult mouse myogenic progenitors: functional heterogeneity of cells within and engrafting skeletal muscle. Cell. 119, 543-554 (2004).
- Gilbert, P. M., et al. Substrate elasticity regulates skeletal muscle stem cell self-renewal in culture. Science. 329, 1078-1081 (2010).
- Motohashi, N., Asakura, Y., Asakura, A. Isolation culture, and transplantation of muscle satellite cells. Journal of Visualized Experiments. , (2014).
- Sciote, J. J., Horton, M. J., Rowlerson, A. M., Link, J. Specialized cranial muscles: how different are they from limb and abdominal muscles. Cells, Tissues, Organs. 174, 73-86 (2003).
- Rowlerson, A., Mascarello, F., Veggetti, A., Carpene, E. The fibre-type composition of the first branchial arch muscles in Carnivora and Primates. Journal of Muscle Research and Cell Motility. 4, 443-472 (1983).
- Muller, J., et al. Comparative evolution of muscular dystrophy in diaphragm, gastrocnemius and masseter muscles from old male mdx mice. Journal of Muscle Research and Cell Motility. 22, 133-139 (2001).
- Feldman, J. L., Stockdale, F. E. Skeletal muscle satellite cell diversity: satellite cells form fibers of different types in cell culture. Developmental Biology. 143, 320-334 (1991).
- Schmalbruch, H., Hellhammer, U. The number of nuclei in adult rat muscles with special reference to satellite cells. The Anatomical Record. 189, 169-175 (1977).
- Gibson, M. C., Schultz, E. The distribution of satellite cells and their relationship to specific fiber types in soleus and extensor digitorum longus muscles. The Anatomical Record. 202, 329-337 (1982).
- Carvajal Monroy, P. L., et al. A rat model for muscle regeneration in the soft palate. PloS One. 8, e59193 (2013).
Tags
Gelişimsel Biyoloji Sayı 101 Baş kasları levator veli palatini kası digastrik kas masseter kası uydu hücreleri izolasyon birincil hücreler yarık damak rejeneratif tıp doku mühendisliği hücreler farklılaşma myofibers kökErratum
Formal Correction: Erratum: Isolation and Characterization of Satellite Cells from Rat Head Branchiomeric Muscles
Posted by JoVE Editors on 10/01/2015.
Citeable Link.
An erratum was issue for Isolation and Characterization of Satellite Cells from Rat Head Branchiomeric Muscles. The fourth figure was updated to explain the isolation of the LVP better.
Steps 2.5.3 and 2.5.4 were updated from:
2.5.3. Look for the trachea and the esophagus that runs behind it. Lift the esophagus, and expose the pharynx, larynx and the soft palate.
2.5.4. Localize the area of the soft palate where the levator veli palatini is inserted and cut it loose (Figure 4B).
to
2.5.3. Look for the trachea and the esophagus that runs behind it. Lift the esophagus, and expose the pharynx and the larynx.
2.5.4 Localize and dissect the area of the superior pharyngeal constrictor muscle. Identify the levator veli palatini and cut it at both sides (Figure 4B).
Figure 4 and its legend were updated from:
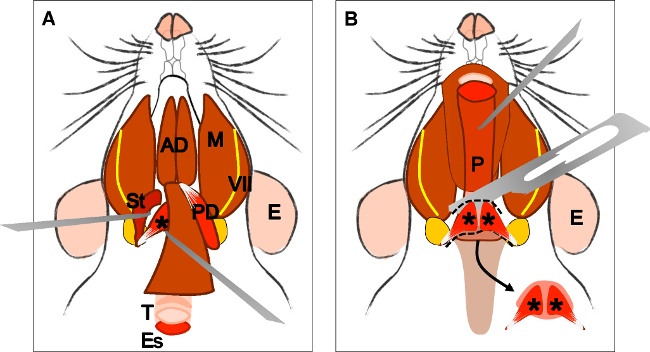
Figure 4: Dissection of the levator veli palatini muscle. (A) General view after dissection of the digastric muscle (posterior belly). Stylohyoid muscle (St) and tendon of the levator veli palatini can be localized. Note the trachea (T) and esophagus (Es) running behind it. (B) After lifting the trachea and the esophagus the pharynx (P) is exposed. The insertion of the levator veli palatini into the soft palate is now visible. The arrow indicates the dissected soft palate with the levator veli palatini muscles at both sides. E: ear, St: stylohyoid muscle, VII: facial nerve, M: masseter muscle, AD: anterior belly digastric muscle, PD: posterior belly digastric muscle, T: trachea, Es: esophagus, P: Pharynx, *levator veli palatini muscle.
to
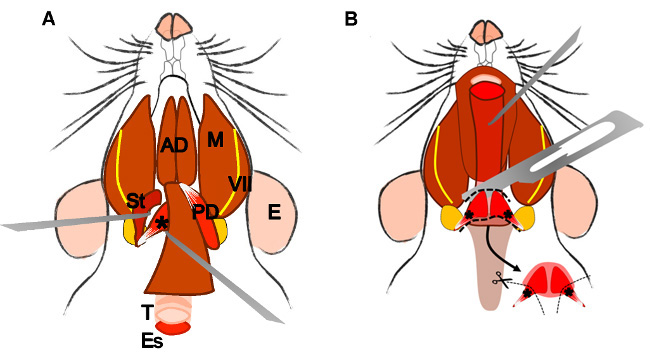
Figure 4: Dissection of the levator veli palatini muscle. (A) General view after dissection of the digastric muscle (posterior belly). Stylohyoid muscle (St) and tendon of the levator veli palatini can be localized. Note the trachea (T) and esophagus (Es) running behind it. (B) After lifting the trachea and the esophagus the pharynx (P) is exposed. The levator veli palatini that runs laterally towards the soft palate is now visible. The arrow indicates the dissected superior pharyngeal constrictor muscle; note the levator veli palatini muscles at both sides. E: ear, St: stylohyoid muscle, VII: facial nerve, M: masseter muscle, AD: anterior belly digastric muscle, PD: posterior belly digastric muscle, T: trachea, Es: esophagus, P: Pharynx, *levator veli palatini muscle.



