Summary
بروتوكول المناعي غير المباشر الموضحة في هذه المقالة يسمح للكشف وتوطين البروتينات في الغدة الثديية الماوس. ويرد طريقة الكامل لتحضير عينات الغدة الثديية، لأداء المناعية، لصورة أقسام الأنسجة بواسطة المجهر مضان، وإعادة بناء الصور.
Abstract
يستخدم المناعي غير المباشر لكشف وتحديد البروتينات من الفائدة في الأنسجة. بروتوكول المعروضة هنا يصف طريقة كاملة وبسيطة للكشف المناعي للبروتينات، والفأر المرضعات الغدة الثديية التي يجري اتخاذها كمثال على ذلك. بروتوكول لإعداد عينات الأنسجة، وخاصة فيما يتعلق تشريح الغدة الثديية الماوس، تثبيت الأنسجة وباجتزاء الأنسجة المجمدة، ومفصل. بروتوكول قياسي لأداء المناعي غير المباشر، بما في ذلك خطوة استرجاع مستضد الاختيارية، ويقدم أيضا. وذكر أيضا مراقبة أقسام الأنسجة وصفت وكذلك الحصول على الصور والمعالجات اللاحقة. يعطي هذا الإجراء لمحة كاملة، من مجموعة من الأنسجة الحيوانية لتوطين الخلوية من البروتين. على الرغم من أن هذه الطريقة العامة التي يمكن تطبيقها على عينات الأنسجة الأخرى، فإنه يجب أن تتكيف مع كل نسيج / الابتدائية زوجين الأجسام المضادة التي شملتها الدراسة.
Introduction
الغدة الثديية هي شاذة إفرازات الجهاز الثدييات التي هي لإنتاج الحليب لتغذية الأطفال حديثي الولادة وظيفة الرئيسي. تطوير أنسجة الثدي تحدث بشكل رئيسي بعد الولادة وتتميز عملية فريدة من نوعها فيها ظهارة يغزو سدى المحيطة بها. هذا النسيج يخضع العديد من التغييرات (النمو، والتمايز والانحدار)، وخصوصا خلال حياة الكبار، بالتزامن مع وجود اختلافات في حالة الإنجاب (الشكل 1). بالإضافة إلى التشكل العام للأنسجة، ونسب أنواع مختلفة من الخلايا وكذلك ترتيبها داخل الغدة الثديية تتغير بشكل كبير خلال تطوير 1-5.
خلال الحياة الجنينية، وظهارة الثديية مستمد من خطوط حليب الثدي، والتي تم تعريفها من قبل سماكة طفيفة والطبقية من الأديم الظاهر، وبين الصدارة والخلفية أطرافه على كل جانب من خط الوسط حول يوم الجنينية 10.5 (E10.5) (الشكل 1A ).على E11.5، خط الحليب تتكسر إلى اللوحاءات الفردية، والتي تتمركز بشكل متناظر على طول الخط حليب الثدي في مواقع قابلة للتكرار، واللحمة المتوسطة المحيطة يبدأ تتكثف. واللوحاءات تبدأ في الغرق أعمق في الأدمة وتنظم اللحمة المتوسطة الثديية في طبقات متحدة المركز حول برعم الثدي (E12.5-E14.5). اعتبارا من E15.5، ظهارة الثديية، ويبدأ في الانتشار واستطال لتشكيل برعم الرئيسي الذي يدفع من خلال اللحمة المتوسطة الثديية نحو لوحة الدهون. تنبت الأساسي يطور التجويف جوفاء مع الانفتاح على الجلد، والتي تمثلت في تشكيل غمد الحلمة. على E18.5، نمت القناة التمطيط في لوحة الدهون وتشعبت إلى نظام الأقنية مفرغة صغيرة شملت في لوحة الدهون. تم القبض على التنمية أساسا، ويبقى الغدة الثديية البدائية هادئة morphogenetically حتى سن البلوغ. في الجنين الذكر، وتنشيط مستقبلات الاندروجين يؤدي إلى انحطاط البراعم، والتي تختفيقبل E15.5. اعتبارا من E18، توقف تطوير الثديية حتى سن البلوغ 6-9.
عند الولادة، والغدة الثديية تؤوي نظام الأقنية بدائية أن يستطيل وفروع ببطء (النمو متساوي القياس). في بداية سن البلوغ، وهياكل كروية يقع على نصائح من القنوات تسمى براعم نهاية طرفية (TEBs)، تتشكل من طبقة خارجية من الخلايا سقف واللب الداخلي متعدد الطبقات من الخلايا (خلايا الجسم). هذه الهياكل هي التكاثري للغاية، والتغلغل في الأنسجة اللحمية المحيطة استجابة لمنبهات الهرمونية. انتشار ضمن نتائج TEBs في استطالة الأقنية، إلى جانب المتفرعة التشكل. هذه العملية تؤدي إلى إنشاء شبكة مفرغة الظهارية الأساسية المنبثقة من الحلمة (الشكل 1B، البلوغ). في ~ بعد 10-12 أسابيع الميلاد، عندما ظهارة غزت لوحة الدهون كلها، توقف توسعها وTEBs تختفي. تطوير الأقنية ثم يخضع لتغيرات ديناميكية، أي successiلقد انتشار والانحدار من الخلايا الظهارية وفقا لدورات داقية 10 (1B الشكل، والكبار).
من بداية الحمل، والأنسجة الثديية يخضع النمو المهم والتغيرات المورفولوجية للتحضير لالرضاعة. ظهارة الثديية تتكاثر على نطاق واسع والتفريق، مما يؤدي إلى شبكة انبوبية-السنخية تشعبت للغاية. وفي الوقت نفسه، الخلايا الظهارية الثديية (MECs) تصبح الاستقطاب وقادرة على تجميع وتفرز منتجات الألبان. MECs تنظم في العديد من الهياكل السنخية (عنيبات) التي تحيط بها خلايا عضلية ظهارية مقلص وإدخالها على سدى تتكون من الأنسجة الضامة والدهنية والأوعية الدموية والنهايات العصبية (1B الشكل، والحمل). وعلاوة على ذلك، فإن الجانب القاعدي من MECs على اتصال وثيق مع الغشاء القاعدي (المصفوفة خارج الخلية)، والتفاعلات بين هذين الكيانين تنظيم بإحكام على حد سواء التشكل وظيفة إفرازية ماماراي ظهارة 11-13.
كل هذه العمليات تعتمد على العمل من العظة مختلف البيئية، والتي من أهمها hormones14، عوامل نظير الصماوي والمصفوفة خارج الخلية. على سبيل المثال، البروجسترون يدفع اسعة 15 و alveologenesis ذلك، بالاشتراك مع البرولاكتين (PRL)، المتفرعة الجانب 16،17، ويعزز ويحافظ على التفريق بين الحويصلات الهوائية. بالإضافة إلى المنشطات وPRL18، السيتوكينات ومسارات الإشارات المرتبطة بالتنمية وتشارك (WNT والشق مسارات الإشارات) أيضا في التزام النسب الثديية والتنمية 19-21. في نهاية الحمل، وMECs اللمعية تبدأ في إنتاج الحليب الغنية بالبروتين يعرف باسم اللبأ في تجويف الحويصلات الهوائية. بالإضافة إلى ذلك، البروجسترون يعمل على نفاذية الظهارية ومنذ منعطفات ضيقة لا تزال مفتوحة، تم العثور على اللبأ أيضا في مجرى دم الأم.
بعد الولادة، ومعمر الذي كان ينتظرذ ظهارة يستغرق ما يقرب من جميع حجم الغدة الثديية، ودرجة عالية من التنظيم (الشكل 2، ظهارة الثديية). يتم تشكيل وحدات إنتاج الحليب، وهي الحويصلات الهوائية (الشكل 2، سنخ)، عن طريق أحادي الطبقة الخلايا الظهارية الثديية الاستقطاب الإفرازية (MESCs)، مع غشاء البلازما قمية من ترسيم التجويف. الحويصلات الهوائية ترتب نفسها في الفصيصات التي تم تجميعها داخل فصوص متصلة القنوات التي تستنزف الحليب إلى الوسط الخارجي (الشكل 2، الفص). تحدث الرضاعة، أي، MESCs تبدأ في إفراز كميات وفيرة من الحليب، ناجمة أساسا عن انخفاض في هرمونات المشيمة (أساسا البروجسترون) (الشكل 1B، الرضاعة). يتم تنشيط جينات بروتين الحليب في دورة الوقت الزمني المحدد بدءا من الحمل إلى الرضاعة 9،22،23، وعلى رأسها ردا على PRL النخامية صدر في وقت الرضاعة. وفي الوقت نفسه، والاتصالات بين MESCs والمصفوفة خارج الخلية كلا تحفيز بروتين الحليب synthesis من خلال الإشارات التي يتم مكتسب من خلال التفاعلات بين integrins الخلوية و laminin 24،25، وقمع موت الخلايا المبرمج في MESCs 26،27. هذه مسارات إشارات تؤدي إلى تنشيط بروتين الحليب المروجين الجين 28 من خلال تفعيل النسخ محددة عوامل 29. الاتصالات خلية خلية مهمة لبعض جوانب التمايز بما في ذلك إنشاء القطبية القمي وإفراز اتجاهي منتجات الألبان أيضا. منعطفات ضيقة وثيقة بسرعة بعد بداية الرضاعة وMESCs تنسق بدقة امتصاص الجزيئات من الدم وكذلك تركيب ونقل وإفراز مكونات الحليب، وذلك استجابة لمتطلبات الغذائية لحديثي الولادة. في وقت الرضاعة، وانكماش خلايا عضلية ظهارية المحيطة الحويصلات الهوائية يحدث استجابة لالأوكسيتوسين ويؤدي إلى قذف اللبن من خلال القنوات وإلى الحلمة. الحليب هو السائل معقد يحتوي على البروتينات (في الغالبكازيين)، والسكريات (اللاكتوز بشكل رئيسي)، والدهون، والمعادن، وكذلك جزيئات النشطة بيولوجيا مثل المناعية A (ايغا)، عوامل النمو والهرمونات. وقد تم تجميع كازيين، وتجميعها في هياكل supramolecular، وهي الكازين المذيلات، نقل على طول مسار إفرازية، ثم أطلق سراحه من قبل إيماس، أي مزيج من التي تحتوي على الكازين الحويصلات الإفرازية (SVS) مع غشاء البلازما قمية من مسك (الشكل 2).
يعتمد حركة المرور داخل الخلايا على تبادل المواد بين الأجزاء غشائي وينطوي القابلة للذوبان N-ethylmaleimide-حساس فيوجن (NSF) البروتين مرفق (SNAP) مستقبلات (الفخ) 30،31. تنقسم عائلة البروتينات كمين في الافخاخ حويصلي (الخامس الافخاخ)، موجودة في غشاء الحويصلة، والافخاخ الهدف (تي الافخاخ)، مترجمة على الأغشية الهدف. من خلال فتح سوستة من خلال المجالات ملفوف لفائف، والخامس ور الافخاخ-تجميع لتشكيل مستقر للغاية مجمع حزمة أربعة الحلزون، يشار إلى عشرالبريد مجمع الفخ. هذا المجمع يعزز الانصهار اثنين من طبقات ثنائية الدهون معارضة من قبل تقديمهم تدريجيا الى مقربة 30،32. بعد ذلك، يتم فصل المجمعات كمين من قبل الأدينوزين فسفاتاز جبهة الخلاص الوطني وإعادة تدويرها البروتين محول SNAP وكمين البروتينات عودتها الى مقصورة منشئهم 33. ومن المثير للاهتمام، كل بروتين كمين تكمن أساسا في الأجزاء الخلوية متميزة وكمين الاقتران يمكن أن تسهم في خصوصية الأحداث الانصهار داخل الخلايا 34. وتشير دراسات سابقة إلى أن ما لا يقل عن 23 بروتين (SNAP23) والحويصلة غشاء المرتبطة البروتين 8 (VAMP8)، وsyntaxins (STX) Synaptosomal المرتبطة -7 -12 وتلعب دورا في الكازين إيماس 35،36. كما تم العثور على هذه البروتينات بالتعاون مع الكسر الدهون من الحليب، أي دهن الحليب كريات (MFGs) 37. النموذج السائد الحالي تفترض أن قطرات الدهون حشوية (CLDs) تتشكل من تراكم ل محايدipids (أساسا triacylglycerols واسترات ستيرول) والكوليسترول المستمدة من النظام الغذائي للأم بين اثنين من منشورات من الشبكة الإندوبلازمية (ER) غشاء 38-41. تتشكل CLDs كبيرة، على الأقل جزئيا، من خلال انصهار CLDs أصغر أثناء نقله إلى الجانب قمية من MESCs حيث يتم اطلاق سراحهم كما MFGs (1-10 ميكرون في القطر) التي مهدها، ويجري enwrapped من قبل مسك القمي غشاء البلازما 40-42. الرضاعة تتوقف بعد مفطوم الجراء وMESCs يموت تدريجيا موت الخلايا المبرمج، مما أدى إلى تراجع الأنسجة الثديية إلى حالة البلوغ (الشكل 1B، ارتداد).
المناعي (IF) هو أسلوب مختبر تحليلي مشترك المستخدمة في جميع الجوانب تقريبا البيولوجيا، سواء في مجال البحث والتشخيص السريري. IF تقنيات يمكن القيام بها على أقسام الأنسجة (المناعية، IHC) أو الخلية (مناعية، ICC) العينات. يعتمد هذا النهج قوية على استخدام fluorescent-الأجسام المضادة المسماة التي تربط تحديدا (مباشرة أو غير مباشرة) للمستضد من الفائدة، مما يسمح التصور من توزيع الأنسجة من خلال المجهر مضان. يعتمد إشارات مضان في الغالب على نوعية وتركيز الأجسام المضادة والتعامل السليم للعينة. ويرد بروتوكول بسيط المناعي غير المباشر (IIF) للكشف عن منتجات الحليب (كازيين وMFGs) والبروتينات المشاركة في إفراز منتجات الحليب (butyrophilin (BTN1)، كمين البروتينات) على الأبواب المجمدة من الأنسجة الماوس الثديية (الشكل 3). بينما يوفر هذا البروتوكول لمحة IHC كاملة، بدءا من جمع الأنسجة لصورة ما بعد العلاج، تنتقد والخطوات الاختيارية وكذلك بعض التوصيات الفنية وتعرض أيضا ومناقشتها.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
كانت ولدت الفئران CD1 في INRA (UE0907 IERP، جوي-أون-Josas، فرنسا). جميع الجوانب الأخلاقية للرعاية الحيوان امتثلت للمبادئ التوجيهية ذات الصلة ومتطلبات الترخيص المنصوص عليها من قبل وزارة الزراعة الفرنسية. تمت الموافقة على الإجراءات المتبعة من قبل لجنة الأخلاق المحلية (اتفاق 12/097 من Comethea جوي-أون-Josas / AgroParisTech).
1. الغدة الثديية إعداد نموذج
- الماوس الغدة الثديية تشريح
- الموت ببطء الفئران في اليوم 10 من الرضاعة خلع عنق الرحم ويعلقون الحيوان أسفل البطن مع لمواجهة.
- الرطب المنطقة البطنية مع الإيثانول وجففه بمنشفة ورقية.
- باستخدام ملقط، سحب ما يصل إلى الجلد في منطقة البطن بين رجليه الخلفيتين وإجراء شق (عن طريق الجلد فقط) من حوالي 1 سم مع مقص حاد. بدءا من هذا الشق الأول، ثم استخدم المقص لقطع الجلد حتى العنق على الماوس. سحب الجلد بعيدا عن الصفاق وبين أسفل جانب واحد من الجلد في وقت واحد، أنها تمتد تدريسها.
- جمع البطن والغدد الثديية الأربية التي تدفعهم بعيدا عن الجلد مع مسحة وأخيرا سحب او قطع منها بعيدا عن الصفاق.
ملاحظة: في هذه الخطوة كارمين تلطيخ يمكن القيام بها من أجل رؤية ظهارة الثديية داخل الغدة بأكملها 43. هذا النهج يمكن أن تكون مفيدة لتحليل مورفولوجيا العالمي الغدة الثديية في ظل ظروف مختلفة (مراحل تطور الفسيولوجية والأمراض والعلاجات في الجسم الحي). - إزالة العقدة الليمفاوية تقع عند تقاطع البطن والغدد الأربية 44.
- تثبيت الأنسجة الثديية
- قطع الأنسجة الثديية إلى 3 مم 3 أجزاء مع مشرط وعلى الفور شطف هذه الشظايا في الفوسفات مخزنة المالحة (PBS) حل، ودرجة الحموضة 7.4، من أجل إزالة أكبر قدر من الحليب ممكن.
- يجف بسرعة شظايا على ورقةمنشفة ووضعها في محلول PBS الباردة التي تحتوي على 4٪ بارافورمالدهيد (PFA، HCHO، 32٪ محلول الفورمالديهايد، تنبيه) لمدة 10 إلى 15 دقيقة على الجليد.
ملاحظة: هذا هو ما يكفي من الوقت للسماح للتحليل لاحقة على شرائح الأنسجة الثديية التي كتبها IIF36 و / أو التهجين في الموقع 45 في. لكن، وكما تخترق مثبتات ألدهيد ببطء في قطعة نسيج (~ 1-3 ملم في الساعة)، ويجوز تمديد هذه الفترة لضمان التثبيت الأمثل للعينة الأنسجة. بدلا من ذلك، إصلاح الأنسجة في الجسم الحي من قبل perfusing حيوان تخدير مع حل تثبيتي (وليس بالتفصيل في هذه الدراسة).
- ضخ السكروز
- شطف بسرعة شظايا الثديية في برنامج تلفزيوني الباردة وتزج بهم في حل PBS الباردة التي تحتوي على 40٪ سكروز (D السكاروز، C12H22O11، السيد 342.3 غرام / مول) ل16-48 ساعة عند 4 درجات مئوية تحت الهز لطيف.
- الأنسجة التضمين
ملاحظة: في هذه الخطوة، شظايا الثديية يمكن إعادة قطع من أجل جعل أجزاء أصغر (2-3 ملم 3) أو لضبط شكلها.- صحيح تسمية القوالب البلاستيكية وملء ثلث حجم القالب مع أكتوبر مركب، حافظت على RT. وضع جزء واحد (2-3 ملم 3) من الأنسجة الثديية في قالب وتغطية ذلك مع أكتوبر المجمع.
- وضع قوالب على السطح من النيتروجين السائل (على ورقة من الألومنيوم أو استخدام منخل معدني)، والسماح للمنتج لتجميد.
ملاحظة: يجب أن تصبح صلبة والأبيض قبل غمر العفن في النيتروجين السائل.
- تخزين العينات المجمدة في -80 درجة مئوية حتى تتم أقسام الأنسجة.
2. المجمدة باجتزاء الأنسجة
ملاحظة: ناظم البرد، التي هي في جوهرها مشراح داخل الفريزر، هو مطلوب لجعل أقسام الأنسجة المجمدة. وغالبا ما يتطلب انخفاض درجة الحرارة لالأنسجة الدهنية أو الدهنية الغنية مثل الغدة الثديية البكر.
- ضبط درجة حرارة ناظم البرد إلى -26 ° C وانتظر حتى يكون لديها stabilized. الحفاظ على كتلة الأنسجة المجمدة في -26 ° C في جميع أنحاء الداخلي باجتزاء بأكمله. تجنب تماما ذوبان النسيج في أي وقت أثناء العملية.
- تبريد شفرة حلاقة، ودعم عدة قطاعات، جهاز مكافحة لفة وفرشاة ل-26 ° C عن طريق وضعها في ناظم البرد لمدة 10 دقيقة على الأقل. وضع أيضا مربع الشريحة داخل ناظم البرد من أجل أن تكون قادرة على تخزين الشرائح الزجاجية كما يتم إجراء الأقسام.
- صحيح تسمية الشرائح الزجاجية التي سيتم استخدامها لجمع المقاطع الأنسجة والمحافظة عليها في RT. وإلا سوف أقسام الأنسجة لا تلتزم بها. إزالة عينة من العفن داخل ناظم البرد.
ملاحظة: وسوف تستخدم الشرائح الزجاجية المشحونة إيجابيا لصالح كثيرا من التصاق أقسام جديدة الأنسجة المجمدة بسبب ارتفاع جاذبية كهرباء. - تغطية سطح القرص الأنسجة المعدنية مع أكتوبر مجمع (الحفاظ على RT)، ودفع العينة المجمدة على ذلك. وضع الرطب جبل داخل ناظم البرد والسماح لها بالمشاركةرأ لمدة 15 دقيقة على الأقل.
- وضع جبل الرطب في حامل القرص من ناظم البرد. ضبط سمك قطع 5-6 ميكرون، وإذا أمكن، استخدام شفرة حادة جديدة أو على الأقل تغيير المنطقة على شفرة تستخدم لقطع كل عينة لأنها سوف بعض الأنسجة مملة بسرعة.
- ضبط الموقف من جهاز مكافحة لفة على شفرة حلاقة بجعل التخفيضات من المتوسطة المتزايدة حتى يتم تشكيل شرائح بالتساوي وبشكل صحيح. من الناحية المثالية، فإن جهاز مكافحة لفة خطوة على شفرة حلاقة بنحو 1 مم.
- وبمجرد أن الإعدادات صحيحة، نفذ أقسام الأنسجة عن طريق تحريك العجلة في حركة موحدة مستمرة. إلا إذا كانت درجة الحرارة المثالية، قسم الأنسجة و، بحكم طبيعتها، في محاولة لعقص.
- استخدام فرشاة لانتزاع والمناورة القسم عبر المرحلة من أجل وضعه كما هو مطلوب على شريحة زجاجية. استخدام الفرشاة لتنظيف بقايا ربما موجودة على كتلة الأنسجة المجمدة و / أو شفرة حلاقة.
- سحبقسم الأنسجة نحو المستخدم، وتجنب الضغط عليه على خشبة المسرح ناظم البرد. تجنب الضغط على قسم الأنسجة على خشبة المسرح ناظم البرد لأنها قد تؤدي إلى التصاق شريحة الأنسجة على المسرح، وبالتالي عدم القدرة على استعادتها مع شريحة زجاجية.
- استرداد أقسام الأنسجة واحدا تلو الآخر من قبل انتشالها على سطح شريحة زجاجية، بوضعها فوق الباب، وتتحين الفرصة عليه لمسة من قسم الأنسجة.
ملاحظة: أقسام الأنسجة الالتزام بسرعة على الزجاج الحار بسبب جاذبية ثابت. إذا وضعت عدة أقسام الأنسجة على نفس الشريحة، يجب الحرص على عدم التداخل بينها وإلى الفضاء لهم ما يكفي لتكون قادرة على إحاطة منهم على حدة في دائرة مسعور (انظر البند 3.1.1.).
3. المناعي غير المباشر
- تحديد الأقسام
- استخدام القلم حاجز مسعور لرسم دائرة مسعور حول الأنسجة محمولة على الشرائح. السماح للدائرة الجافة لحوالي 1 دقيقة في RT. رسم خط حول رأقسام القضية مع علامة دائمة السوداء الجميلة أيضا، ولكن على جانب من الشريحة الزجاجية مقابل واحد حيث هي أقسام الأنسجة.
ملاحظة: هذه الدائرة بالماء طارد وacetone- والكحول غير قابلة للذوبان. وبالتالي فإنه يوفر حاجزا أمام المحاليل المائية المستخدمة أثناء إجراء IHC ويقلل من حجم الكواشف اللازمة. - ترطيب أقسام الأنسجة التي تغطي عليها مع قطرة من ~ 250 ميكرولتر من برنامج تلفزيوني لمدة بضع دقائق في RT. إصلاح أقسام الأنسجة التي تغطي لهم ~ 250 ميكرولتر من الطازجة 3٪ PFA الحل في برنامج تلفزيوني لمدة 10 إلى 15 دقيقة.
ملاحظة: اختياريا في هذه الحالة، استخدم الحل ألدهيد التبريد (كلوريد الأمونيوم 50 ملم (NH 4 الكلورين، السيد 53.5 جم / مول) في برنامج تلفزيوني أو 0.1M الجلايسين (C 2 H 5 NO 2، السيد 75.07 غرام / مول) في برنامج تلفزيوني ) لوقف تفاعل تثبيت. بسيطة وفيرة PBS غسل يكفي عموما لإزالة ألدهيد غير المتفاعل.
- استخدام القلم حاجز مسعور لرسم دائرة مسعور حول الأنسجة محمولة على الشرائح. السماح للدائرة الجافة لحوالي 1 دقيقة في RT. رسم خط حول رأقسام القضية مع علامة دائمة السوداء الجميلة أيضا، ولكن على جانب من الشريحة الزجاجية مقابل واحد حيث هي أقسام الأنسجة.
- استرجاع مستضد (اختياري)
- وضع حل AR (100 ملي تريس (C 4 H 11 NO 3، السيد 121.14) 5٪ اليوريا (NH 2 CONH 2، السيد 60.06) درجة الحموضة 9.6) في كوب. يجب أن يكون حجم محلول AR كافية لتغطية كامل الشرائح الزجاجية وضعها في حامل الزجاج.
- سخن حل AR إلى 95 ° C خلال رصد درجة الحرارة مع الحرارة وثم ضع الشرائح الزجاجية على رف مناسبة، immerge رف في المنطقة العازلة الساخنة، وغطاء للحد من التبخر واحتضان لمدة 10 دقيقة في درجة حرارة 95 درجة مئوية.
- إزالة كوب من حمام الماء وتترك الشرائح الزجاجية لمدة 10 دقيقة أخرى في المنطقة العازلة.
- شطف أقسام الأنسجة مع PBS (~ 250 ميكرولتر / قسم) وتشبع لهم حلا3٪ ألبومين المصل البقري (BSA، ~ 250 ميكرولتر / قسم) في برنامج تلفزيوني لمدة 30 دقيقة على الأقل في RT.
- وضع 30-50 ميكرولتر من الأجسام المضادة الأولية مخففة في برنامج تلفزيوني يحتوي على 2٪ BSA على كل قسم الأنسجة.
ملاحظة: هذا الحجم يكفي لتشكيل الهبوط الذي يغطي تماما على قسم الأنسجة. - وضع نفس حجم مخفف (2٪ BSA في PBS) وحده على قسم الأنسجة لأداء السلبية من دون السيطرة الأجسام المضادة الأولية.
- تشمل منهجية هذا الشاهد السلبي في كل تجربة IHC وأداء لكل الأجسام المضادة الثانوية المستخدمة لتقدير خلفية التجربة (وضع العلامات غير محددة بسبب الأجسام المضادة الثانوية و / أو الأنسجة لصناعة السيارات في مضان). ويمكن أيضا أنواع أخرى من الضوابط الإيجابية أو السلبية القيام بها لضمان خصوصية وضع العلامات (انظر المناقشة).
- وضع الشرائح الزجاجية في مربع O مرطب / N عند 4 درجات مئوية.
ملاحظة: كانت الأجسام المضادة الأولية المستخدمة الماوس وحيدة النسيلة المضادة للcytokeratin8 (CK8، 01:50 تمييع)، والماوس وحيدة النسيلة المضادة للcytokeratin 14 (CK14، 01:50 تمييع)، الأرنب بولكلونل مكافحة فأر الكازين (# 7781، 01:50 التخفيف، وقدمت بسخاء من قبل MC نيفيل، جامعة كولورادو الصحة مركز العلوم، CO، الولايات المتحدة الأمريكية)، الأرنب بولكلونل المضادة للBTN1 (1: 300 التخفيف، وقدمت بسخاء من قبل IH ماذر، قسم علوم الحيوان والطيور، جامعة ميريلاند، كلية بارك، MD، الولايات المتحدة الأمريكية)، الأرنب بولكلونل المضادة للStx6 ( 1:50 التخفيف، وقدمت بسخاء من قبل S. Tooze، معهد أبحاث السرطان في المملكة المتحدة، معهد البحوث لندن، لندن، المملكة المتحدة) والأرنب بولكلونل المضادة للVAMP4 (01:50 تمييع). - تماما غسل أقسام الأنسجة مع PBS أربع مرات على الأقل لمدة 10 دقيقة في RT.
- تمييع الأجسام المضادة المناسبة الثانوية (رودامين مترافق الماعز مفتش المضادة للأرنب (H + L)، 1: 300 تمييع) في برنامج تلفزيوني يحتوي على 2٪ BSA، ضع 30-50 ميكرولتر من هذا الحل على جميع أقسام الأنسجة، واحتضان لمدة 1.5 ساعة في RT.
- منذ fluorochromes هي جزيئات حساسة للضوء، لافضح أقسام الأنسجة للضوء حتى تحليلهم. لمعهد التمويل الدولي على أقسام الأنسجة، لصالح الأجسام المضادة الثانوية بالإضافة إلى fluorophore الأحمر منذ أغشية الخلايا تميل إلى توليد الأخضر لصناعة السيارات في مضان التي يمكن أن تتداخل مع انخفاض العلامات. وعلاوة على ذلك، واختيار يقترن fluorophore الأجسام المضادة الثانوية الأحمر يسمح بوضع العلامات يصاحب ذلك من الدهون المحايدة (انظر أدناه).
- تماما غسل أقسام الأنسجة مع PBS أربع مرات على الأقل لمدة 10 دقيقة في RT.
- بالنسبة لبعض التجارب، نفذ ما بعد التثبيت، التي يحتضنها العينات مع 2٪ PFA مخففة في برنامج تلفزيوني لمدة 10 دقيقة في RT من أجل تحقيق الاستقرار السقالات مستضد / الأضداد. ومع ذلك، فإن هذه الخطوة يمكن الاستغناء عنها في معظم الحالات.
- لتصور CLDs وMFGs، اللون الدهون المحايدة التي يحتضنها أقسام الأنسجة في 30-50 ميكرولتر من محلول PBS تحتوي على 3 ميكروغرام / مل من bodipy 493/ 503 لمدة 10 دقيقة في RT. شطف بسرعة أقسام الأنسجة مرتين مع برنامج تلفزيوني.
- مباين DNA النووي مع 30-50 ميكرولتر من محلول PBS تحتوي على 3 ميكرومتر من دابي (4-6-diamidino-2-phenylindole، 5 ملغ / مل حل الأسهم) لمدة 10 دقيقة في RT. غسل أقسام الأنسجة مرتين مع برنامج تلفزيوني قبل تركيب الشرائح للمراقبة.
- إزالة برنامج تلفزيوني ووضع قطرة من تصاعد المتوسطة على كل قسم الأنسجة.
- ضع جانب واحد من انزلاق الغطاء بزاوية ضد الشريحة، مما يجعل الاتصال مع الحافة الخارجية للانخفاض السائل ومن ثم خفض الغطاء ببطء، وتجنب فقاعات الهواء. تدع السائل انتشرت بين شريحة زجاجية وانزلاق الغطاء لبضع دقائق ثم قم بإزالة الفائض من تصاعد المتوسطة مع منشفة ورقية.
- ختم زلة تغطية على شريحة زجاجية مع أقسام طلاء الأظافر والأنسجة تخزينها في 4 ° C لمنع تعرضها للضوء حتى الملاحظة.
4. الإسفار المراقبة والحصول على صورة
ملاحظة: A المجهر مضان مجهزة مطلوب كاميرا تسيطر عليها البرنامج الحصول على الصورة لاحظ النتائج IHC.
- قبل الحصول على الصور، والتحقق من كثافة العلامات وتقييم خلفية التجربة من خلال النظر في ضوابط السلبية. الحصول على الصور من كل تسمية الفلورسنت (قناة لون) بشكل فردي.
- الحصول على جميع الصور، بما في ذلك الضوابط المقابلة، في نفس الظروف (التعرض والإعدادات العامة) لكل قناة لون.
- المجهر التقليدية
- أداء المجهر epifluorescence مع المجهر مزودة بمرشحات القياسية لثيوسيانات فلوريسئين (FITC والأخضر)، رودامين (أحمر) ودابي (الأزرق) الانبعاثات، و× 20 إلى × 63 (للنفط غمر، NA 1.3) الأهداف وكاميرا التصوير DP50.
- المجهر متحد البؤر
- أداء متحد البؤر المجهري مع مايكروينالتعامل مجهزة البرنامج ZEN، وذلك باستخدام × 20 × 63 ل(النفط غمر، NA 1.4) الأهداف وموجات الإثارة 488- و 568 نانومتر ليزر.
العلاج 5. صورة
ملاحظة: يتم تنفيذ جميع صورة المعالجات اللاحقة باستخدام البرمجيات الحرة يماغيج (http://imagej.nih.gov/ij/).
- ركب صورة (دمج)
- فتح الصور المكتسبة في كل قناة من شأنها أن تكون مجتمعة (ملف / فتح). إذا كان يعمل مع الصور الرمادية 8 بت، السمة اللون الاصطناعي لكل قناة باستخدام جدول بحث (الجداول صورة / بحث).
- توليد صورة مركبة من الصور الرمادية أو الملونة باستخدام الأمر "قنوات دمج" (صورة / اللون / دمج قنوات) ثم ينسب لون لكل قناة.
- أداء صورة مداخن استعلاء بنفس الطريقة عن طريق فتح مداخن المكتسبة في كل قناة من شأنها أن تكون مجتمعة (ملف / فتح) واستخدام الأمر "دمج القنوات &# 8221؛ (صورة / اللون / دمج قنوات) إلى السمة لون لكل قناة. حفظ كومة مركب باعتبارها تسلسل الصور أو كفيلم (انظر القسم 5.4).
- صورة كومة Z الإسقاط
- استخدم الدالة Z الإسقاط (صورة / كومة / Zproject، ماكس الشدة) لتقديم وجهة نظر ثنائية الأبعاد من كل الصور من رصة صور من خلال إبراز لهم على طول محور عمودي على الطائرة صورة (ض محور). "أقصى كثافة" خيار يخلق صورة فيها كل بكسل يحتوي على القيمة القصوى على جميع الصور في المكدس. وهذا يولد صورة واحدة مما يسمح التصور من كل تلطيخ لوحظ من خلال صورة كاملة مكدس لقناة معينة أو بعد استعلاء عدة قنوات.
- صورة الإسقاط كومة 3D
- استخدم الأمر إسقاط 3D (مشروع صورة / كومة / 3D، ألمع نقطة، المحور ص) لإنشاء سلسلة من التوقعات لحجم الدورية الصعود إلى الطائرة. التقديم المرئي للسوrfaces والهياكل الداخلية يعتمد على كل من طريقة الإسقاط (أقرب نقطة، ألمع نقطة (المستخدمة هنا)، أو يعني القيمة) والمعلمات التصور مختارة. كل إطار من سلسلة الرسوم المتحركة هو نتيجة لإسقاط من زاوية النظر المختلفة.
- وتناوب على خلق صورة 3D حول كل من المحاور المتعامدة الثلاثة (تم اختيار المحور الصادي هنا). حفظ تسلسل كما تنتج صورة واحدة أو فيلم.
- صورة كومة لتحويل الفيلم
- فتح كومة صورة (ملف / فتح) وحفظه كفيلم في شكل افي باستخدام الأمر "AVI" (ملف / حفظ باسم / AVI).
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
الغدة الثديية هي غدة تحت الجلد تقع على طول هيكل بطني كل من الصدر والبطن في القوارض. يظهر موقع خمسة أزواج من الغدد الماوس أثناء الحمل في الشكل (4). والتشكل من الغدة الثديية يتغير بشكل كبير خلال تطورها، مما يعكس التعديلات الفنية اللازمة للتحضير لالرضاعة الكاملة (الشكل 1B). في الحيوانات أو البكر ولم يسبق لها الحمل، تتكون الغدة الثديية من ظهارة الأقنية المتفرعة قليلة جزءا لا يتجزأ من داخل سدى الدهنية رقيقة قد يكون من الصعب أن نرى. من بداية الحمل، وانتشر ظهارة الثديية وتوسع، مما أدى إلى الغدد الثديية الكبيرة التي تصبح أسهل لمعرفة وإزالة (الشكل 4). أثناء الرضاعة، والأنسجة الثديية هو أكثر سمكا ويبدو أكثر بياضا بسبب وجود الحليب. يتم جمع سوى الغدد الثديية في البطن والحوض، لأن عنق الرحم والصدر الغده الثدييةتتم إزالة DS أقل بسهولة نظرا لارتباطها الوثيق مع العضلات. بالنسبة لبعض التجارب، الجراء يمكن فصلها عن المرضعات الإناث 6/4 ساعة قبل التضحية من أجل الحد من إفراز الحليب MESCs 46،47.
تحديد ظهاري عضلي الثديية والخلايا الظهارية
خلايا عضلية ظهارية مقلص المحيطة الحويصلات الهوائية يمكن تمييزها عن MESCs اللمعية من خلال استخدام الأجسام المضادة الموجهة ضد علامات أعرب تحديدا من قبل كل من هذين النوعين من الخلايا. في الغدة الثديية، وعلامات الحالية المستخدمة هي cytokeratins (CKS). CKS هي عائلة كبيرة من البروتينات السيتوبلازمية التي تتبلمر لتشكيل خيوط المتوسطة هيكل الخلية (10 نانومتر في القطر في المتوسط) وجدت في الأنسجة الظهارية. شعيرات متوسطة مستقرة للغاية وتوفر الدعم الميكانيكي للهندسة المعمارية الخلية، وتنظيم الأنسجة من خلال المساهمة في التصاق الخلية خلية والقاعدية الخلايا الضامةتفاعلات الأنسجة. مجموعات فرعية من CKS التي أعربت عنها الخلايا الظهارية تعتمد أساسا على نوع البشرة، مرحلة تطوره وحالة التمايز لها. وعلاوة على ذلك، وهذا ينطبق أيضا على نظرائهم الخبيثة من ظهائر. وهكذا، هذه العلامات هي أدوات بسيطة وقيمة لتوصيف السكان الخلية في الأنسجة تحت الظروف الفسيولوجية وتستخدم لتشخيص الورم وتوصيف في علم الأمراض الجراحية 48.
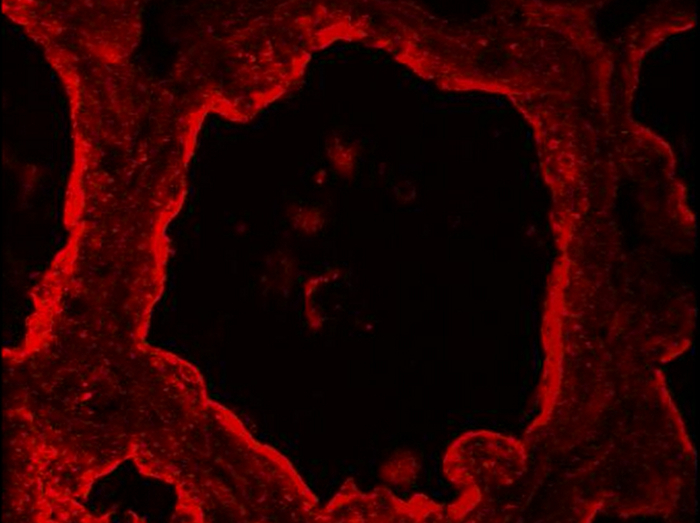
في الغدة الثديية العادية، ويمكن التمييز بين الخلايا ظهاري عضلي وMESCs اللمعية على أساس من التعبير التفاضلية من CK14 وCK8، على التوالي (الشكل 5). تم الكشف عن هذه العلامات حشوية في الفروع الثديية من الفئران المرضعات بعد PFA تثبيت وAR. تم الحصول على الصور مع المجهر epifluorescence التقليدية. يبدو CK8 ليتم توزيعها في جميع أنحاء السيتوبلازم من MESCs اللمعية (الشكل 5، CK8). لاحظ أن خلفية حمراء تقيداهو يرجع في معظمه إلى قسم الأنسجة للطي د للسيطرة سلبية دون الأجسام المضادة الأولية (الشكل 5، -Ig1)، على النحو الذي اقترحه وضع العلامات DNA الأزرق، الذي يعرض عدة طبقات من النوى (الشكل 5، -Ig1، نوى). لوحظ CK14 تحديدا في خلايا عضلية ظهارية مسطحة وممدود تقع في قاعدة الحويصلات الهوائية (الشكل 5، CK14). آخر طريقة شائعة لتحديد الخلايا عضلية ظهارية هو للكشف عن الأكتين العضلات ألفا السلس (أ - SMA) الموجودة في هذه الخلايا مقلص (انظر الشكل 4 في 49).
الكشف عن منتجات الألبان الماوس
بعد الولادة، وMESCs متباينة تماما البدء في إنتاج كميات وفيرة من الحليب. تفرز مكونات الحليب من خلال مسارات متميزة 40،50. تفرز المذيلات الكازين بواسطة إيماس من SVS جولجي المشتقة، في حين يتم الإفراج عن الدهون كما MFGs من قبل التبرعم من جمع القميأسماء غشاء MESCs (الشكل 2، الثديية الخلايا الظهارية إفرازية). بالنسبة لبعض التجارب، ويتم فصل الجراء من الإناث 6/4 ساعة قبل جمع الغدد الثديية، من أجل إبطاء إفراز الحليب 46،47. في ظل هذه الظروف، غشاء البلازما قمية من MESCs ومضمون لمعة يمكن ملاحظتها بسهولة، وليس هذا هو الحال أثناء الرضاعة حيث يتم التعاقد الحويصلات الهوائية ويتم إغلاق التجويف. وعلاوة على ذلك، إبطاء إفراز الضروري أيضا عند دراسة البروتينات المتورطين في الاتجار غشاء مثل الافخاخ. في الواقع، الافخاخ دورة بين الجهات المانحة ومقصورات متقبل والتعريب من التحت خلوية من الصعب تحديد منذ غالبا ما تنتشر العلامات عند دوران غشاء مرتفع، أي، أثناء الرضاعة. ولذلك، إبطاء إفراز الحليب عن طريق إزالة الجراء يوفر الظروف المناسبة لدراسة توطين الخلايا من الافخاخ عندما تي والخامس الافخاخ يقيم تفضيلي في المانحةومتقبل مقصورة على التوالي (انظر أدناه).
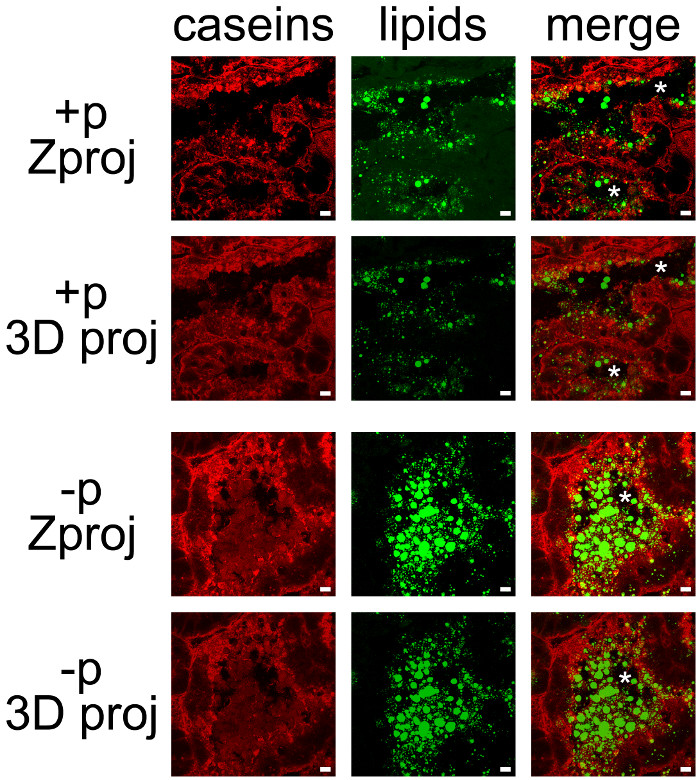
ويبين الشكل 6 توطين كازيين في المرضعات الماوس الغدة الثديية في اليوم 10 من الرضاعة، وذلك بحضور (الشكل 6، + ع) أو في غياب (الشكل 6، -p) من الجراء. وقد لوحظت أقسام الأنسجة كل من التقليدية المجهري epifluorescence (الأعمدة الثلاثة على اليمين) والفحص المجهري متحد البؤر (الشكل 6، العمود الأيسر). أثناء الرضاعة، تظهر كازيين أن تراكمت معظمها في المنطقة قمي (الشكل 6، ص +، السهام). ويكشف الفحص المجهري متحد البؤر التي كازيين موجودة أيضا، وإن كان بدرجة أقل، في الجانب القاعدي من MESCs في وجود الجراء (الشكل 6، + ص، السهام)، والتي لا يمكن ملاحظتها بوضوح في المجهر التقليدية (الشكل 6، كازيين، قارن بين اليسار واليمين لوحات). في الواقع، في epifluorescence واسعة المجال، ومضان المنبعثة من عينة (fluorescen الخلفيةم) يمر من خلال حجم متحمس ويغير القرار من الكائنات التي لوحظت في المستوى البؤري موضوعية (خارج التركيز مضان). هذا ينطبق بشكل خاص لعينات سميكة (أكثر سمكا من 2 ميكرون) هذا. المجهر متحد البؤر يسمح للحصول على صور ذات جودة عالية من العينات التي أعدت لepifluorescence، وعمق الميدان يمكن التحكم ومضان خلفية استبعاد من البؤري. وعلاوة على ذلك، في ظل وجود الجراء (الشكل 6، + ع)، تجويف الحويصلات الهوائية هي مغلقة تماما والجانب قمية من MESCs لوحظ بشكل أفضل في غياب الجراء (الشكل 6، -p)، عندما تجويف الحويصلات الهوائية هو المتوسعة بسبب تراكم منتجات الألبان. عندما تباطأ إفراز الحليب إلى أسفل، كازيين أيضا تظهر تراكمت تحت غشاء البلازما قمية (الشكل 6، -p، السهام)، والتقيد بشكل واضح في الجانب القاعدي من MESCs (الشكل 6، -p، السهام). ضوابط السلبية دون antib الأساسيلم ODY لا تظهر أي وضع العلامات (الشكل 6، -Ig1).
منتجات الحليب، ويمكن بسهولة شارك الكشف من خلال الجمع بين IHC للكازيين وcounterstaining الدهون محايد CLDs وMFGs (الشكل 7). تم تصوير المقاطع النسيجية كما Z أكوام بواسطة المجهر متحد البؤر، والتي كانت آخر تعامل مع يماغيج لإنتاج Z التوقعات أو إسقاطات 3D لكل (الشكل 7، كازيين، والدهون) أو جميع القنوات اللون (الشكل 7، دمج). تم حفظ تسلسل الصور المنتجة وصور واحدة (أرقام 7 و 8) أو أفلام (انظر أفلام تكميلية).
وعلى الرغم من ملاحظة بعض العلامات على جانبهم القاعدية، وقد تراكمت كازيين في الغالب على الجانب قمية من MESCs (الشكل 7، + ع)، كما هو موضح بالفعل عندما الإناث لم يفصل في وقت سابق من الجراء (الشكل 6، + ع). كما المترجمة CLDs بشكل رئيسي في منطقة قمية من MESCs، في حين سر أكبرMFGs إد موجودة في تجويف الحويصلات الهوائية. لاحظ أن كازيين وMFGs وتصور بسهولة في التجويف من الحويصلات الهوائية في غياب الجراء (الشكل 7، مقارنة + ص و-p). كازيين لا شارك في توطين مع CLDs أو MFGs في أي من هذه الشروط منذ استعلاء قنوات اللون اثنين لا تنتج العلامات الصفراء (الشكل 7، دمج الصور). ومع ذلك، تظهر صورة كومة المعالجات اللاحقة التي كازيين تحيط MFGs يفرز في تجويف الحويصلات الهوائية، مما يشير إلى أن هذه البروتينات قد تتفاعل مع مبدعين (الشكل 7، ودمج الصور). لاحظ الفرق بين الصور التي تنتجها كل بعد المعالجة المستخدمة (الشكل 7، مقارنة Zproj و 3D مسقطة لكل قناة لون).
الكشف عن butyrophilin، علامة البروتين من MFGs.
BTN1 هو واحد من البروتينات الرئيسية المرتبطة MFGs في الحليب 51. هذا البروتين الغشاء هو mainlذ المحلية في غشاء البلازما قمية من MESCs وبالتالي وجدت على سطح من مبدعين بعد صدوره عن طريق التبرعم 52 الشكل 8 يدل على أن في يوم 10 من الرضاعة، المترجمة BTN1 أساسا في غشاء البلازما قمية، وإلى بدرجة أقل، في المنطقة القمية من MESCs. كما يحيط BTN1 وMFGs موجودة في تجويف الحويصلات الهوائية وكذلك بعض CLDs قمي (الشكل 8، دمج مسقطة 3D، السهام). يتم عرض النتائج على هيئة صورة واحدة المستخرج من الحصول عليها صورة Z كومة (الشكل 8، الصورة) أو كطريقة عرض 3D ولدت مع الأمر الإسقاط 3D من يماغيج، كما هو موضح أعلاه (الشكل 8، مسقطة 3D). لاحظ أن صورة واحدة يمكن أن تكون كافية لمراقبة توزيع القمي من البروتين، ولكن الرابطة المكانية للBTN1 مع MFGs يفرز أو لوحظ فقط قمي CLDs بعد إعادة الإعمار 3D من Z كومة (الشكل 8 يقارن BTN1 الصورة ودمج 3D مسقطة PICTures). ويمكن أيضا أن Z كومة إعادة بنائها كفيلم لإعطاء صورة أفضل المكاني لتوزيع البروتين. الصورة Z كومة المكتسبة لBTN1 وحدها (أفلام تكميلية 1 و 3) أو فرضه مع اثنين من قنوات الألوان الأخرى (دمج والأفلام التكميلية 2 و 4) وترد على سبيل المثال. وZ كومة يمكن قراءة صورة تلو صورة من أعلى إلى أسفل (أفلام تكميلية 1 و 2) أو وجهة نظر الدورية (المحور الصادي) من الإسقاط 3D صورة كاملة كومة (الأفلام التكميلية 3 و 4 ).
الكشف عن اثنين من البروتينات الفخ: Stx6 وVAMP4
كما ذكر سابقا، الافخاخ هي بروتينات محددة الغشاء الذي تنقل بين الأغشية المانحة ومتقبل. ولذلك فمن الأفضل أن يتباطأ معدل دوران غشاء المرتبطة بالنشاط إفرازية عال من MESCs عن طريق الفصل بين الإناث من الجراء قبل جمع الغدة الثديية عند دراسةهذه البروتينات. على حد سواء وصفت Stx6 وVAMP4 باعتباره مرتبطا مع شبكة عابرة للجولجي 53،54. ومع ذلك، قد تكون هذه البروتينات كمين أيضا أن تلعب دورا هاما على مستوى الأجزاء الخلوية الأخرى مثل حبيبات إفرازية (Stx6) 55،56 وجهاز جولجي (VAMP4) 57. وتشير الدراسات السابقة أن البروتينات كمين تلعب دورا في إفراز الكازين 35،36. أثناء الرضاعة، وتقع Stx6 وVAMP4 في منطقة جنوب القمي من MESCs. لوحظ Stx6 بين النواة والغشاء القمي من MECs، المقابلة لجولجي والشبكة العابرة للجولجي (الشكل 9، Stx6)، وموجود أيضا، وإن بدرجة أقل، على SVS 36 التي تحتوي على الكازين. يتم ترجمة VAMP4 أيضا في منطقة جنوب القمي من MESCs، ولكن وضع العلامات ويبدو أن أكثر منقط وتراكمت تحت غشاء البلازما قمية (الشكل 9، VAMP4) بسبب ارتباطه مع كل CLDs والكازين-حساب المشتركSVS ining 36. لم السلبية من دون السيطرة الأجسام المضادة الأولية لا تؤدي إلى أي وضع العلامات.

الشكل 1. ماوس التنمية الغدة الثديية خلال الحياة الجنينية والكبار. (A) والغدد الثديية الماوس تبدأ في تطوير حول يوم الجنينية 10 (E10) من الأدمة (الضوء الأزرق) خطوط الحليب (الوردي). في E11.5، اللوحاءات شكل متناظر على طول الخط حليب الثدي واللحمة المتوسطة المحيطة بها (الأزرق الداكن) يبدأ تتكثف. واللوحاءات المنغلفة لتشكيل براعم (E12.5-E14.5)، وعلى E15.5، ظهارة الثديية (وردي)، تتكاثر واستطال لتشكيل برعم الرئيسي الذي يدفع من خلال اللحمة المتوسطة الثديية نحو لوحة الدهون (الضوء الأخضر ). A أشكال التجويف جوفاء وتفتح لتؤدي إلى الحلمة (البنفسجية). على E18.5، ظهارة الثديية يشكل rudimentaبنية متفرعة راي متصلة الخارج. مقتبس من 6 بإذن من ماكميلان للنشر المحدودة: طبيعة الاستعراضات علم الوراثة، حقوق الطبع والنشر 2007. (B) خلال فترة البلوغ، ظهارة الثديية (البنفسجية) يدخل مرحلة هامة النمو (الاستطالة واسعة، التشعب والتفرع الجانبي). في بداية الحمل، وانتشار واسع وسريع وكذلك الجانب المتفرعة تحدث، مما أدى إلى التوسع الكبير في ظهارة الثديية، الذي يغزو تماما الثديية كاملة لوحة الدهون. ظهارة الثديية تصل إلى حالة وظيفية متباينة للغاية أثناء الرضاعة عندما تفرز MESCs اللمعية كميات كبيرة من الحليب. عندما توقف الرضاعة بعد الفطام، وinvolutes الغدة الثديية. تتم إزالة MESCs التي كتبها موت الخلايا المبرمج والبلعمة، مما أدى إلى اختفاء هياكل lobulo السنخية التي يتم استبدال الأنسجة الدهنية. مقتبس من مخطط 1 من http://brisken-lab.epfl.ch/research والفصل 2.2. http://tvmouse.ucdavis.edu/bcancercd/22/index.html و. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
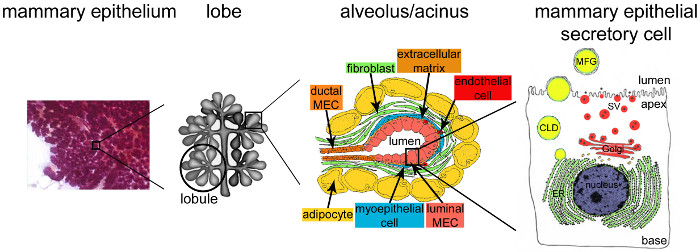
الشكل 2. العمارة الغدة الثديية أثناء الرضاعة. وخلال الرضاعة، وضعت بشكل كامل وظهارة تشعبت للغاية (البنفسجية) يمثل بالنسبة للغالبية العظمى من الأنسجة الثديية. يتم تشكيل الأنسجة الظهارية بواسطة هياكل انبوبية السنخية جزءا لا يتجزأ من سدى التي تحتوي على أنواع مختلفة الخلية (الخلايا الليفية، الخلايا الشحمية، وخلايا العضلات الملساء والدم والأوعية اللمفاوية والنهايات العصبية). ويتم تنظيم MESCs في الهياكل أو الحويصلات الهوائية عنيبية، وتجميعها في الفصيصات التي تشكل الفصوص. كل سنخ هو وحدة لإنتاج الحليب وظيفية متصل إلى شبكة متفرعة للغاية من القنوات مفصص والفصيصات، مما يسمح للحليب إلى أن د أمطرت إلى الخارج. ومن تخوم كل سنخ من قبل أحادي الطبقة من MESCs الاستقطاب، وعلى الجانب قمي الذي يحاذي التجويف المركزي. الجانب القاعدي من MESCs على اتصال وثيق مع المصفوفة خارج الخلية وخلايا عضلية ظهارية مقلص. يتم الافراج منتجات الحليب في الجانب قمية من MESCs. تفرز الحليب الرئيسي (كازيين)، والمذيلات الكازين (النقاط السوداء) من خلال إيماس من الحويصلات الإفرازية جولجي المشتقة (SVS)، في حين يتم الإفراج الدهون كما كريات الدهون الحليب (MFGs) عن طريق التبرعم من غشاء البلازما قمية من MESCs. CLD: حشوية الدهون الحبرية. ER: الشبكة الإندوبلازمية. MEC: الخلايا الظهارية الثديية. مقتبس من الفصل 2.2. http://tvmouse.ucdavis.edu/bcancercd/22/index.html.، الشكل. 02 www.cellbiol.net/ste/alpHERCEPTIN1.php، الشكل. 26-02 في 58، ومن 50. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
. في غضون صفحة = "دائما"> 

الشكل 3. الإجراء التجريبي لأداء المناعي غير المباشر على الأبواب المجمدة من الغدة الثديية الماوس. ويتم جمع الغدة الثديية من الماوس CD1 الإناث في اليوم 10 من الرضاعة. يتم قطع الأنسجة الثديية إلى أجزاء صغيرة التي يتم إصلاحها مع امتصاص العرق وغرست في السكروز قبل جزءا لا يتجزأ من أكتوبر مركب والمفاجئة مجمدة. ثم يتم قطع العينات الغدة الثديية إلى أقسام المجمدة رقيقة ومعالجتها لمعهد التمويل الدولي من قبل حضانة المتعاقبة مع الأجسام المضادة الابتدائية وتألقي مترافق، على التوالي. بعد تصاعد مستمر، ويتم تحليل العينات باستخدام المجهر مضان، والسماح للاقتناء الصور التي يمكن أن تكون في وقت لاحق بعد المعالجة. /53179/53179fig3large.jpg "الهدف =" _ فارغة "> الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.

. الشكل 4. تشريحية موقع الغدد الثديية الماوس الأيسر: عرض البطنية من نظام الماوس الثدي في مرحلة متأخرة من الحمل. الصحيح: التعريب والجانب من الغدة الثديية في مرحلة متأخرة من الحمل في الماوس. لاحظ أنه أثناء الرضاعة، والغدد الثديية أكثر سمكا وتظهر أكثر بياضا بسبب وجود الحليب في الحويصلات الهوائية. مقتبس من http://ctrgenpath.net/static/atlas/mousehistology/Windows/femaleu/mousemammgldiagram.html وhttp://www.pathbase.net/Necropsy_of_the_Mouse/index.php؟file=Chapter_3.html. يرجى النقر هنا ل عرض نسخة أكبر من هذا الرقم.
-together.within صفحة = "دائما"> 
ويتم تحديد الشكل 5. تحديد الخلايا الظهارية اللمعية وخلايا عضلية ظهارية القاعدية في الغدة الثديية الماوس. MESCs اللمعية وخلايا عضلية ظهارية من قبل معهد التمويل الدولي في الغدة الثديية الماوس في اليوم 10 من الرضاعة، على أساس التعبير عنها من CK-8 و CK-14 ، على التوالي. كانت ملطخة DNA النووية مع دابي (الأزرق). تم الحصول على الصور مع المجهر epifluorescence التقليدية. الصورة المركبة (دمج) تظهر استعلاء وصفها الموافق كازيين (أحمر) والنوى (الأزرق)، على التوالي. -Ig1، سيطرة سلبية دون الأجسام المضادة الأولية. العلامات النجمية تشير شمعة. على نطاق وبار = 100 ميكرون. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
ه 6 "SRC =" / ملفات / ftp_upload / 53179 / 53179fig6.jpg "/>
الرقم 6. توطين الخلوي من كازيين في الغدة الثديية الماوس. تم الكشف عن كازيين من قبل معهد التمويل الدولي في الغدة الثديية الماوس في اليوم 10 من الرضاعة. وقد تم جمع الغدة الثديية من الإناث في وجود (+ ع) أو في غياب (-p) من الجراء. تم الحصول على الصور مع التقليدية (يمين لوحة، كازيين، نوى ودمج) أو متحد البؤر (كازيين (الأحمر)، يسار لوحة) مضان المجهر. في كل الأحوال، يتم الكشف عن كازيين (الأحمر) في المنطقة القمية (السهام) وأكثر من ذلك أو أقل في القاعدية من MESCs (السهام). ضوابط السلبية دون الأجسام المضادة الأولية لا تظهر أي وسم (-Ig1). اتسخت DNA النووي مع دابي (الأزرق). الصورة المركبة (دمج) تظهر استعلاء وصفها الموافق كازيين (أحمر) والنوى (الأزرق)، على التوالي. العلامات النجمية تشير شمعة. على نطاق وبار = 100 ميكرون للصور epifluorescence (اللوحة اليمنى، كازيين، نوى، دمج) و= 10 &# 181؛ م للصور مبائر (العمود الأيسر) الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
تم الكشف عن الرقم 7. توطين الخلوي من منتجات الألبان في الماوس الغدة الثديية. الكازين (أحمر) من خلال معهد التمويل الدولي في الغدة الثديية الماوس في اليوم 10 من الرضاعة في وجود (+ ع) أو في غياب (-p) من الجراء. وcounterstained الدهون المحايدة (CLDs وMFGs) مع bodipy 493/503 (الخضراء). الصور المركبة (دمج) تظهر استعلاء على labelings اثنين. تم الحصول على الصور كما Z-مداخن مع المجهر متحد البؤر. Z-مداخن وآخر تعامل مع يماغيج لتوليد Z التوقعات (Zproj) أو إسقاطات 3D (المحور الصادي) (3D مسقطة) من مداخن كاملة في كل قناة على حد سواء (دمج). العلامات النجمية تشير شمعة. شريط النطاق= 10 ميكرون. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.

تم الكشف عن الرقم 8. توطين الخلوي من butyrophilin والدهون في الغدة الثديية الماوس. BTN1 (أحمر) من خلال معهد التمويل الدولي في الماوس الغدة الثديية في اليوم 10 من الرضاعة في غياب الجراء. وcounterstained الدهون المحايدة (CLDs وMFGs) وDNA النووي مع bodipy 493/503 (الخضراء) ودابي (الأزرق)، على التوالي. تم الحصول على الصور مع المجهر متحد البؤر كصورة Z-المداخن. يتم عرض النتائج على هيئة صورة واحدة المستخرج من المكدس الصورة (صورة، BTN1، والدهون، ونوى ودمج) أو بعد بعد العلاج مع يماغيج لتوليد رأي 3D (المحور الصادي) صورة كاملة كومة (مسقطة 3D، BTN1 والدهون، نوى، دمج). الصور المركبة (دمج) عرضالتراكب من قنوات اللون الثلاثة. -Ig1، سيطرة سلبية دون الأجسام المضادة الأولية. العلامات النجمية تشير شمعة. شريط النطاق = 10 ميكرومتر. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.

تم الكشف عن الرقم 9. توطين الخلوي من اثنين من البروتينات كمين في الماوس الغدة الثديية. Syntaxin 6 (Stx6) وVAMP4 (V4) من خلال معهد التمويل الدولي في الغدة الثديية الماوس في اليوم 10 من الرضاعة. تم الحصول على الصور مع التقليدي (التحويل) epifluorescence أو متحد البؤر (LSM) المجهر. الصور المركبة (دمج) تظهر استعلاء وصفها لوحظ لكل بروتين الفخ (أحمر) وDNA النووي counterstained مع دابي (اللون الأخضر كاذبة)، على التوالي. -Ig1، سيطرة سلبية دون الأجسام المضادة الأولية. النجمةالصورة تشير شمعة. مقياس شريط = 10 ميكرون للصور مبائر و= 100 ميكرون للحصول على صور epifluorescence. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.


الجدول 1. المناعية دليل استكشاف الأخطاء وإصلاحها.

تم الكشف عن فيلم التكميلي 1. توطين butyrophilin في الغدة الثديية الماوس. BTN1 (أحمر) من خلال معهد التمويل الدولي في الغدة الثديية الماوس في اليوم 10 من الرضاعة. تم الحصول على الصور مع المشترك المجهر nfocal باعتباره Z المكدس وآخر تعامل مع يماغيج لتوليد فيلم. تتم قراءة Z كومة من أعلى إلى أسفل. الرجاء انقر هنا لمشاهدة هذا الفيديو.

تم الكشف عن فيلم التكميلي 2. توطين butyrophilin والدهون المحايدة في الغدة الثديية الماوس. BTN1 (أحمر) من خلال معهد التمويل الدولي في الماوس الغدة الثديية في اليوم 10 من الرضاعة. وcounterstained الدهون المحايدة (CLDs وMFGs) وDNA النووي مع bodipy 493/503 (الخضراء) ودابي (الأزرق)، على التوالي. تم الحصول على الصور مع المجهر متحد البؤر باعتبارها Z كومة لكل قناة لون، وكانت آخر تعامل مع يماغيج لتوليد مركب Z كومة أن تطغى قنوات اللون الثلاثة. قراءة الناتج مركب Z كومة من أعلى إلى أسفل.https://www.jove.com/files/ftp_upload/53179/supvid2.mp4 "الهدف =" _ فارغة "> الرجاء انقر هنا لمشاهدة هذا الفيديو.
تم الكشف عن فيلم التكميلي 3. توطين butyrophilin في الغدة الثديية الماوس. BTN1 (أحمر) من خلال معهد التمويل الدولي في الغدة الثديية الماوس في اليوم 10 من الرضاعة. تم الحصول على الصور مع المجهر متحد البؤر باعتبارها Z المكدس ومع يماغيج (الإسقاط 3D) المعالجة بالمبيدات آخر لتوليد الدورية (المحور الصادي) عرض المكاني لوضع العلامات BTN1. الرجاء انقر هنا لمشاهدة هذا الفيديو.

فيلم التكميلي 4. توطين butyrophilin ومحايدة الدهون في أماه الماوستم الكشف عن الغدة mmary. BTN1 (أحمر) من خلال معهد التمويل الدولي في الغدة الثديية الماوس في اليوم 10 من الرضاعة. وcounterstained الدهون المحايدة (CLDs وMFGs) وDNA النووي مع bodipy 493/503 (الخضراء) ودابي (الأزرق)، على التوالي. تم الحصول على الصور مع المجهر متحد البؤر باعتبارها Z كومة لكل قناة لون، وكانت آخر تعامل مع يماغيج لتوليد مركب Z كومة أن تطغى قنوات اللون الثلاثة. وقد استخدم يماغيج (الإسقاط 3D) كذلك لتوليد الدورية (المحور الصادي) عرض المكاني للمركب Z-المكدس. الرجاء انقر هنا لمشاهدة هذا الفيديو.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
IHC هي طريقة بسيطة نسبيا ومباشر التجريبي لتوطين مستضد في أقسام الأنسجة، والتي تعتمد في المقام الأول على التفاعلات حاتمة الأجسام المضادة المحددة. على الرغم من أن يتم استخدام عدد كبير من البروتوكولات في توطين بروتين من قبل معهد التمويل الدولي، جوهر هذه الإجراءات هو دائما نفسه تقريبا. ومع ذلك، هناك بعض الجوانب الهامة التي يمكن أن تؤثر بشدة نتيجة، وبالتالي يجب أن يكون الأمثل لكل دراسة IHC الفردية. الجانب الأكثر تحديا لهذا النهج هو لتحديد أفضل الظروف التجريبية، أي، تلك توليد إشارة قوية ومحددة للمستضد من الفائدة. المتغيرات التي يجب أخذها بعين الاعتبار لتصميم التجارب والتحسين هي: (1) نوع المستضد (الأنواع، ومستويات التعبير، والموقع التحت خلوية)؛ (2) نوع حاتمة (تسلسل، التشكل، التعديلات بعد متعدية المفترضة)؛ (3) إعداد العينات (التضمين في البارافين أو لأقسام المجمدة)؛ (4) والمنهجيات التثبيتالتطوير التنظيمي (نضح أو الغمر)؛ (5) تثبيتي المستخدمة (الفورمالديهايد، الكحول أو الأسيتون)؛ (6) كاشف الحجب المستخدمة (المصل العادي، BSA أو الحليب الخالي من الدسم). (7) الخطوة AR. (8) طريقة الكشف (مباشرة أو غير مباشرة)؛ (8) نوع من الأجسام المضادة الأولية (وحيدة النسيلة أو بولكلونل)؛ (9) الأجسام المضادة الثانوية (الأنواع والتسمية)؛ (10) counterstains (النووية و / أو غيرها من العلامات مقصورة الخلوية)؛ و(11) وسيلة تركيب (انظر الجدول 1 للاطلاع على التفاصيل). التثبيت والخطوات حظر، على الأقل، يتطلب تعظيم الاستفادة من عوامل إضافية مثل التركيز، ودرجة الحموضة، ودرجة الحرارة، وفترة حضانة مخفف.
على الجانب الحاسم الأول يتعلق بإعداد عينات الأنسجة، والتي ترتبط ارتباطا وثيقا طريقة التثبيت، وهذا بدوره يؤثر على نوعية النتائج. على سبيل المثال، وقطع الأنسجة يمكن أن تكون ثابتة أو لا قبل التضمين. قد تعتمد هذه الخطوة أيضا على طريقة التضمين المختار، أي أكتوبر مجمع مقابل البارافين التضمين، الذي في حد ذاته يعتمد أحيانا على الأجسام المضادة الأولية المستخدمة. الأنسجة التثبيت لا يمكن أن يؤديها في الحي بواسطة perfusing حيوان تخدير مع حل تثبيتي. هذه الطريقة مفيدة للحفاظ على مستضدات عند دراسة أنسجة سليمة ولكن قد لا تكون كافية لإصلاح الأنسجة من الاهتمام. في هذه الحالة، قطعة نسيج صغيرة (لا يزيد سمكها عن 10 مم) يمكن أن تكون مغمورة في محلول تثبيتي. يمكن الأنسجة المجمدة عن طريق غمر النسيج في النيتروجين السائل أو isopentane أعدت، والمفاجئة تجميد ينصح بشدة للكشف احق من التعديلات بعد متعدية مثل الفسفرة. ولكن، على عكس الأنسجة جزءا لا يتجزأ من البارافين التجميد ليست كافية للحفاظ على المدى الطويل من الأنسجة نتيجة لتكوين بلورات الثلج داخل الخلايا التي قد تغير التشكل التحت خلوية. قطع مرة واحدة، أقسام الأنسجة المجمدة يمكن تخزينها في -80 درجة مئوية لمدة تصل إلى 1 سنة. في أي حال، وإعداد عينات الأنسجة تمثل حلا وسطا بين الحفاظ على النسيج/ العمارة الخلوية والحفاظ على سلامة حاتمة.
لأنه يغير من التركيب الكيميائي للأنسجة، فمن الأهمية بمكان لتحسين شروط التثبيت لتجنب حد سواء غير مكتملة (تحت فاي xation) والإفراط (overfixation) فاي xation.
في الواقع، underfixation قد يقلل من إشارة معينة عن طريق تعزيز تدهور بروتين بعض المستضدات. من ناحية أخرى، يمكن أن overfixation يغير من وضع العلامات المحددة من قبل اخفاء حاتمة أو توليد خلفية غير محددة قوية. وهكذا، بالإضافة إلى اختيار الحل تثبيتي، معلمات أخرى مثل فترة حضانة، ودرجة الحرارة ودرجة الحموضة سيؤثر تثبيت الأنسجة. على الرغم من أن PFA هو مثبت الأكثر شيوعا لIHC، فإنه لا يمكن اعتبار تثبيتي "عالمي". PFA يدفع البروتين البروتين والبروتين النووي حمض عبر وصلات، وبالتالي يمكن تعديل artefactually حاتمة (overfixation) ثم منع ريكو لgnition من الأجسام المضادة الأولية. ومع ذلك، حاتمة يمكن المقنعة كذلك من خلال تقنيات AR (انظر أدناه). قد يكون PFA أيضا غير مناسب للكشف عن بعض المستضدات، كما ثبت ذلك للحث على النبات من بعض البروتينات فسفرته من الغشاء إلى السيتوبلازم. في مثل هذه الحالات، PFA يجب أن تحل محلها مثبتات البديلة المناسبة مثل الكحول. على عكس PFA، والكحول مثل الميثانول أو الايثانول لا تحجب الحواتم لأنها تسمح للتثبيت الأنسجة عن طريق الاستعاضة عن جزيئات الماء في الأنسجة. هذا يمكن أن يؤدي إلى ترسب البروتينات ومن ثم منع تفاعل الأجسام المضادة / حاتمة نتيجة للتغيرات متعلق بتكوين. ويعتقد على نطاق واسع أن الكحول لا تخترق، وبالتالي لا تحافظ على التشكل الأنسجة وكذلك PFA. الأسيتون هو مثبت بديل آخر، والذي يستخدم عادة عند التعامل مع غير المثبتة، أقسام الأنسجة الإضافية المجمدة. ومع ذلك، الأسيتون هو عامل التجفيف قوي ويمكن أن يؤدي إلى هطول الأمطار لا رجعة فيه للبروتينات الأنسجة.
بالنسبة لبعض المستضدات، قد تكون هناك حاجة إلى خطوة إضافية من AR للحصول على إشارة جيدة، لا سيما إذا كان مثبت الحث على تغيير متعلق بتكوين أو يغير من تهمة الكهربائي من حاتمة (اخفاء للحاتمة). تهدف طرق AR لعكس هذه العمليات لاستعادة مناعية من حاتمة وتفاعلها لاحق مع الأجسام المضادة الأولية. طرق AR تعتمد بشكل رئيسي على منهجين: (1) التي يسببها البروتيني حاتمة استرجاع، أي مع الانزيمات مثل بروتين K، التربسين أو البيبسين، الذي يلتصق الببتيدات التي تحجب حاتمة. و (2) استرجاع حاتمة الناجمة عن الحرارة، أي باستخدام المايكرويف، طناجر الضغط، والبواخر الخضر وأجهزة التعقيم أو حمامات الماء. هذا النهج الأخير هو زمني خاص، temperature-، buffer-، وحساسة الرقم الهيدروجيني، والظروف المثلى يجب أن تحدد تجريبيا (وأعطى مثالا في قسم البروتوكول). بدلا من ذلك، يمكن تعزيز التقارب من الأجسام المضادة للمستضد لعن طريق تغيير درجة الحموضة أو تركيز الأيونات الموجبة من مخفف الأضداد.
مطلوب خطوة permeabilization أحيانا للحصول على إشارة جيدة للحاتمة الخلايا في أقسام الأنسجة الكثيفة، ولا سيما بالنسبة للمستضد تلطيخ النووي. ويمكن تحقيق ذلك بطرق مختلفة عن طريق استخدام: (1) الكحول أو الأسيتون كما مثبتات؛ أو (2) المنظفات مثل تريتون، NP-40 (0.1-0.2٪ في برنامج تلفزيوني، 10 دقيقة)، ديجيتونين، سابونين أو توين 20 (0،2-0،5٪ لمدة 10 إلى 30 دقيقة) بعد PFA التثبيت. ومع ذلك، فإن اختيار المنظفات يعتمد على موقع الخلوي للحاتمة الكشف عنها. في الواقع، المنظفات القاسية مثل تريتون-X100، الذي إذابة الأغشية الخلوية، هي مناسبة للكشف حاتمة النووي لكنها يمكن أن تؤدي إلى تغيير إشارة على استخراج بعض البروتينات الغشائية. استخدام المنظفات أكثر اعتدالا (سابونين وتوين 20) هي أكثر مناسبة للكشف عن الحواتم حشوية.
الخطوة الثانية الحاسمة هي blockinغرام من تلطيخ غير محددة. الربط من الأجسام المضادة للحاتمة هدفه تحكمه القوى بين الجزيئات (التفاعلات على سبيل المثال، مسعور والأيونية، الرابطة الهيدروجينية). وبالتالي، قد تفاعلات الأجسام المضادة الأولية و / أو الثانوية مع بروتينات أخرى من المضادات هدفهم يؤدي إلى تلطيخ غير محددة. وهذا يولد خلفية مضان عالية، مما يمنع التصور من البروتين من الفائدة (منخفض إشارة / نسبة الضوضاء). حجب الكواشف يقلل من التفاعلات غير محددة دون المساس محدد تفاعل الأجسام المضادة / حاتمة. يتكون الإجراء المشترك لاحتضان أقسام الأنسجة مع الحرارة المعطل المصل العادي أو BSA. عند استخدام المصل العادي، يجب أن يكون من نفس النوع كما ان من الحيوان مجموعة من الأجسام المضادة الثانوية أو من الأنواع غير ذات صلة. في جميع الحالات، يجب أيضا أن يضاف كاشف حجب المحددة إلى منظفة للالأجسام المضادة الأولية والثانوية. وعلاوة على ذلك، واستخدام المنظفات غير الأيونية مثل تريتون X-100، Tوين 20 أو سابونين يساعد على الحد من التفاعلات غير محددة.
المعلمة الثالث، وربما الأكثر أهمية هو اختيار الأجسام المضادة الأولية والتحسين. ومن الواضح أن أفضل خيار هو الضد عالية الجودة مع الحد الأدنى من عبر التفاعل. كما الاجسام المضادة عادة ما تبدي قابلية عالية وخصوصية لحاتمة واحدة، فهي أفضل الوسائل لتميز عضو معين من عائلة البروتين مع الهوية تسلسل عالية. ومع ذلك، يمكن أن يتعرض للخطر تفاعل الأجسام المضادة / حاتمة إذا حاتمة الهدف فقد حالته بتكوين الأم أو عندما منعت الوصول إلى حاتمة بواسطة التفاعل مع غيرها من البروتينات، والتعديلات بعد متعدية، ودرجة الحرارة، درجة الحموضة، وتثبيت وتركيز الملح. في مثل هذه الحالات، الأجسام المضادة هي أكثر ملاءمة لأنها تعترف الحواتم متعددة من نفس البروتين. وعلاوة على ذلك، فإنها غالبا ما تكون أكثر استقرارا من الأجسام المضادة وحيدة النسيلة على نطاق واسع من درجة الحموضة وتركيز الملح.لها دراسات أولية لتحديد شروط الحضانة المناسبة، أي العمل التخفيف (الأجسام المضادة أحادية المنشأ: 5-25 ملغ / مل، الأجسام المضادة بولكلونل: 1،7 حتي 15 ملغ / مل)، فترة حضانة، مخفف، ودرجة الحرارة، والتي يجب أن تكون تصميما تجريبيا لل كل الأجسام المضادة الأولية. هذه المعايير يجب أن يكون الأمثل لتحديد الظروف التي تنتج إشارة الأمثل مع انخفاض الضوضاء في الخلفية. ويحظي خصوصية وضع العلامات من قبل مرات حضانة أطول في درجات حرارة منخفضة (أي.، 4 ° C مقابل RT).
الاختيار لأداء الكشف مباشر أو غير مباشر غالبا ما يعتمد على مستوى مستضد التعبير. على سبيل المثال، يمكن ببساطة اكتشاف حاتمة أعرب للغاية مع الأجسام المضادة الأولية-تألقي مترافق، وبالتالي السماح لمتعدد الألوان تلطيخ سريعة وبسيطة مع تجنب الممكنة خلفية غير محددة بسبب استخدام الأجسام المضادة الثانوية. ومع ذلك، توجيه IF مايو يولد إشارة منخفضة بتكلفة أعلى، ويمكن ليالييكون ometimes الصعب، الأجسام المضادة عندما وصفت غير متوفرة تجاريا. على العكس، معهد التمويل الدولي هو أكثر حساسية للكشف عن الحواتم وأعرب الدنيا كما إشارة ولدت هي أكثر كثافة بسبب التفاعل بين اثنين على الأقل من الأجسام المضادة الثانوية المسمى (التي أثيرت ضد الأنواع المضيفة الأجسام المضادة الأولية) مع الأجسام المضادة الأولية (التضخيم). وعلاوة على ذلك، مجموعة واسعة من الأجسام المضادة الثانوية مترافق لمختلف fluorophores متاحة تجاريا، وغير مكلفة نسبيا، والسيطرة النوعية. ومع ذلك، يمكن لهذا النهج لحث عبر التفاعل، وبالتالي يتطلب أن تختار بعناية الأجسام المضادة الأولية التي لا تنتج في نفس النوع أو من isotypes مختلفة عند إجراء التجارب متعددة العلامات. معهد التمويل الدولي أيضا يتطلب في بعض الأحيان الخطوات حجب اضافية ويجب أن تشمل ضوابط السلبية منهجية (انظر أدناه). التضخيم ويمكن تحقيق مزيد باستخدام الأجسام المضادة الثانوية البيوتين مترافق وfluorescently المسمى أفيدين أو streptavidin (أربعة biotins ملزمة لكل موlecule). ومع ذلك، يتطلب هذا الأسلوب التضخيم خطوات إضافية لمنع غير محددة وملزمة ولا يجوز تكييفها للتلوين بعض الأنسجة (الكبد، الكلى، القلب والدماغ والرئة والمرضعات الغدة الثديية) وذلك بسبب وجود مستويات عالية من البيوتين الذاتية . ومع ذلك، يمكن حظر البيوتين الذاتية التي كتبها قبل احتضان العينة مع أفيدين وبعد ذلك مع البيوتين قبل الحضانة مع الأجسام المضادة الأولية. اختيار fluorochromes مترافق، والتي هي جزيئات كيميائية صغيرة مع الخاصية لينبعث ضوء عند اثارته ضوء طول موجي أقصر، يعتمد بالدرجة الأولى على نوع من المعدات المجهر المتاحة.
عندما تكون مصممة بشكل صحيح للحد من كلا التفاعل المتبادل بين الأجسام المضادة وتقاطع بين الخواص الطيفية للfluorochromes المستخدمة، IHC استنادا المناعي-يسمح للتصور في وقت واحد من أهداف الخلوية متعددة.
آخر حاسمةنقاط بشأن التجارب IHC تتعلق الضوابط الإيجابية والسلبية التي يجب تنفيذها لدعم صحة تلطيخ، لتحديد الأعمال الفنية التجريبية والتفسير الدقيق للنتائج. بعض الأنسجة يحمل خلفية الفلورسنت عالية (ويشار إلى تألق ذاتي) التي يمكن أن تؤدي إلى سوء تفسير النتائج. وهكذا، على أقسام الأنسجة التي يتعين مراعاتها في إطار كل مضان ومشرق الميدان الإضاءة قبل بدء التجربة IHC. يجب منهجية يتم تضمين السيطرة السلبية التي يغفل الأجسام المضادة الأولية في كل تجربة IHC من أجل ضمان أن المحتمل ملزم من الأجسام المضادة الثانوية غير محددة لا يكاد يذكر، ولا غامضة أو يشابه نمط تلطيخ محددة. وisotype السيطرة يمكن القيام بها عند العمل مع الأجسام المضادة وحيدة النسيلة الأساسي عن طريق الاستعاضة عن ذلك مع الأجسام المضادة غير المحصنين من نفس نمط إسوي (على سبيل المثال، IgG1، IgG2A، IgG2B، الغلوبولين المناعي) في نفس التركيز. هذه السيطرة يساعد على وفاقtimate تلطيخ غير محددة، والتي قد تكون نتيجة لتفاعلات الأجسام المضادة مع العينة. للتدليل على محددة وملزمة من الأجسام المضادة للمستضد، ويمكن أن يتحقق عنصر تحكم امتصاص بطريقتين لما قبل احتضان الأجسام المضادة الأولية: (1) مع مستمنع لها للذوبان (10: 1 نسبة الرحى) O / N عند 4 درجات مئوية ؛ و (2) مع الخلايا أو الأنسجة المقاطع التي تعبر عن حاتمة من الفائدة ولكن تختلف من الأنسجة درس (على سبيل المثال، انظر الشكل 4B في 59). في كلتا الحالتين، يجب أن يترتب على ذلك من استنزاف من الأجسام المضادة الأولية يؤدي إلى القليل أو أي تلطيخ. نوع آخر من السيطرة يمكن أن يتم باستخدام الأجسام المضادة الأولية غير ذي صلة، أي، الموجهة ضد حاتمة الذي يظهر توطين الخلوية التي تختلف عن حاتمة الفائدة (النووي مقابل حشوية). يجب أن يكون غير ذي صلة الضد من نفس نمط إسوي والأنواع مثل الأجسام المضادة الأولية من الفائدة. يمكن ضوابط إضافية للتجارب IHC تشمل استخدام عينات من TISSUES المعروفة للتعبير عن (الحيوانات المعدلة وراثيا) أو لا (الحيوانات خروج المغلوب) حاتمة من الفائدة. وهذا يمكن أن توفر مرجعا مفيدا ويساعد على تحسين إجراءات IHC.
A القيد الرئيسي تقنيات IF هو أنها لا يمكن تطبيقها على ثابت (ميت) و / أو الخلايا permeabilized، سواء الإجراء المحتمل تحملها التحف. قيود أخرى على هذا النهج هي نتيجة لاستخدام المجهر لمراقبة العينات. أولا، حيث أن قرار بصري من epifluorescence ومتحد البؤر المجهر محدودة، لا ينبغي أن يكون المكان أو الموقع المشترك من البروتينات الكشف عن الإفراط في تفسيرها. ثانيا، photobleaching من أي. يتلاشى من شدة مضان على مر الزمن عند تعرضها للضوء، ويرجع ذلك أساسا إلى توليد أنواع الأكسجين التفاعلية في العينة على مضان الإثارة التي، بدورها، تؤدي إلى تدمير الضوئي من fluorophore. يمكن تقليل photobleaching من خلال: أ) حفظ العينات محمية منضوء أثناء التجربة IF والتخزين حتى مراقبتهم؛ ب) باستخدام وكيل antifade (الزبالين أنواع الاكسجين التفاعلية) في المتوسطة المتزايدة. ج) يقلل من كثافة و / أو مدة ضوء الإثارة. د) زيادة تركيز fluorophores أو باستخدام تركيز منخفض من تألقي مع كفاءة عالية الكم. وه) باستخدام fluorophores قوية التي هي أقل عرضة للphotobleaching من (أي اليكسا Fluors، سيتا Fluors، أو DyLightFluors). ثالثا، تألق ذاتي في كثير من الأحيان بسبب وجود الإنزيمات المساعدة فلافين (FAD وFMN: الاستيعاب، 450 نانومتر؛ الانبعاثات، 515 نانومتر)، وتخفيض النيوكليوتيدات البيريدين (NADH: الاستيعاب، 340 نانومتر؛ الانبعاثات، 460 نانومتر) في خلايا الثدييات. وعلاوة على ذلك، فإن استخدام الألدهيدات، وخاصة غلوتارالدهيد، لتحديد العينات، يمكن أن يؤدي إلى مستويات عالية من تألق ذاتي. هذا يمكن التقليل من غسل العينات مع 0،1٪ بوروهيدريد الصوديوم في برنامج تلفزيوني قبل الأجسام المضادة الحضانة و / أو عن طريق اختيار تحقيقات والمرشحات الضوئية التي مaximize إشارة مضان المتعلقة تألق ذاتي. رابعا، تداخل مضان (تسمى أيضا-تنزف من خلال تقاطع أو تداخل الإشارات) ويرجع ذلك أساسا إلى انبعاث الخصائص الطيفية للfluorophores لأنها غالبا ما يظهرون عرض نطاق ترددي واسع جدا، مختلفة، لمحات الطيفية غير المتكافئة، فضلا عن العديد من انبعاث موجات الذروة وعدد من ماكسيما. يحدث مضان التداخل عند العمل مع العديد من fluorophores (الوسم متعدد الألوان) ويتميز عن انبعاث fluorophore واحد في قناة (فلتر) من fluorophore آخر. يجب أن يكون الحد الأدنى التحف ينزف من خلال لأنها في كثير من الأحيان إلى تعقيد تفسير IF النتائج، وخصوصا في حالة المشاركة في توطين أو الدراسات الكمية. كما موازنة انبعاثات fluorophores لا يمكن إلا أن تحسنت قليلا قبل إجراء IF، ينزف من خلال يمكن أن تكون أساسا خفضت في وقت الحصول على الصور باستخدام أمثل مجموعات مرشح مضان و / أو كاشف مضخم من أجل separ صحيحأكل لمحات طيفية من fluorophores. وفي هذا الصدد، الفحص المجهري متحد البؤر غير مناسبة تماما لتصوير متعدد الألوان لأنها تتيح للتمايز أطياف الانبعاث مضان من fluorophores الفردية عن طريق توجيه كل إشارة إلى قناة الكشف معينة. وعلاوة على ذلك، الفحص المجهري متحد البؤر يسمح لضبط الربح، مضخم التيار الكهربائي، أو قوة الليزر للقنوات كشف الفردية لاقتناء متسلسل (fluorophore واحد فقط في كل مرة) لوضع العلامات. من الناحية المثالية، يجب تنفيذ ضوابط تسمية واحدة لقياس تنزف من خلال ونهاية المطاف إزالته حسابيا. A السيطرة من دون الأجسام المضادة الثانوية (التحكم الخلفية) يمكن أن تكون على استعداد لوضع حدود للكسب إشارة وتعويض كل قناة لاقتناء الصورة الأمثل. ويمكن أن تستخدم أيضا لمعالجة ما بعد الشراء لتصحيح صورة الخلفية (تألق ذاتي).
في الختام، وطريقة وصفها يوفر بروتوكول قياسي بسيط لrealizati سهلةعلى من المناعية على أقسام الغدة الثديية. ومع ذلك، يجب أن يكون الأمثل الخطوات الرئيسية لتجربة IHC لكل مستضد / زوجين الأجسام المضادة من أجل تصور تلطيخ محددة وتقليل إشارات خلفية غير محددة. ويشمل الطريقة الموصوفة أيضا العديد من الطرق الأساسية لمرحلة ما بعد العلاج لمعظم الصور التي تم الحصول عليها. مناعي القائم على مضان هو وسيلة قوية مع مجموعة واسعة من التطبيقات من توطين الخلوي للمستضد إلى التشخيص. وسوف يتحقق التطورات الجديدة في هذه المناهج مع التنمية المستقبلية للfluorophores جديدة، وأجهزة اقتناء وتقنيات الفحص المجهري لصورة سبق تفاصيل غير الملحوظة الهياكل البيولوجية والعمليات.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
تعلن الكتاب أنه ليس لديهم المصالح المالية المتنافسة.
Acknowledgments
المؤلفون ممتنون لمرفق الأساسية التصوير INRA MIMA2 (INRA، UMR1198، جوي-أون-Josas) وإلى موظفي وحدة IERP (UE 0907، INRA، جوي-أون-Josas) للحصول على الرعاية والمرافق الحيوانية. كما نود أن نشكر IH ماذر، MC نيفيل وS. Tooze لتزويدنا antibodie مفيدة جدا.
Materials
| Name | Company | Catalog Number | Comments |
| Dissection | |||
| Pins | |||
| Ethanol | |||
| Scissors | |||
| Scalpel and adapted blades | |||
| Ice | |||
| Towel paper | |||
| Tissue sample preparation | Company | Catalog Number | Comments/Description |
| Phosphate Buffered Saline (pH7.4) | Sigma | P-3813 | |
| Paraformaldehyde (PFA, 32% EM grade, 100 ml) | Electron Microscopy Sciences | 15714-S | personnal protection equipment required WARNING: this product will expose you to Formaldehyde Gas, a chemical known to cause cancer |
| OCT compound/Tissue Tek | Sakura | 4583 | |
| Sucrose (D-saccharose) | VWR | 27480.294 | |
| Plastic molds | Dominique Dutscher | 39910 | |
| Liquid nitrogen | |||
| Cryostat/sample support | Leica | CM3050S | |
| Razor blades (SEC35) | Thermo Scientific | 152200 | |
| Slide box | |||
| Glass slides Superfrost/Superfrost Ultra Plus | Thermo Scientific | 10143560W90/1014356190 | |
| Brushes | |||
| IHC | Company | Catalog Number | Comments/Description |
| Super Pap Pen | Sigma | Z377821-1EA | |
| Permanent marker (black) | |||
| 50 mM NH4Cl in PBS | Sigma | A-0171 | |
| 0.1 M glycine in PBS | VWR | 24403.367 | |
| Antigen Retrieval solution: Tris 100 mM 5% urea pH9.6 | |||
| Heater (up to 100°C) | |||
| Bovine Serum Albumin (BSA) | Sigma | A7906-100G | |
| Vectashield (anti-fading mounting medium) without DAPI/with DAPI | Vector Laboratories | H-1000/H-1200 | |
| Glass coverslips 22x50mm (microscopy grade) | VWR | CORN2980-225 | |
| Nail polish | |||
| Primary antibodies | Company | Catalog Number | Comments/Description |
| Rabbit anti-mouse caseins (#7781; 1:50 dilution) | generously gifted by M.C. Neville (University of Colorado Health Sciences Center, USA) |
||
| Mouse anti-cytokeratin 8 (CK8, clone 1E8, 1:50 dilution) | Biolegend (Covance) | MMS-162P | |
| Mouse anti-cytokeratin 14 (CK14, cloneLL002, 1:50 dilution) | Thermo Scientific | MS-115-P0/P1 | |
| Rabbit anti-butyrophilin (1:300 dilution) | generously gifted by I.H. Mather (Department of Animal and Avian Sciences University of Maryland College Park, USA) | ||
| Rabbit anti-Stx6 (1:50 dilution) | generously gifted S. Tooze (Cancer Research UK, London Research Institute, London, UK) |
||
| Rabbit anti-VAMP4 (1:50 dilution) | Abcam | ab3348 | |
| Secondary antibodies | Company | Catalog Number | Comments/Description |
| Rhodamine-conjugated goat anti-rabbit IgG (H + L) (1:300 dilution) | Jackson ImmunoResearch Laboratories | 111-025-003 | |
| Counterstains | Company | Catalog Number | Comments/Description |
| Bodipy 493/503 | Life Technologies (Molecular Probes) | D-3922 | |
| DAPI (4-6-diamidino-2-phenylindole) | Life Technologies (Molecular Probes) | D-1306 | |
| Observation/Image capture | Company | Catalog Number | Comments/Description |
| conventional fluorescence microscope | Leica Leitz DMRB microscope |
Standard filters for FITC, Rhodamine and DAPI emissions, ×63 oil-immersion objective (NA 1.3), DP50 imaging camera (Olympus), CellˆF software (Olympus) |
|
| Laser Scanning Microscope (confocal microscopy) | Zeiss LSM 510 microscope |
Plan-Apochromat ×63 oil-immersion objective (NA 1.4), CLSM 510 software, Confocal facilities, MIMA2 Platform, INRA Jouy-en-Josas, France, http://mima2.jouy.inra.fr/mima2) | |
| Image treatment | Company | Catalog Number | Comments/Description |
| ImageJ 1.49k software | Free software |
References
- Watson, C. J., Khaled, W. T. Mammary development in the embryo and adult: a journey of morphogenesis and commitment. Development. , 135-995 (2008).
- Smith, G. H. Experimental mammary epithelial morphogenesis in an in vivo model: evidence for distinct cellular progenitors of the ductal and lobular phenotype. Breast Cancer Res Treat. 39, 21-31 (1996).
- Van Keymeulen, A., et al. Distinct stem cells contribute to mammary gland development and maintenance. Nature. 479, 189-193 (2011).
- Oakes, S. R., Gallego-Ortega, D., Ormandy, C. J. The mammary cellular hierarchy and breast cancer. Cell Mol Life Sci. 71, 4301-4324 (2014).
- Visvader, J. E., Stingl, J. Mammary stem cells and the differentiation hierarchy: current status and perspectives. Genes & development. 28, 1143-1158 (2014).
- Robinson, G. W. Cooperation of signalling pathways in embryonic mammary gland development. Nat Rev Genet. 8, 963-972 (2007).
- Cowin, P., Wysolmerski, J. Molecular mechanisms guiding embryonic mammary gland development. Cold Spring Harb Perspect Biol. 2, a003251 (2010).
- Brisken, C., O'Malley, B. Hormone action in the mammary gland. Cold Spring Harb Perspect Biol. 2, a003178 (2010).
- Gjorevski, N., Nelson, C. M. Integrated morphodynamic signalling of the mammary gland. Nat Rev Mol Cell Biol. 12, 581-593 (2011).
- Daniel, C. W., Smith, G. H. The mammary gland: a model for development. J Mammary Gland Biol Neoplasia. 4, 3-8 (1999).
- Howlett, A. R., Bissell, M. J. The influence of tissue microenvironment (stroma and extracellular matrix) on the development and function of mammary epithelium. Epithelial Cell Biol. 2, 79-89 (1993).
- Edwards, G., Streuli, C. Signalling in extracellular-matrix-mediated control of epithelial cell phenotype. Biochem Soc Trans. 23, 464-468 (1995).
- Hennighausen, L., Robinson, G. W. Think globally, act locally: the making of a mouse mammary gland. Genes & development. 12, 449-455 (1998).
- Topper, Y. J., Freeman, C. S. Multiple hormone interactions in the developmental biology of the mammary gland. Physiol Rev. 60, 1049-1106 (1980).
- Brisken, C., et al. A paracrine role for the epithelial progesterone receptor in mammary gland development. Proc Natl Acad Sci U S A. 95, 5076-5081 (1998).
- Ormandy, C. J., Binart, N., Kelly, P. A. Mammary gland development in prolactin receptor knockout mice. J Mammary Gland Biol Neoplasia. 2, 355-364 (1997).
- Oakes, S. R., Rogers, R. L., Naylor, M. J., Ormandy, C. J. Prolactin regulation of mammary gland development. J Mammary Gland Biol Neoplasia. 13, 13-28 (2008).
- Hennighausen, L., Robinson, G. W. Information networks in the mammary gland. Nat Rev Mol Cell Biol. 6, 715-725 (2005).
- Kouros-Mehr, H., Werb, Z. Candidate regulators of mammary branching morphogenesis identified by genome-wide transcript analysis. Dev Dyn. 235, 3404-3412 (2006).
- Khaled, W. T., et al. The IL-4/IL-13/Stat6 signalling pathway promotes luminal mammary epithelial cell development. Development. 134, 2739-2750 (2007).
- Asselin-Labat, M. L., et al. Gata-3 is an essential regulator of mammary-gland morphogenesis and luminal-cell differentiation. Nat Cell Biol. 9, 201-209 (2007).
- Barcellos-Hoff, M. H., Aggeler, J., Ram, T. G., Bissell, M. J. Functional differentiation and alveolar morphogenesis of primary mammary cultures on reconstituted basement membrane. Development. 105, 223-235 (1989).
- Robinson, G. W., McKnight, R. A., Smith, G. H., Hennighausen, L. Mammary epithelial cells undergo secretory differentiation in cycling virgins but require pregnancy for the establishment of terminal differentiation. Development. 121, 2079-2090 (1995).
- Streuli, C. H., Bissell, M. J. Mammary epithelial cells, extracellular matrix, and gene expression. Cancer Treat Res. 53, 365-381 (1991).
- Streuli, C. H., et al. Laminin mediates tissue-specific gene expression in mammary epithelia. J Cell Biol. 129, 591-603 (1995).
- Boudreau, N., Sympson, C. J., Werb, Z., Bissell, M. J. Suppression of ICE and apoptosis in mammary epithelial cells by extracellular matrix. Science. 267, 891-893 (1995).
- Pullan, S., et al. Requirement of basement membrane for the suppression of programmed cell death in mammary epithelium. J Cell Sci. 109 (Pt 3), 631-642 (1996).
- Schmidhauser, C., Bissell, M. J., Myers, C. A., Casperson, G. F. Extracellular matrix and hormones transcriptionally regulate bovine beta-casein 5' sequences in stably transfected mouse mammary cells. Proc Natl Acad Sci U S A. 87, 9118-9122 (1990).
- Streuli, C. H., et al. Stat5 as a target for regulation by extracellular matrix. J Biol Chem. 270, 21639-21644 (1995).
- Sollner, T., et al. SNAP receptors implicated in vesicle targeting and fusion. Nature. 362, 318-324 (1993).
- Jahn, R., Scheller, R. H. SNAREs--engines for membrane fusion. Nat Rev Mol Cell Biol. 7, 631-643 (2006).
- Weber, T., et al. SNAREpins: minimal machinery for membrane fusion. Cell. 92, 759-772 (1998).
- Sollner, T., Bennett, M. K., Whiteheart, S. W., Scheller, R. H., Rothman, J. E. A protein assembly-disassembly pathway in vitro that may correspond to sequential steps of synaptic vesicle docking, activation, and fusion. Cell. 75, 409-418 (1993).
- McNew, J. A. Regulation of SNARE-mediated membrane fusion during exocytosis. Chem Rev. 108, 1669-1686 (2008).
- Wang, C. C., et al. VAMP8/endobrevin as a general vesicular SNARE for regulated exocytosis of the exocrine system. Mol Biol Cell. 18, 1056-1063 (2007).
- Chat, S., et al. Characterisation of the potential SNARE proteins relevant to milk product release by mouse mammary epithelial cells. Eur J Cell Biol. 90, 401-413 (2011).
- Reinhardt, T. A., Lippolis, J. D. Bovine milk fat globule membrane proteome. J Dairy Res. 73, 406-416 (2006).
- Robenek, H., et al. Butyrophilin controls milk fat globule secretion. Proc Natl Acad Sci U S A. 103, 10385-10390 (2006).
- Fujimoto, T., Ohsaki, Y., Cheng, J., Suzuki, M., Shinohara, Y. Lipid droplets: a classic organelle with new outfits. Histochem Cell Biol. 130, 263-279 (2008).
- Mather, I. H., Keenan, T. W. Origin and secretion of milk lipids. J Mammary Gland Biol Neoplasia. 3, 259-273 (1998).
- Heid, H. W., Keenan, T. W. Intracellular origin and secretion of milk fat globules. Eur J Cell Biol. 84, 245-258 (2005).
- McManaman, J. L., Russell, T. D., Schaack, J., Orlicky, D. J., Robenek, H. Molecular determinants of milk lipid secretion. J Mammary Gland Biol Neoplasia. 12, 259-268 (2007).
- de Assis, S., Warri, A., Cruz, M. I., Hilakivi-Clarke, L. Changes in mammary gland morphology and breast cancer risk in rats. Journal of visualized experiments : JoVE. , (2010).
- Plante, I., Stewart, M. K., Laird, D. W. Evaluation of mammary gland development and function in mouse models. Journal of visualized experiments : JoVE. , (2011).
- Galio, L., et al. MicroRNA in the ovine mammary gland during early pregnancy: spatial and temporal expression of miR-21, miR-205, and miR-200. Physiol Genomics. 45, 151-161 (2013).
- Linzell, J. L., Peaker, M. The effects of oxytocin and milk removal on milk secretion in the goat. J Physiol. 216, 717-734 (1971).
- Knight, C. H., Peaker, M., Wilde, C. J. Local control of mammary development and function. Rev Reprod. 3, 104-112 (1998).
- Walid, M. S., Osborne, T. J., Robinson, J. S. Primary brain sarcoma or metastatic carcinoma? Indian J Cancer. 46, 174-175 (2009).
- Hue-Beauvais, C., et al. Localisation of caveolin in mammary tissue depends on cell type. Cell Tissue Res. 328, 521-536 (2007).
- McManaman, J. L., Neville, M. C. Mammary physiology and milk secretion. Adv Drug Deliv Rev. 55, 629-641 (2003).
- Mather, I. H., Jack, L. J. A review of the molecular and cellular biology of butyrophilin, the major protein of bovine milk fat globule membrane. J Dairy Sci. 76, 3832-3850 (1993).
- Heid, H. W., Winter, S., Bruder, G., Keenan, T. W., Jarasch, E. D. Butyrophilin, an apical plasma membrane-associated glycoprotein characteristic of lactating mammary glands of diverse species. Biochim Biophys Acta. 728, 228-238 (1983).
- Bock, J. B., Klumperman, J., Davanger, S., Scheller, R. H. Syntaxin 6 functions in trans-Golgi network vesicle trafficking. Mol Biol Cell. 8, 1261-1271 (1997).
- Tran, T. H., Zeng, Q., Hong, W. VAMP4 cycles from the cell surface to the trans-Golgi network via sorting and recycling endosomes. J Cell Sci. 120, 1028-1041 (2007).
- Wendler, F., Page, L., Urbe, S., Tooze, S. A. Homotypic fusion of immature secretory granules during maturation requires syntaxin 6. Mol Biol Cell. 12, 1699-1709 (2001).
- Wendler, F., Tooze, S. Syntaxin 6: the promiscuous behaviour of a SNARE protein. Traffic. 2, 606-611 (2001).
- Shitara, A., et al. VAMP4 is required to maintain the ribbon structure of the Golgi apparatus. Mol Cell Biochem. 380, 11-21 (2013).
- Thibault, C., Levasseur, M. C. La reproduction chez les mammifères et l'homme. , INRA Editions. 928 (2001).
- Truchet, S., Wietzerbin, J., Debey, P. Mouse oocytes and preimplantation embryos bear the two sub-units of interferon-gamma receptor. Mol Reprod Dev. 60, 319-330 (2001).



