Summary
Den indirekte immunfluorescens protokoll beskrevet i denne artikkelen, tillater påvisning og lokalisering av proteiner i musebrystkjertelen. En komplett fremgangsmåte er gitt for å fremstille melkekjertlene prøver, for å utføre immunhistokjemi, å avbilde vevssnittene ved fluorescens mikroskopi, og å rekonstruere bilder.
Abstract
Indirekte immunfluorescens blir brukt til å detektere og lokalisere proteiner av interesse i et vev. Protokollen som presenteres her beskriver en komplett og enkel metode for immun påvisning av proteiner, musemelkegivende brystkjertel blir tatt som et eksempel. En protokoll for utarbeidelsen av vevsprøver, spesielt om disseksjon av mus melkekjertlene, vev fiksering og frosset vev seksjonering, er detaljerte. En standard protokoll for å utføre indirekte immunfluorescens, inkludert en valgfri antigen gjenfinning trinn blir også presentert. Observasjon av de merkede vevssnittene samt bilde oppkjøp og etterbehandling er også oppgitt. Denne prosedyren gir full oversikt, fra samlingen av animalsk vev på det cellulære lokalisering av et protein. Selv om denne generelle metode kan anvendes på andre vevsprøver, bør det være tilpasset hvert vev / primært antistoff par studert.
Introduction
Melkekjertlene er et atypisk pattedyr eksokrin organ hvis viktigste funksjon er å produsere melk til å mate nyfødte. Utviklingen av brystvev forekommer hovedsakelig etter fødselen, og er karakterisert ved en unik fremgangsmåte hvor epitelet invaderer den omkringliggende stroma. Dette vevet gjennomgår mange endringer (vekst, differensiering og regresjon), spesielt i løpet av voksenlivet, samtidig med variasjoner i reproduktiv status (figur 1). I tillegg til den totale morfologi av vev, andelene av forskjellige celletyper, så vel som deres arrangement i melkekjertelen dramatisk endre seg under utvikling 1-5.
I løpet av embryonisk liv, utleder brystepitel fra brystmelkeledninger, som er definert ved en svak fortykning og lagdeling av ektoderm, mellom for- og baklemmene på hver side av midtlinjen rundt embryodag 10,5 (E10.5) (figur 1A ).På E11.5, melk linjen bryter opp i individuelle placodes, som er symmetrisk plassert langs melke melk linjen på reproduserbare steder, og det omkringliggende mesenchyme begynner å kondensere. De placodes begynne å synke dypere inn i dermis og melke mesenchyme organiserer i konsentriske lag rundt melke bud (E12.5-E14.5). Per E15.5, melke epitel, begynner å spre seg og forlenge å danne primære spire som presser gjennom melke mesenchyme mot fettpute. Den primære spire utvikler en hul lumen med en åpning på huden, som er merket ved dannelsen av nippelen kappen. På E18.5 har elongating duct vokst til fettpute og har forgrenet inn i en liten arborized ductal systemet omfattet i fettpute. Utviklingen er i hovedsak arrestert og rudimentær melkekjertlene forblir morphogenetically hvilende inntil puberteten. I den mannlige foster, aktivering av androgen-reseptorer fører til degenerering av knopper, som forsvinnerved E15.5. Per E18, mammary utvikling opphører før puberteten 6-9.
Ved fødselen, havner melkekjertlene en rudimentær duktal system som forlenges og grener sakte (isometrisk vekst). Ved utbruddet av pubertet, sfæriske strukturer som ligger på tuppen av kanalene kalles terminal endeknopper (TEBs), dannes av et ytre lag av cap celler og et flerlags indre kjerne av celler (celler i kroppen). Disse strukturene er svært proliferativ og infiltrere omliggende stromal vev som svar på hormonelle signaler. Spredning innenfor TEBs resultater i duktal forlengelse, kombinert med forgrening morphogenesis. Denne prosessen fører til at det etableres en grunnleggende epitelial arborized nettverk som kommer fra nippelen (figur 1B, pubertet). På ~ 10-12 uker etter fødselen, når Epitel har invadert hele fett puten, stopper og sin ekspansjon i TEBs forsvinne. Ductal utvikling gjennomgår deretter dynamiske endringer, dvs. successive spredning og regresjon av epitelceller i henhold til østrogensyklus 10 (figur 1B, voksen).
Fra begynnelsen av svangerskapet, gjennomgår brystvev viktig vekst og morfologiske endringer for å forberede laktasjon. Den melkekjertelepitelet omfattende spre og differensiere, fører til et sterkt forgrenet tubulointerstitiell alveolar nettverk. Samtidig, mammary epitelceller (mecs) blir polarisert og i stand til å syntetisere og skiller melkeprodukter. Mecs organisere inn i mange alveolære strukturer (acini) som er omgitt av kontraktile korgcellene og innlemmet i en stroma består av bindevev og fettvev, blodkar og nerveterminaler (figur 1B, graviditet). Videre er det basale siden av mecs i nær kontakt med basalmembranen (ekstracellulær matriks), og vekselvirkning mellom disse to enhetene tett regulere både morfogenese og sekretorisk funksjon av mammary epitel 11-13.
Alle disse prosessene er avhengige av virkningen av ulike miljø signaler, hvorav de viktigste er hormones14, parakrine faktorer og ekstracellulære matrise. For eksempel induserer progesteron omfattende sideforgrening 15 og alveologenesis som i kombinasjon med prolaktin (PRL) 16,17, fremmer og opprettholder differensiering av alveolene. I tillegg til steroider og PRL18, cytokiner og signalveier knyttet til utvikling (Wnt og Notch signalveier) er også involvert i bryst avstamning engasjement og utvikling 19-21. Ved slutten av svangerskapet, luminal mecs begynne å produsere et proteinrikt melk kalt kolostrum i lumen av alveolene. I tillegg fungerer progesteron på epiteliale permeabilitet og siden de tett veikryss er fortsatt åpne, er råmelk også funnet i mors blod stream.
Etter fødsel, den Mammary epitelet opptar nesten hele brystkjertelen volum og er høyt organisert (figur 2, brystepitel). Melkeproduserende enheter, nemlig alveoler (figur 2, tannhulen), er dannet av et monolag av polariserte mammary epiteliale sekretoriske celler (MESCs), med sin apikale plasmamembranen som avgrenser hulrommet. Alveolene ordne seg inn lobules som er gruppert i fliker som er koblet til kanaler som drenerer melk til utsiden miljø (figur 2, lapp). Amming oppstår, altså., MESCs begynner å utskille rikelige mengder melk, først og fremst utløst av fallet i placenta hormoner (hovedsakelig progesteron) (figur 1B, amming). Melk-proteingenene er aktivert i en tidsmessig definert tidsforløp som strekker seg fra graviditet til amming 9,22,23, hovedsakelig som svar på hypofysen PRL frigjøres ved suging. Samtidig, kontakter mellom MESCs og ekstracellulære matrise både stimulerer melkeprotein synthesis gjennom signaler som formidles via interaksjoner mellom cellulære inte og laminin 24,25, og undertrykke apoptose i MESCs 26,27. Disse signalveier resultere i aktivering av melkeprotein genet promotorer 28 gjennom aktivering av spesifikke transkripsjonsfaktorer 29. Celle-celle-kontakter er også viktig for noen aspekter av differensiering, inkludert etablering av apikal polaritet og vektor sekresjon av melkeprodukter. Tett veikryss raskt tett etter begynnelsen av laktasjonen og MESCs fint organisere opptaket av molekyler fra blodet, så vel som syntesen, transport og sekresjon av melkekomponenter, i respons til de ernæringsmessige behov for nyfødte. På tidspunktet for suging, oppstår sammentrekning av korg celler som omgir alveolene i respons til oxytocin og fører til melke utstøting gjennom kanalene og inn i nippelen. Melk er en sammensatt væske som inneholder proteiner (for det mestekaseiner), sukker (hovedsakelig laktose), lipider og mineraler, samt bioaktive molekyler slik som immunoglobuliner A (IgA), vekstfaktorer og hormoner. Kaseiner blir syntetisert, samlet i supramolekylære strukturer, nemlig casein miceller, transporteres langs den sekretoriske vei, og deretter frigjøres ved exocytose, dvs. blanding av kasein inneholdende sekretoriske vesikler (SVs) med den apikale plasmamembranen til Mesc (figur 2).
Intracellulær trafikk er avhengig av materielle utveksling mellom membran avdelinger og innebærer Løselig N-etylmaleimid-Sensitive Fusion (NSF) Vedlegg Protein (SNAP) Receptor (SNARE) 30,31. Snaren proteiner familien er inndelt i vesikulær snarer (v-snarer), til stede i vesikkelmembranen, og målet snarer (t-snarer), lokalisert på målet membraner. Ved som gjennom sine kveil-spiral-domener, V- og T-snarene sammen for å danne en svært stabil fire-heliksbunt kompleks, referert til som the SNARE kompleks. Dette komplekset fremmer fusjon av to motstående lipidbilag ved gradvis å bringe dem i tett nærhet 30,32. Etterpå er snare komplekser dissosiert av NSF adenosin triphosphatase og dets adapter protein SNAP og snare proteiner blir resirkulert tilbake til sitt segment til opprinnelses 33. Interessant, hver SNARE protein hovedsakelig ligger i forskjellige cellulære avdelinger og SNARE sammenkobling kan bidra til spesifisitet av intracellulære fusjons hendelser 34. Tidligere studier antyder at minst synaptosomale tilknyttet protein 23 (SNAP23) og Vesikkel-Associated Membrane Protein 8 (VAMP8), og syntaxins (STX) -7 og -12 spille en rolle i kasein exocytose 35,36. Disse proteinene har også blitt funnet i forbindelse med lipid fraksjon av melk, dvs. melk fettkulene (MFGs) 37. Den nåværende rådende modell postulerer at cytoplasmatiske lipiddråper (CLDs) er dannet ved akkumulering av nøytralt lipids (hovedsakelig triacylglyceroler og sterolestere) og kolesterol avledet fra mors kosthold mellom de to flygeblader i det endoplasmatiske retikulum (ER) membran 38-41. Store CLDs er dannet, i det minste delvis, ved fusjon av mindre CLDs under transport til den apikale siden av MESCs hvor de blir utgitt som MFGs (1-10 mikrometer i diameter) ved knoppskyting, blir omviklet med Mesc apikale plasmamembranen 40-42. Amming opphører etter pups er avvent og MESCs gradvis dør ved apoptose, som fører til regresjon av brystvev tilbake til en pubertets tilstand (figur 1B, involusjon).
Immunfluorescens (IF) er et felles analyselaboratorium metoden som brukes i nesten alle aspekter av biologi, både i forskning og i klinisk diagnostikk. IF teknikker kan bli utført på vevssnitt (immunhistokjemi, IHC), eller celle (immunocytokjemi, ICC) prøver. Denne kraftige tilnærming er avhengig av bruk av fluorescent-merkede antistoffer som spesifikt binder (direkte eller indirekte) til antigenet av interesse, og således tillate visualisering av dens vevsfordeling gjennom fluorescens mikroskopi. Fluorescenssignaler for det meste avhenge av kvaliteten og konsentrasjonen av antistoffene og korrekt håndtering av prøven. En enkel indirekte immunfluorescens (IIF) protokoll er presentert for å detektere melkeprodukter (kaseiner og MFGs) og proteiner som er involvert i melkeprodukt sekresjon (butyrophilin (BTN1), snare proteiner) på frosne snitt av mus brystvev (figur 3). Mens denne protokollen gir en komplett IHC oversikt, alt fra vev samling til bilde post-behandling, kritisk og valg trinn samt noen tekniske anbefalinger er også presentert og diskutert.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
CD1 mus ble avlet på INRA (UE0907 IERP, Jouy-en-Josas, Frankrike). Alle etiske aspekter av dyr vare oppfylt de relevante retningslinjer og konsesjonskrav fastsatt av franske Landbruksdepartementet. Prosedyrene som benyttes ble godkjent av den lokale etikkutvalg (avtalen 12/097 fra Comethea Jouy-en-Josas / AgroParisTech).
1. melkekjertler Prøvepreparering
- Mus melkekjertler disseksjon
- Avlive mus på dag 10 av amming ved halshugging og pin dyret ned med buken opp.
- Fukt ventralområdet med etanol og tørk den med et papirhåndkle.
- Bruk pinsett, trekke opp magehuden mellom de to bakbena og gjør et snitt (gjennom huden bare) på ca 1 cm med skarp saks. Starter fra denne første snittet, og deretter bruke saks for å klippe huden opp til halsen på musen. Trekk huden bort fra peritoneum og pin nedover den ene siden av huden på en gang, å strekke det læres.
- Samle mage- og inguinal melkekjertlene ved å skyve dem vekk fra huden med en bomullspinne og til slutt trekke eller klippe dem vekk fra bukhinnen.
Bemerk: Ved dette trinnet Carmine fargingen kan utføres for å visualisere brystepitel innen hele pakkboksen 43. Denne fremgangsmåten kan være nyttig for å analysere den globale morfologi av brystkjertelen under forskjellige betingelser (fysiologiske utviklingsstadier, sykdommer, in vivo-behandlinger). - Fjern lymfeknute ligger i krysset av mage- og inguinal kjertler 44.
- Brystvev fiksering
- Skjær brystvev opp i 3 mm tre fragmenter med en skalpell og umiddelbart skylle disse fragmenter i en fosfat-bufret saltoppløsning (PBS) løsning, pH 7,4, for å fjerne så mye melk som mulig.
- Raskt tørke fragmentene på et papirhåndkle og legg dem i en kald PBS løsning som inneholder 4% paraformaldehyde (PFA, HCHO, 32% formaldehyd løsning, FORSIKTIG) for 10 til 15 minutter på isen.
Merk: Dette er nok tid til å tillate påfølgende analyse på brystvev skiver av IIF36 og / eller in situ hybridisering 45. Men som aldehyd-fiksativ penetrere ganske langsomt i vev stykker (~ 1-3 mm per time), denne gangen kan forlenges for å sikre en optimal fiksering av vevsprøve. Alternativt fikse vev in vivo ved perfusert en bedøvet dyret med et fiksativ løsning (ikke detaljert i denne studien).
- Sukrose infusjon
- Raskt skyll melke fragmentene i kald PBS og dyppe dem i en kald PBS-løsning inneholdende 40% sukrose (D-sakkarose, C12H22O11, Mr 342,3 g / mol) i 16 til 48 timer ved 4 ° C under forsiktig risting.
- Tissue embedding
Merk: På dette trinnet, melke fragmenter kan bli re-kutt for å gjøre mindre fragmenter (2-3 mm 3) Eller for å justere deres form.- Riktig merke plastformer og fylle en tredjedel av volumet av formen med oktober forbindelse, holdt ved RT. Plasser en fragment (2-3 mm 3) av brystvev per mold og dekke den med oktober sammensatte.
- Plasser formene ved overflaten av det flytende nitrogen (på et ark av aluminium eller ved hjelp av en metallisk sil) og tillater produktet å fryse.
Merk: Det må bli solid og hvitt før nedsenking av mold i flytende nitrogen.
- Oppbevare de frosne prøvene ved -80 ° C inntil vevssnitt blir utført.
2. Frozen vev Seksjonering
Merk: En kryostat, som er egentlig en mikrotom inne i en fryser, er nødvendig for å gjøre frosne vevssnitt. En lavere temperatur er ofte nødvendig for fett eller fettrike vev som virgin melkekjertler.
- Juster temperaturen kryostaten til -26 ° C og vente til den har Stabilized. Opprettholde den frosne vevsblokk ved -26 ° C i hele seksjonering prosedyren. Absolutt unngå tining av vevet ved ethvert tidspunkt i løpet av prosedyren.
- Avkjøl barberblad, skjære støtte, stabiliseringsenhet og børsten til -26 ° C ved å plassere dem i kryostat i minst 10 min. Også plassere en glideboks inne i kryostaten for å være i stand til å lagre glassplater som seksjonene er gjort.
- Riktig merke glassplater som skal brukes til å samle vevssnittene og vedlikeholde dem ved RT; ellers vevssnitt vil ikke forholde seg til dem. Fjern prøven fra formen inne i kryostaten.
Merk: Ved hjelp av positivt ladede glass vil i stor grad favoriserer heft Dypfryst vevssnitt grunnet høyere elektrostatisk tiltrekning. - Dekke overflaten av en metallskive med vev oktober forbindelse (opprettholdt ved RT) og presse det frosne prøven på den. Plasser den våte montere inne i kryostat og la det cool i minst 15 min.
- Plasser våt mount i platen innehaveren av kryostat. Juster kuttet tykkelse til 5-6 mikrometer og, om mulig, bruk en ny skarp kniv eller i det minste endre området på bladet brukes til å skjære hver prøve, siden noen vev vil raskt kjedelig det.
- Justere plasseringen av den anti-roll-enheten over barberblad ved å gjøre kutt av monteringsmedium inntil skivene dannes jevnt og riktig. Ideelt sett vil stabiliseringsenhet gå over barberblad med ca 1 mm.
- Når innstillingene er riktige, utføre vevssnitt ved å dreie rattet i en kontinuerlig jevn bevegelse. Med mindre temperaturen er ideell, en vev delen vil, av natur, kan du prøve å krølle seg.
- Bruk en pensel til å ta tak og manøvrere avsnittet over scenen for å plassere det som ønskelig på glasset lysbilde. Bruk pensel til å rydde opp restene muligens til stede på den frosne vevsblokk og / eller barberblad.
- Dravevet delen mot brukeren, og unngå å trykke den på kryostat scenen. Unngå å presse vevet delen på kryostaten stadium da det kan føre til adhesjon av vev skive på scenen, og derfor manglende evne til å gjenopprette den med glass-slide.
- Hente vevssnitt en etter en ved å løfte dem opp på overflaten av en glassplate, ved å holde den over delen og vinkle den ned til berøring vevet delen.
Merk: Vevssnitt raskt følge den varme glass på grunn av statisk attraksjon. Hvis flere vevssnitt er plassert på samme lysbilde, være forsiktig med å overlappe dem og plass dem nok til å være i stand til å individuelt legge dem i en hydrofob sirkel (se kapittel 3.1.1.).
3. Indirekte Immunofluorescence
- Finne deler
- Bruk en hydrofob barriere penn til å tegne en hydrofob sirkel rundt slide-montert vev. La sirkelen tørke i ca. 1 min ved RT. Tegn en linje rundt tutstede seksjoner med en fin svart sprittusj, så vel, men på siden av glass-slide overfor en hvor vevssnittene er.
Merk: Denne sirkelen er vannavstøtende og aceton og alkohol-uløselig. Det gir derfor en barriere mot vandige oppløsninger som brukes under IHC prosedyren og reduserer volumet av nødvendige reagenser. - Rehydrere vevssnitt ved å dekke dem med en dråpe ~ 250 ul PBS i noen få minutter ved RT. Fix vevssnitt ved å dekke dem med ~ 250 ul av en ferskt fremstilt 3% PFA-løsning i PBS i 10 til 15 min.
Merk: Eventuelt kan i dette tilfellet bruker et aldehyd bråkjøling oppløsning (50 mM ammoniumklorid (NH4Cl, Mr 53,5 g / mol) i PBS eller 0,1 M glycin (C 2 H 5 NO2, Mr 75,07 g / mol) i PBS ) for å stanse reaksjonen fiksering. Enkel og rikelig PBS vaske er som regel tilstrekkelig for å fjerne uomsatt aldehyd.
- Bruk en hydrofob barriere penn til å tegne en hydrofob sirkel rundt slide-montert vev. La sirkelen tørke i ca. 1 min ved RT. Tegn en linje rundt tutstede seksjoner med en fin svart sprittusj, så vel, men på siden av glass-slide overfor en hvor vevssnittene er.
- Antigen gjenfinning (valgfritt)
- Plasser AR-oppløsning (100 mM Tris (C 4 H 11 NO 3, Mr 121,14) 5% urea (NH2 CONH2, Mr 60,06), pH 9,6) i et begerglass. Volumet av AR oppløsning må være tilstrekkelig til fullstendig å dekke de glassplater som er plassert i et glassholderen.
- Forvarm AR løsning til 95 ° C ved å overvåke temperaturen med et termometer og deretter plassere glassplater på et passende stativ, immerge stativet i den varme buffer, for å dekke begrense fordamping og inkuberes i 10 minutter ved 95 ° C.
- Fjerner begeret fra vannbadet og la glassplater for ytterligere 10 minutter i bufferen.
- Skyll vevssnitt med PBS (~ 250 mL / seksjon) og mette dem med en løsning3% bovint serum albumin (BSA, ~ 250 pl / seksjon) i PBS i minst 30 minutter ved romtemperatur.
- Sett 30-50 ul av det primære antistoff fortynnet i PBS inneholdende 2% BSA i hver seksjon vev.
Merk: Dette volum er tilstrekkelig til å danne en dråpe som fullstendig dekker vev delen. - Plasser det samme volumet av fortynningsmiddel (2% BSA i PBS) alene på en vev del for å utføre en negativ kontroll uten primært antistoff.
- Systematisk inkludere denne negative kontroll i hvert forsøk IHC og utfører for hvert sekundært antistoff som brukes til å estimere bakgrunn av eksperimentet (ikke-spesifikk merking på grunn av det sekundære antistoff, og / eller vevet auto-fluorescens). Andre typer av positive eller negative kontroller kan også bli utført for å sikre at spesifisiteten til merking (se diskusjon).
- Plasser glassplater i en fuktet boks O / N ved 4 ° C.
Merk: Primære antistoffer som ble brukt var musemonoklonalt anti-cytokeratin8 (CK8, 1:50 fortynning), mus monoklonalt anti-cytokeratin 14 (CK14, 1:50 fortynning), kaninpolyklonalt anti-mus kasein (# 7781, 1:50 fortynning, sjenerøst gitt av MC Neville, University of Colorado Health Sciences Center, CO, USA), kaninpolyklonalt anti-BTN1 (1: 300 fortynning, sjenerøst gitt av IH Mather, Institutt for husdyr- og Avian Sciences, University of Maryland, MD, USA), kaninpolyklonalt anti-Stx6 ( 01:50 fortynning, sjenerøst gitt av S. Tooze, Cancer Research UK, London Research Institute, London, UK) og kaninpolyklonalt anti-VAMP4 (1:50 fortynning). - Vask vevssnitt med PBS minst fire ganger i 10 minutter ved RT.
- Fortynn passende sekundært antistoff (rhodamin-konjugert geit-anti-kanin IgG (H + L), 1: 300 fortynning) i PBS inneholdende 2% BSA, plasserer 30-50 ul av denne løsning på alle vevssnitt, og inkuberes i 1,5 timer ved RT.
- Siden fluorokromer er lyssensitive molekyler, ikkeUtsett vevssnitt for lys inntil deres analyse. For IIF på vevssnitt, favorisere sekundære antistoffer koblet til en rød fluorofor siden celle-membraner har en tendens til å generere en grønn auto-fluorescens som kan interferere med lav merking. Videre velger en rød fluorofor-koblet sekundært antistoff tillater samtidig merking av nøytrale lipider (se nedenfor).
- Vask vevssnittene med PBS minst fire ganger i 10 minutter ved RT.
- For noen eksperimenter, utføre post-fiksering ved å inkubere prøvene med 2% PFA fortynnet i PBS i 10 minutter ved romtemperatur for å stabilisere antigen / antistoff-stillas. Imidlertid kan dette trinn utelates i de fleste tilfeller.
- For å visualisere CLDs og MFGs, farge nøytrale lipider ved inkubering av vevssnittene i 30-50 pl av en PBS-oppløsning inneholdende 3 mikrogram / ml BODIPY 493/ 503 i 10 minutter ved RT. Hurtig skylle vevssnitt to ganger med PBS.
- Counterstain kjerne-DNA med 30 til 50 pl av en PBS-oppløsning inneholdende 3 mM av DAPI (4-6-diamidino-2-fenylindol, 5 mg / ml stamløsning) i 10 minutter ved RT. Vask vevssnittene to ganger med PBS før montering lysbildene for observasjon.
- Fjern PBS og plassere en dråpe monteringsmedium på hver vev delen.
- Plasser den ene siden av dekkglass i en vinkel mot raset, ta kontakt med den ytre kanten av væsken slipp og senk dekselet sakte, unngå luftbobler. La væsken spredt mellom glass-slide og dekkglass i noen minutter, og deretter fjerne overflødig montering medium med et papirhåndkle.
- Tett dekkglass til glass-slide med neglelakk og butikken vevssnitt ved 4 ° C for å hindre at de utsettes for lys til observasjon.
4. Fluorescens Observasjon og Image Acquisition
Merk: En fluorescens mikroskop utstyrt med et kamera styrt av bildet oppkjøpet programvare er nødvendig for å observere IHC resultater.
- Før skaffe bilder, kontrollere intensiteten av merkingen og evaluere bakgrunn av forsøket ved å se på de negative kontrollene. Tilegne seg bilder av hver fluorescensmarkør (fargekanal) individuelt.
- Erverve alle bilder, inkludert de av de tilsvarende kontroller, i de samme forhold (eksponering og generelle innstillinger) for hver fargekanal.
- Konvensjonell mikros
- Utfør epifluorescence mikroskopi med et mikroskop utstyrt med standard filtre for fluoresceinisotiocyanat (FITC, grønn), rhodamin (rød) og DAPI (blå) utslipp, × 20 × 63 (olje-nedsenking, NA 1.3) mål og en DP50 økende kamera.
- Konfokalmikroskopi
- Utfør konfokalmikroskopi med microsCope utstyrt med ZEN programvare, ved hjelp × 20 × 63 (olje-nedsenking, NA 1.4) mål og 488 og 568 nm-eksitasjonsbølgelengdene av laseren.
5. Bilde Treatment
Merk: Alle bildeetterbehandling er utført ved hjelp av ImageJ fri programvare (http://imagej.nih.gov/ij/).
- Legg over bilde (fusjonere)
- Åpne bildene ervervet i hver kanal som skal kombineres (File / Open). Hvis du arbeider med 8-bits gråtonebilder, tilskriver kunstig farge til hver kanal ved hjelp av søketabellen (Bilde / Oppslag Tables).
- Generere sammensatte bildet fra gråtoner eller fargede bilder ved hjelp av kommandoen "Slå sammen kanaler" (Bilde / Farge / Merge kanaler) og deretter tildele en farge til hver kanal.
- Utfør image stabler superimposition på samme måte ved å åpne stabler ervervet i hver kanal som skal kombineres (File / Open) og ved hjelp av kommandoen "Slå sammen kanaler &# 8221; (Bilde / Farge / Merge kanaler) å tillegge en farge til hver kanal. Lagre kompositt stabelen som en bildesekvens eller som en film (se punkt 5.4).
- Bildestakk Z projeksjon
- Bruk Z projeksjon funksjon (Bilde / Stable / Zproject, Max Intensity) for å gi en todimensjonal visning av alle bildene av en bildestakk ved å projisere dem langs aksen vinkelrett på bildeplanet (z-aksen). Den "Maximum Intensity" alternativet skaper et bilde der hver piksel inneholder maksimumsverdien over alle bildene i bunken. Dette genererer et enkelt bilde som tillater visualisering av alle flekker observeres gjennom hele bildestakk for en bestemt kanal eller etter overlagring av flere kanaler.
- Bildestakk 3D projeksjon
- Bruk 3D-projeksjon kommando (Bilde / Stable / 3D prosjekt, Brightest Point, y-aksen) for å generere en sekvens av projeksjoner av en roterende volum på et plan. Den visuelle gjengivelsen av surfaces og interne strukturer avhenger både av projeksjonsmetoden (nærmeste punkt, lyseste punkt (benyttet her), eller betyr-verdi) og visualiserings parametrene valgt. Hver ramme av den animerte sekvensen er resultatet av som rager ut fra en annen synsvinkel.
- Rotere 3D effekten rundt hver av de tre ortogonale akser (y-aksen ble valgt her). Lagre sekvensen produsert som et enkelt bilde eller en film.
- Bildestakk til film konvertering
- Åpne en bildestakk (File / Open), og lagre det som en film i AVI-format ved hjelp av kommandoen "AVI" (Fil / Lagre som / AVI).
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Melkekjertlene er en subkutan kjertel som ligger langs ventral strukturen i både brystkassen og magen hos gnagere. Plasseringen av de fem par kjertler fra mus under drektighetsperioden, er vist i figur 4. Morfologien av brystkjertelen endres dramatisk i løpet av sin utvikling, noe som reflekterer funksjonelle modifikasjoner som kreves for å forberede for fullstendig laktasjon (figur 1B). I jomfruelige eller førstegangsfødende dyr, består i melkekjertelen av et sparsomt forgrenet ductal epitel innleiret i en tynn fett stroma som kan være vanskelig å se. Fra starten av svangerskapet, de melkekjertelepitelet proliferates og utvides, noe som resulterer i større melkekjertler som blir lettere å se og ta (figur 4). Ved amming er brystvev tykkere og ser hvitere på grunn av tilstedeværelsen av melk. Bare mage og inguinal melkekjertler er samlet fordi livmorhals og thorax bryst Glands er mindre enkelt fjernes på grunn av sin nære tilknytning til muskler. For noen eksperimenter, kan valpene skilles fra ammende kvinner 4-6 timer før offer for å begrense melk sekresjon av MESCs 46,47.
Identifikasjon av melkekorg og epitelceller
Korg kontraktile celler som omgir alveolene kan skilles fra luminal MESCs ved bruk av antistoffer rettet mot markører som blir uttrykt spesifikt ved hver av disse celletyper. I melkekjertlene, dagens markører som brukes er cytokeratins (CKs). CKs er en stor familie av cytoplasmatiske proteiner som polymeriserer for å danne cytoskeletal intermediære filamenter (10 nanometer i diameter i gjennomsnitt) funnet i epitelvev. De mellomliggende filamenter er ekstremt stabile og gir en mekanisk støtte for cellearkitektur, og organisere vev ved å bidra til celle-celle adhesjon og basalcelle-bindevev interaksjoner. De undergrupper av CKs uttrykt av epitelceller i hovedsak avhengig av type epitel, dens utviklingstrinn og dens differensiering status. Videre gjelder dette også de ondartede kolleger av epitel. Således er disse markørene er enkle og verdifulle verktøy for å karakterisere cellepopulasjoner i et vev under fysiologiske betingelser, og brukes til tumor diagnostikk og karakterisering i kirurgisk patologi 48.
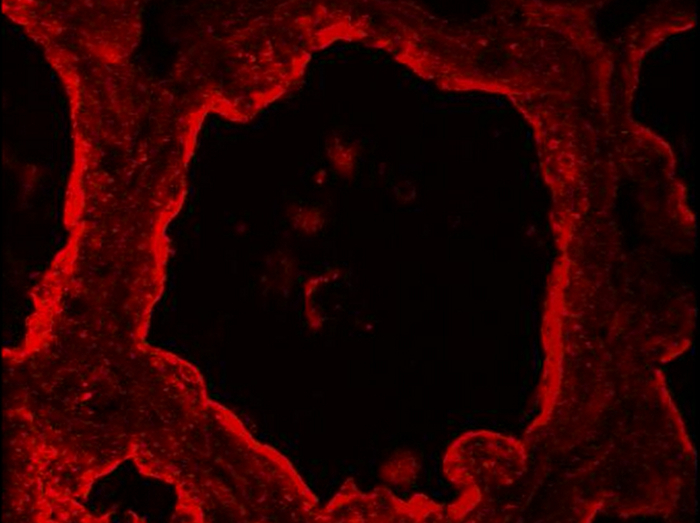
I den normale melkekjertlene, kan korg og luminale MESCs celler skilles fra hverandre basert på deres differensial ekspresjon av CK14 og CK8, henholdsvis (figur 5). Disse cytoplasmatiske markørene er påvist i melke deler av ammende mus etter PFA fiksering og AR. Bilder ble kjøpt med en konvensjonell epifluorescence mikroskop. Synes CK8 å bli distribuert gjennom cytoplasma av luminale MESCs (Figur 5, CK8). Legg merke til at den røde bakgrunnen observered for den negative kontrollen uten primære antistoff (Figur 5, -Ig1) er mest på grunn av vev delen folding, som foreslått av den blå DNA merking, som viser flere lag kjerner (Figur 5, -Ig1, kjerner). CK14 er spesielt observert i flate og langstrakte korg celler lokalisert i bunnen av alveolene (figur 5, CK14). En annen vanlig måte å identifisere celler korg er å påvise alfa-glattmuskel aktin (a - SMA) som er tilstede i disse kontraktile celler (se figur 4 i 49).
Påvisning av mus melkeprodukter
Etter fødsel, fullt differensierte MESCs begynne å produsere rikelig mengder melk. Melk komponenter er utskilt av forskjellige veier 40,50. Kasein miceller utskilles ved eksocytose av Golgi-avledet SVs, mens lipider er utgitt som MFGs av spirende av den apikale plasma membran av MESCs (figur 2, mammary epithelial sekretorisk celle). For noen eksperimenter, blir valpene atskilt fra den kvinnelige 4-6 timer før samle melkekjertlene, for å bremse ned melk sekresjon 46,47. Under slike forhold kan den apikale plasmamembranen av MESCs og innholdet i lumen lett observeres, noe som ikke er tilfelle ved suging siden alveoler trekkes sammen og lumen er lukket. Videre sakker utskillelsen er også viktig når man studerer proteiner involvert i membran trafficking som snarer. Faktisk, snarer syklus mellom donor og akseptor avdelinger og deres subcellulære lokalisering er vanskelig å fastslå, siden merking er ofte diffust når membranen omsetningen er høy, altså., Under suging. Derfor sakker melk sekresjon ved å fjerne valpene gir riktige forhold for å studere intracellulær lokalisering av snarer når t- og v-snarer fortrinnsvis ligge i donorog akseptor kammer henholdsvis (se nedenfor).
Figur 6 viser lokalisering av kasein i et melkemusebrystkjertelen på dag 10 av amming, i nærvær (figur 6, + p) eller uten (figur 6, -p) av avkom. Vevssnitt ble observert både ved konvensjonell epifluorescens mikroskopi (de tre kolonner til høyre) og konfokal mikroskopi (figur 6, venstre spalte). Under diebarn kaseiner synes å være stort sett samlet i apikale regionen (figur 6 + p, pilspisser). Konfokal mikroskopi avslører at kaseiner er også til stede, om enn i mindre grad, på basal side av MESCs i nærvær av unger (figur 6, + p, piler), som ikke klart kan observeres i konvensjonelle mikroskopi (figur 6, kaseiner, sammenligne venstre og høyre panel). Faktisk, i vidvinkel epifluorescens, fluorescensen avgitt av prøven (bakgrunns fluorescence) passerer gjennom den eksiterte volum og forandrer oppløsning av objektene som observeres i målfunksjonen fokalplanet (ut-av-fokus fluorescens). Dette gjelder spesielt for tykke prøver (tykkere enn 2 um). Konfokalmikroskopi gjør det mulig å oppnå bilder med høy kvalitet fra prøver preparert for epifluorescens, som dybden av feltet kan kontrolleres og bakgrunnsfluorescens ekskludert fra fokalplanet. Videre, i nærvær av unger (figur 6, + p), hulrommet i alveolene er helt lukket, og den apikale siden av MESCs er bedre observert i fravær av unger (figur 6, -p), når lumen alveoli er utvidet på grunn av opphopning av melkeprodukter. Når melk sekresjon er bremset ned, kaseiner også vises akkumulert under apikale plasma membran (Figur 6, -p, pilspisser), og er tydelig observert ved basal siden av MESCs (Figur 6, -p, piler). Negative kontroller uten primær Antibody viste ingen merking (Figur 6, -Ig1).
Melkeprodukter kan lett co-oppdages ved å kombinere IHC for kaseiner og nøytralt lipid kontra av CLDs og MFGs (figur 7). Vevssnitt ble avbildet som Z-stabler av konfokalmikroskopi, som var etterbehandlet med ImageJ å produsere Z anslag eller 3D anslag for hver (Figur 7, kasein, lipider) eller alle fargekanalene (Figur 7, slå sammen). De bildesekvenser som produseres har blitt lagret som enkeltbilder (figur 7 og 8) eller filmer (se Utfyllende filmer).
Selv om noen merking ble observert på sin side basal, ble kaseiner hovedsakelig akkumuleres på den apikale side av MESCs (figur 7, + p), som allerede beskrevet når kvinner ikke tidligere er skilt fra unger (figur 6, + p). CLDs er også lokalisert hovedsakelig i den apikale regionen MESCs, mens større hemmeligheted MFGs er til stede i hulrommet i alveolene. Legg merke til at kaseiner og MFGs blir lett visualisert i lumen av alveolene i fravær av unger (figur 7, sammenlign + p og -p). Kaseiner ikke co-lokalisere med CLDs eller MFGs i noen av disse forholdene siden superimposition av de to fargekanaler ikke produserer gul merking (Figur 7, fusjonere bilder). Men bildestakk etterbehandling viser at kaseiner omgir utskilt MFGs i lumen av alveolene, noe som tyder på at disse proteinene kan samhandle med MFG (Figur 7, fusjonere bilder). Legg merke til forskjellen på bilder produsert av hver etterbehandling brukes (Figur 7, sammenligne Zproj og 3D proj for hver fargekanal).
Påvisning av butyrophilin, et protein markør for MFGs.
BTN1 er en av de store proteiner forbundet med MFGs i melk 51. Denne trans protein er mainly lokalisert på den apikale plasmamembranen av MESCs og som følgelig finnes på overflaten av MFG etter utgivelsen av spirende 52. Figur 8 viser at på dag 10 av amming, er BTN1 hovedsakelig lokalisert på den apikale plasmamembranen og, i i mindre grad, i det apikale området av MESCs. BTN1 omgir også MFGs stede i lumen av alveolene samt noen av de apikale CLDs (Figur 8, 3D proj fusjonere, pilspisser). Resultatene er vist som et enkelt bilde hentet fra det oppkjøpte bilde Z-stack (Figur 8, bilde) eller som en 3D-visning generert med 3D-projeksjon kommando av ImageJ, som beskrevet ovenfor (Figur 8, 3D proj). Legg merke til at et enkelt bilde kan være tilstrekkelig til å observere den apikale fordeling av protein, men den romlige foreningen av BTN1 med utskilte MFGs eller apikale CLDs kun observert etter 3D rekonstruksjon av Z-stabelen (Figur 8 sammenligner BTN1 bilde og 3D-proj flettingen pictures). Z-stack kan også bli rekonstruert som en film for å gi en bedre romlig syn på fordeling av protein. Bildet Z-stack anskaffet for BTN1 alene (Utfyllende filmer 1 og 3) eller overlagret med de to andre fargekanalene (fusjonere, Utfyllende filmer 2 og 4) er vist som eksempler. Z-stack kan leses bilde-for-bilde fra toppen til bunnen (Utfyllende filmer 1 og 2) eller som en roterende visning (y-aksen) av 3D projeksjon av hele bildestakk (Utfyllende filmer 3 og 4 ).
Påvisning av to snare proteiner: Stx6 og VAMP4
Som tidligere nevnt, snarer er membranbundne proteiner som syklus mellom donor og akseptor membraner. Det er derfor bedre å bremse ned membran omsetning knyttet til høy sekretoriske aktivitet av MESCs ved å skille kvinner fra valpene før samle melkekjertlene når man studererdisse proteinene. Stx6 og VAMP4 har både blitt beskrevet som å bli assosiert med den trans-Golgi nettverk 53,54. Imidlertid kan disse Snare proteinene spiller også en viktig rolle ved nivået for andre cellulære avdelinger slik som de sekretoriske granuler (Stx6) 55,56 og Golgi-apparatet (VAMP4) 57. Tidligere studier tyder på at snare proteiner spiller en rolle i kasein sekresjon 35,36. Under amming, Stx6 og VAMP4 er plassert i under apikale regionen MESCs. Stx6 observeres mellom kjernen og den apikale membran av mecs, svarende til Golgi og trans-Golgi-nettet (figur 9, Stx6), og er også tilstede, men i mindre grad, på kaseinholdig SVs 36. VAMP4 er lokalisert også i sub-apikal region av MESCs, men merkingen synes å være mer punktformet og er akkumulert under den apikale plasmamembranen (figur 9, VAMP4) på grunn av sin tilknytning til både CLDs og kasein-containing SVs 36. Negativ kontroll uten primære antistoff ga ikke grunnlag for noen merking.

Figur 1. Mouse melkekjertlene utvikling under embryonal og voksne liv. (A) Musemelkekjertlene begynner å utvikle rundt embryonale dag 10 (E10) fra ectodermal (lys blå) melke linjer (rosa). Ved E11.5, placodes danne symmetrisk langs brystmelkeledningen og den omgivende mesenchyme (mørk blå) begynner å kondensere. De placodes invaginate å danne knopper (E12.5-E14.5), og på E15.5, melke epitel (rosa), sprer og forlenge å danne primære spire som presser gjennom melke mesenchyme mot fettpute (lys grønn ). En hul lumen former og kan åpnes for å gi opphav til nippelen (purpur). På E18.5, danner melkekjertelepitelet en rudimentary forgrenet struktur som er koblet til utsiden. Tilpasset fra 6 gitt med tillatelse fra Macmillan Publishers Ltd: Nature Genetics, copyright 2007. (B) Under puberteten, den melkekjertelepitelet (lilla) går inn i en betydelig vekstfase (omfattende forlengelse, delinger og sidegreiner). I begynnelsen av svangerskapet, omfattende og hurtig spredning, så vel som side forgrening forekomme, som fører til en betydelig utvidelse av brystepitel, som fullt ut invaderer hele melkefettputen. Den melkekjertelepitelet når et sterkt differensiert funksjonell tilstand under amming når luminale MESCs utskiller store mengder melk. Når amming opphører etter avvenning, melkekjertlene involutes. MESCs fjernes ved apoptose og fagocytose, som fører til forsvinningen av lobulo-alveolære strukturer som er erstattet av fettvev. Tilpasset fra ordningen en av http://brisken-lab.epfl.ch/research og kapittel 2.2. http://tvmouse.ucdavis.edu/bcancercd/22/index.html. Klikk her for å se en større versjon av dette tallet.
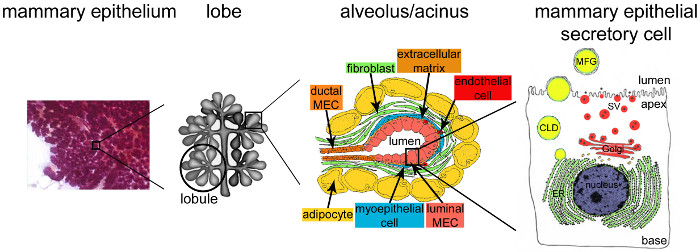
Figur 2. Arkitektur av melkekjertlene under amming. Under amming, fullt utviklet og sterkt forgrenet epitel (lilla) står for det store flertallet av brystvev. Epitelvevet er dannet av Tubulointerstitiell alveolære strukturer innebygd i en stroma som inneholder forskjellige celletyper (fibroblaster, adipocytter, glatte muskelceller, blod og lymfekar og nerveender). MESCs er organisert i acinar strukturer eller alveolene, samlet i lobules som danner fliker. Hver tannhulen er en funksjonell melkeproduserende enhet som er koblet til en sterkt forgrenet nettverk av lobular og interlobular kanaler, slik at melken som skal dregnet på utsiden. Hver alveolus er avgrenset av et monolag av polariserte MESCs, grenser den apikale siden av som en sentral lumen. Basal side av MESCs er i nær kontakt med en ekstracellulær matrix og kontraktile korgcellene. Melkeprodukter er utgitt på den apikale siden av MESCs. Major melk (kasein) skilles ut som kasein miceller (svarte poeng) ved eksocytose av Golgi-avledet sekretoriske vesikler (SVS), mens lipider er utgitt som melk fettkulene (MFGs) av spirende av den apikale plasma membran av MESCs. CLD: cytoplasmic lipid dråpe; ER: endoplasmatiske retikulum; MEC: melke epitelcelle. Tilpasset fra kapittel 2.2. http://tvmouse.ucdavis.edu/bcancercd/22/index.html., fig. 02 www.cellbiol.net/ste/alpHERCEPTIN1.php, Fig. 26-02 i 58, og fra 50. Klikk her for å se en større versjon av dette tallet.
.within-side = "always"> 

Figur 3. Eksperimentell prosedyre for å utføre indirekte immunfluorescens på frosne deler av mus melkekjertlene. Melkekjertlene er hentet fra en CD1 hunnmus på dag 10 av amming. Den brystvev er kuttet opp i små fragmenter som er løst med paraformaldehyde og infused i sukrose før de blir integrert i oktober sammensatte og hurtigfrosset. Melkekjertlene Prøvene blir deretter skåret i tynne frosne seksjoner og behandlet for IIF ved suksessiv inkubasjon med primære og fluorokromkonjugerte konjugert sekundære antistoffer, henholdsvis. Etter montering, er prøvene analysert med en fluorescens mikroskop, slik at anskaffelse av bilder som senere kan være etterbehandlet./53179/53179fig3large.jpg "Target =" _ blank "> Klikk her for å se en større versjon av dette tallet.

. Figur 4. Anatomisk plassering av musemelkekjertlene Venstre: ventral visning av musen melkesystemet på slutten av svangerskapet scenen. Høyre: lokalisering og aspekt av melkekjertlene på slutten av svangerskapet scenen i musen. Legg merke til at i løpet av amming, brystkjertlene er tykkere og vises hvitere på grunn av tilstedeværelsen av melk i alveolene. Tilpasset fra http://ctrgenpath.net/static/atlas/mousehistology/Windows/femaleu/mousemammgldiagram.html og http://www.pathbase.net/Necropsy_of_the_Mouse/index.php?file=Chapter_3.html. Vennligst klikk her for å se en større versjon av dette tallet.
-together.within-side = "always"> 
Figur 5. Identifisering av luminale epitel-celler og basal korg celler i mus melkekjertler. Luminal MESCs og korg celler er identifisert ved IIF i musebrystkjertelen på dag 10 av amming, basert på deres ekspresjon av CK-8 og CK-14 hhv. Nuclear DNA ble farget med DAPI (blå). Bilder ble kjøpt med en konvensjonell epifluorescence mikroskop. Det sammensatte bildet (fusjonere) viser overlagring av merkingen som svarer til kaseiner (rød) og kjerner (blå), henholdsvis. -Ig1, Negativ kontroll uten primære antistoff. Stjernene viser lumen. Scale bar = 100 mikrometer. Klikk her for å se en større versjon av dette tallet.
e 6 "src =" / filer / ftp_upload / 53179 / 53179fig6.jpg "/>
Figur 6. Cellulær lokalisering av kaseiner i musemelkekjertler. Kaseiner blir oppdaget av IIF i musen melkekjertlene på dag 10 av amming. Den melkekjertler ble oppsamlet fra hunner i nærvær (+ p), eller i fravær (-p) av avkom. Bilder ble kjøpt med en konvensjonell (høyre panel, kasein, kjerner og flette) eller en konfokal (kasein (rød), venstre panel) fluorescens mikroskop. I begge forholdene, er kaseiner (rød) påvist i apikale regionen (pilspisser) og mer eller mindre på basal av MESCs (piler). Negative kontroller uten primære antistoffer viser ikke noen merking (-Ig1). Nuclear DNA er farget med DAPI (blå). Det sammensatte bildet (fusjonere) viser overlagring av merkingen som svarer til kaseiner (rød) og kjerner (blå), henholdsvis. Stjernene viser lumen. Scale bar = 100 mikrometer for epifluorescens bilder (høyre panel, kaseiner, kjerner, flette) og = 10 &# 181; m. For konfokale bilder (venstre kolonne) Klikk her for å se en større versjon av dette tallet.
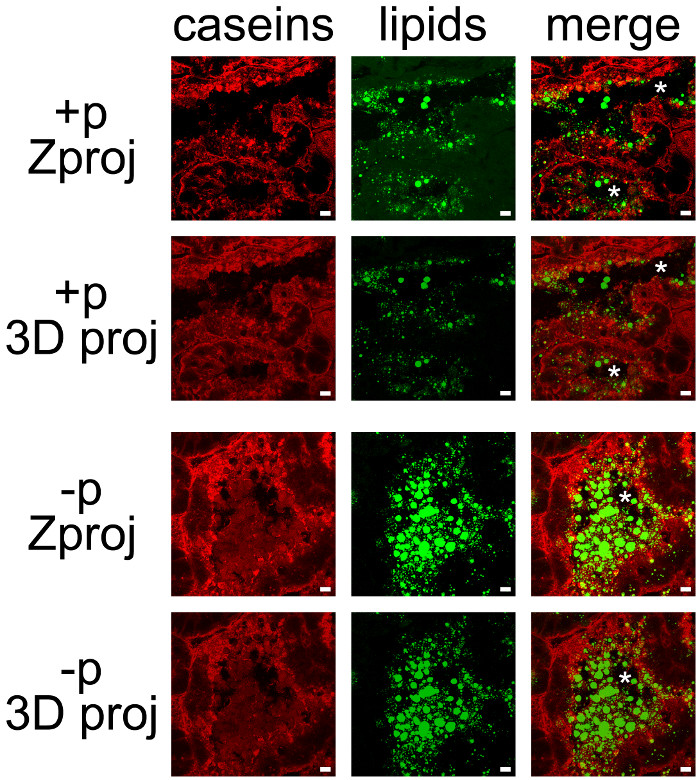
Figur 7. Cellulær lokalisering av melkeprodukter i musebrystkjertel. Kaseiner (røde) blir detektert ved IIF i musebrystkjertelen på dag 10 av laktasjonen i nærvær (+ p), eller i fravær (-p) av avkom. Nøytrale lipider (CLDs og MFGs) er motfarget med BODIPY 493/503 (grønn). De sammensatte bilder (flette) viser superimposition av de to labelings. Bilder ble ervervet som Z-stabler med konfokal mikroskop. Z-stabler ble etterbehandlet med ImageJ å generere Z anslag (Zproj) eller 3D-projeksjoner (y-aksen) (3D Proj) av hele stabler i hver kanal for begge (fusjonere). Stjernene viser lumen. Scale bar= 10 mikrometer. Klikk her for å se en større versjon av dette tallet.

Figur 8. Cellulær lokalisering av butyrophilin og lipider i musebrystkjertel. BTN1 (rød) detekteres ved IIF i musebrystkjertel på dag 10 av laktasjonen i fravær av avkommet. Nøytrale lipider (CLDs og MFGs), og nukleært DNA blir motfarget med BODIPY 493/503 (grønn) og DAPI (blå), henholdsvis. Bilder ble kjøpt med en konfokalmikroskop som bilde Z-stabler. Resultatene er vist som et enkelt bilde hentet fra bildestakk (bilde, BTN1, lipider, kjerner og flette) eller etter etterbehandling med ImageJ å generere et 3D-visning (y-aksen) av hele bildestakk (3D proj, BTN1 , lipider, kjerner, fusjonere). De sammensatte bilder (flette) visersuperimposition av de tre fargekanalene. -Ig1, Negativ kontroll uten primære antistoff. Stjernene viser lumen. Scale bar = 10 mikrometer. Klikk her for å se en større versjon av dette tallet.

Figur 9. Cellular lokalisering av to snare proteiner i musen melkekjertlene. Syntaxin 6 (Stx6) og VAMP4 (V4) blir oppdaget av IIF i musen melkekjertlene på dag 10 av amming. Bilder ble kjøpt med en konvensjonell (conv) epifluorescens eller en konfokal (LSM) mikroskop. De sammensatte bilder (flette) viser overlagring av merkingen observert for hver SNARE protein (rød) og for nukleært DNA motfarget med DAPI (false grønn farge), henholdsvis. -Ig1, Negativ kontroll uten primære antistoff. Asterisks indikere lumen. Scale bar = 10 mikrometer for konfokale bilder og = 100 mikrometer for epifluorescens bilder. Klikk her for å se en større versjon av dette tallet.


Tabell 1. Immunohistokjemi feilsøking.

Supplerende film 1. Lokalisering av butyrophilin i musen melkekjertler. BTN1 (rød) er oppdaget av IIF i musen melkekjertlene på dag 10 av amming. Bilder ble kjøpt med en co nfocal mikroskop som en Z-stack og etterbehandlet med ImageJ å generere en film. Z-stack leses fra toppen til bunnen. Klikk her for å se denne videoen.

Supplerende film 2. Lokalisering av butyrophilin og nøytrale lipider i musen melkekjertler. BTN1 (rød) er oppdaget av IIF i musemelkekjertlene på dag 10 av amming. Nøytrale lipider (CLDs og MFGs), og nukleært DNA blir motfarget med BODIPY 493/503 (grønn) og DAPI (blå), henholdsvis. Bilder ble kjøpt med en konfokalmikroskop som en Z-stack for hver fargekanal, og var etterbehandlet med ImageJ å generere et sammensatt Z-stack som superimposes de tre fargekanalene. Den resulterende kompositten Z-stabelen leses fra toppen til bunnen.https://www.jove.com/files/ftp_upload/53179/supvid2.mp4 "target =" _ blank "> Klikk her for å se denne videoen.
Supplerende film 3. Lokalisering av butyrophilin i musen melkekjertler. BTN1 (rød) er oppdaget av IIF i musen melkekjertlene på dag 10 av amming. Bilder ble kjøpt med en konfokalmikroskop som en Z-stack og etterbehandlet med ImageJ (3D projeksjon) for å generere en roterende (y-aksen) romlig utsikt over BTN1 merking. Klikk her for å se denne videoen.

Supplerende film 4. Lokalisering av butyrophilin og nøytrale lipider i musen mammary kjertelen. BTN1 (rød) er oppdaget av IIF i musen melkekjertlene på dag 10 av amming. Nøytrale lipider (CLDs og MFGs), og nukleært DNA blir motfarget med BODIPY 493/503 (grønn) og DAPI (blå), henholdsvis. Bilder ble kjøpt med en konfokalmikroskop som en Z-stack for hver fargekanal, og var etterbehandlet med ImageJ å generere et sammensatt Z-stack som superimposes de tre fargekanalene. ImageJ (3D projeksjon) ble videre brukt til å generere en roterende (y-aksen) romlig visning av kompositt Z-stack. Klikk her for å se denne videoen.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
IHC er en forholdsvis enkel og grei eksperimentelle metoden for å lokalisere antigenet i vevssnitt, som avhenger primært av spesifikke epitop-antistoff-interaksjoner. Selv om et stort antall protokoller brukes for å lokalisere et protein ved IIF, er kjernen i disse prosedyrene nesten alltid den samme. Det er imidlertid noen kritiske aspekter som sterkt kan påvirke resultatet, og må derfor være optimalisert for hvert enkelt IHC studium. Den mest utfordrende aspekt ved denne tilnærmingen er å bestemme de beste eksperimentelle betingelser, det vil si., De som genererer et sterkt og spesifikt signal for antigenet av interesse. De variabler som må tas i betraktning for eksperimentell design og optimalisering er: (1) den type antigen (arter, ekspresjonsnivåer, subcellulære beliggenheten); (2) epitopen type (sekvens, konformasjon, putative post-translasjonelle modifikasjoner); (3) prøveopparbeidelse (embedding i parafin eller for frosne snitt); (4) fiksering method (perfusjon eller nedsenking); (5) den brukte fikser (formaldehyd, alkohol eller aceton); (6) den blokkerende reagens som brukes (normalt serum, BSA eller ikke-fettmelk); (7) AR trinn; (8) påvisningsmetoden (direkte eller indirekte); (8) den type primære antistoff (monoklonalt eller polyklonalt); (9) den sekundære antistoff (arter og etikett); (10) counterstains (nukleær og / eller andre cellerommet merking); og (11) monteringsmedium (se tabell 1 for detaljer). Fiksering og blokkeringstrinn, i det minste kreve optimalisering av flere faktorer slik som konsentrasjon, pH, temperatur, inkubasjonstid og fortynningsmiddel.
Den første viktig aspekt angår fremstilling av vevsprøver, som er nært knyttet til fikseringsmetoden, som i sin tur påvirker kvaliteten av resultatene. For eksempel kan vev stykkene være fast eller ikke før innebygging. Dette trinnet kan også avhenge av innleiringen metoden som velges, dvs. oktober forbindelse vs. parafin innstøping, Som i seg selv noen ganger avhenger av det primære antistoff benyttes. Tissue festing kan bli utført in vivo ved å perfusert en bedøvet dyr med et fikseringsmiddel-løsning. Denne metoden er nyttig å bevare antigener når studere intakt vev, men kan ikke være tilstrekkelig til å løse vevet av interesse. I dette tilfelle kan små vev stykker (ikke tykkere enn 10 mm) blir neddykket i fiksativ løsningen. Frosne vev kan fremstilles ved nedsenking av vevet i flytende nitrogen eller isopentan, og snap-frysing er sterkt anbefalt for den etterfølgende påvisning av post-translasjonelle modifikasjoner så som fosforylering. Men i motsetning til parafin-innleiret vev, er frysepunktet ikke er tilstrekkelig for langtidsoppbevaring av vev på grunn av dannelsen av iskrystaller inne i cellene som kan endre subcellulære morfologi. Når kuttet kan frosne vevssnitt bli lagret ved -80 ° C i opp til ett år. I alle fall, er fremstilling av vevsprøver et kompromiss mellom å bevare vevet/ cellulær arkitektur og bevare epitope integritet.
Siden det endrer den kjemiske sammensetningen av vev, er det avgjørende å optimalisere festebetingelser for å unngå både ufullstendig (under fi xation) og overdreven (overfixation) fi xation.
Faktisk kan underfixation redusere det spesifikke signal ved å fremme den proteolytiske nedbrytning av visse antigener. På den annen side kan overfixation endre spesifikk merking ved maskering av epitopen eller genererer et sterkt ikke-spesifikk bakgrunn. Derfor, i tillegg til valg av bindemiddel-løsning, andre parametere så som inkubasjonstid, temperatur og pH-verdien vil påvirke vev fiksering. Selv PFA er det mest vanlige bindemiddel brukes til IHC, kan den ikke anses som en "universal" fikseringsmiddel. PFA induserer protein-protein og protein-nukleinsyre kryssbindinger og kan dermed artefactually endre epitope (overfixation) og deretter hindre recognition av det primære antistoff. Imidlertid kan epitopen bli ytterligere avslørt av AR-teknikker (se nedenfor). PFA kan også være uegnet for påvisning av visse antigener, som det har vist seg å indusere translokasjon av enkelte fosforylerte proteiner fra membranen til cytoplasma. I slike tilfeller må PFA erstattes av egnede alternative fiksativ som alkohol. I motsetning til PFA, gjør alkoholer som metanol eller etanol ikke maskere epitoper siden de tillater vev fiksering ved å erstatte vannmolekyler i vev. Dette kan føre til utfelling av proteinene, og deretter hindre antistoff / epitop interaksjonen skyldes konformasjonsendringer. Det er allment antatt at alkoholene ikke trenge gjennom og dermed ikke bevare morfologien vev, så vel som PFA. Aceton er et annet alternativ fiksativ, som vanligvis brukes når du arbeider med ufestede, snap-frosne vevssnitt. Imidlertid er aceton et sterkt dehydratiserende middel, og kan føre til irreversibel utfelling av vevsproteiner.
For noen antigener, kan et ytterligere trinn av AR være nødvendig for å oppnå et godt signal, hovedsakelig Hvis fiksativ induserer konformasjonsendring eller endrer den elektrostatiske ladning av epitopen (maskering av epitopen). AR fremgangsmåter tar sikte på å reversere disse prosesser for å gjenopprette immunoreaktiviteten av epitopen og dens etterfølgende interaksjon med det primære antistoff. AR fremgangsmåter hovedsakelig er avhengige av to fremgangsmåter: (1) protease-induserte epitop henting, dvs. med enzymer så som proteinase K, trypsin eller pepsin, som spalter peptider som maskere epitop; og (2) varmeindusert epitope henting, dvs. ved hjelp av en mikrobølgeovn, trykkokere, vegetabilske dampskip, autoklaver eller vannbad. Denne sistnevnte tilnærmingen er spesielt tids-, temperatur-, buffer-, og pH-sensitive, og de optimale betingelser må bestemmes empirisk (et eksempel er gitt i protokollen avsnitt). Alternativt kan affiniteten av et antistoff for antigenet økesved å endre pH eller kationet konsentrasjonen av antistoff-fortynningsmiddel.
En permeabilization trinn er noen ganger nødvendig for å oppnå et godt signal for et intracellulært epitop i tykke vevssnitt, særlig for kjerne antigen farging. Dette kan oppnås på forskjellige måter ved hjelp av: (1) alkoholer eller aceton som fiksativ; eller (2) detergenter som Triton, NP-40 (0,1 til 0,2% i PBS, 10 min), digitonin, saponin eller Tween 20 (0,2 til 0,5% for 10 til 30 minutter) etter PFA fiksering. Imidlertid er valget av vaskemiddel avhenger av den cellulære plasseringen av den detekterte epitop. Faktisk sterke vaskemidler så som Triton-X100, som solubilisere cellulære membraner, er egnet for påvisning atom epitop, men kan føre til signal forandring ved ekstraksjon av noen membran-proteiner. Bruken av mildere detergenter (saponin og Tween 20) er mer egnet for deteksjon av cytoplasmiske epitoper.
Den andre kritiske trinn er blocking av ikke-spesifikk farging. Bindingen av et antistoff til dets mål-epitop er styrt av intermolekylære krefter (f.eks hydrofobe og ioniske interaksjoner, hydrogenbinding). Således kan interaksjoner av primære og / eller sekundære antistoffer med andre proteiner enn deres målantigener resultere i en ikke-spesifikk farging. Dette genererer høy fluorescens bakgrunn, som hindrer visualisering av proteinet av interesse (lavt signal / støy-forhold). Blokkering reagenser reduserer ikke-spesifikke interaksjoner som ikke nedsetter spesifikt antistoff / epitop interaksjon. En vanlig fremgangsmåte består i å inkubere vevssnitt med varmeinaktivert normalt serum eller BSA. Ved bruk av en normal serum, må det være fra den samme art som det som i vertsdyr av det sekundære antistoff eller av en uavhengig art. I alle tilfeller må den valgte blokkerende reagens også tilsettes til de fortynningsmidler for de primære og sekundære antistoffer. Videre er bruk av ikke-ioniske detergenter som for eksempel Triton X-100, Tlom 20 eller saponin bidrar til å redusere ikke-spesifikke interaksjoner.
Den tredje og kanskje mest viktig parameter er den primære antistoff utvalg og optimalisering. Selvfølgelig er det beste valget en høy kvalitet antistoff med minimal kryssreaksjon. Som monoklonale antistoffer vanligvis oppviser høy affinitet og spesifisitet for en enkelt epitop, er de beste verktøy for å diskriminere et bestemt medlem av en familie proteiner med høy sekvensidentitet. Imidlertid kan det antistoff / epitop interaksjonen bli skadet hvis målet epitopen har mistet sin opprinnelige konformasjonell tilstand eller når tilgangen til epitopen hindres ved interaksjoner med andre proteiner, post-translasjonelle modifikasjoner, temperatur, pH, fiksering og saltkonsentrasjon. I slike tilfeller, polyklonale antistoffer er mer egnet som de gjenkjenner multiple epitoper av det samme proteinet. Dessuten er de ofte er mer stabile enn monoklonale antistoffer over et stort spekter av pH og saltkonsentrasjon.Preliminære studier har til å definere de nødvendige inkuberingsbetingelser, dvs. arbeider fortynning (monoklonalt antistoff: 5-25 mg / ml, polyklonalt antistoff: 1,7 til 15 mg / ml), inkubasjonstid, fortynningsmiddel og temperatur, noe som må bestemmes empirisk for hver primær antistoff. Disse parametrene må bli optimalisert for å bestemme de betingelser som frembringer den optimale signal med lav bakgrunnsstøy. Spesifisiteten av merking er foretrukket av lengre inkubasjonstider ved lavere temperaturer (f.eks., 4 ° C vs RT).
Valget om å utføre direkte eller indirekte gjenkjenning ofte avhenger av nivået av antigen uttrykk. For eksempel kan et sterkt uttrykt epitop bare bli detektert med et fluorokromkonjugerte konjugert primære antistoff, og dermed gir en rask og enkel flerfarget farging og samtidig unngå mulig ikke-spesifikk bakgrunn på grunn av bruken av et sekundært antistoff. Men direkte IF mai genererer et lavt signal til en høyere pris, og kan sometimes være vanskelig, når merket antistoff ikke er kommersielt tilgjengelige. Motsatt er IIF mer følsom til å påvise lavere uttrykt epitoper som det genererte signalet er mer intens på grunn av samspillet av minst to merkede sekundære antistoffer (dannet mot de primære antistoff vertsarter) med det primære antistoff (forsterkning). Videre er en lang rekke sekundære antistoffer konjugert til forskjellige fluoroforer er kommersielt tilgjengelig, relativt billig, og kvalitetssikret. Imidlertid kan denne tilnærmingen indusere kryssreaksjon og dermed krever å velge nøye primære antistoffer som ikke er produsert i samme art eller av ulike isotyper når du utfører flere merkeforsøk. IIF også noen ganger krever ekstra blokkering trinn og må inkludere systematiske negative kontrollene (se nedenfor). Amplifikasjon kan videre oppnås ved å bruke et biotin-konjugert sekundært antistoff og fluorescensmerket avidin eller streptavidin (fire biotins bundet per molecule). Ikke desto mindre krever denne amplifikasjonsmetoden ytterligere trinn for å hindre ikke-spesifikk binding, og kan ikke tilpasses for farging av noen vev (lever, nyre, hjerte, hjerne, lunge og melkegivende brystkjertel) på grunn av tilstedeværelsen av høye nivåer av endogent biotin . Imidlertid kan endogene biotin bli blokkert ved pre-inkubering av prøven med avidin og deretter med biotin før inkubering med det primære antistoff. Valget av de konjugerte fluorokromer, som er små kjemiske molekyler med egenskapen å sende ut lys når det påvirkes av lys av kortere bølgelengde, avhenger først og fremst av type mikroskop utstyr tilgjengelig.
Når den er riktig utformet for å begrense både kryss-reaktivitet mellom antistoffene og crossover mellom de spektrale egenskapene til de fluorokromer som brukes, gjør det mulig for immunofluorescens-baserte IHC den samtidig visualisering av flere cellulære mål.
Den siste kritiskepunkt vedrørende IHC eksperimenter angår de positive og negative kontroller som må utføres for å støtte gyldigheten av flekker, for å identifisere eksperimentelle gjenstander og for nøyaktig tolkning av resultatene. Noen vev utviser høy fluorescerende bakgrunn (referert til som autofluorescence) som kan føre til en feiltolkning av resultatene. Dermed vevssnitt må følges under både fluorescens og lyse-feltet belysning før du starter IHC eksperimentet. En negativ kontroll som utelater det primære antistoff systematisk må tas med i hvert forsøk IHC for å sikre at en eventuell ikke-spesifikk binding av det sekundære antistoffet er ubetydelig og ikke skjuler eller ligner den bestemte fargemønster. En isotype kontroll kan utføres ved å arbeide med et monoklonalt primært antistoff ved å erstatte den med en ikke-immun-antistoff av samme isotype (f.eks IgG1, IgG2a, IgG2b, IgM) ved samme konsentrasjon. Denne kontrollen bidrar til å estimate den ikke-spesifikk farging, som kan være på grunn av interaksjoner av antistoffer med prøven. For å demonstrere den spesifikke bindingen av et antistoff til dets antigen, kan en absorpsjon kontroll oppnås på to måter ved å pre-inkubere det primære antistoffet: (1) med sin oppløselig immunogen (10: 1 molforhold) O / N ved 4 ° C ; og (2) med celler eller vev seksjoner som uttrykker epitoper av interesse, men som skiller seg fra den undersøkte vev (for eksempel, se figur 4B i 59). I begge tilfeller bør den påfølgende uttømming av det primære antistoff føre til liten eller ingen farging. En annen type av kontroll kan gjøres ved hjelp av et irrelevant primært antistoff, f.eks., Er rettet mot en epitop som oppviser en cellulær lokalisering som er forskjellig fra epitopen av interesse (atom vs. cytoplasma). Den irrelevant antistoff må være av samme isotype, og arter som det primære antistoff av interesse. Ytterligere kontroller for IHC eksperimenter kan omfatte anvendelse av prøver fra tissues kjent for å uttrykke (transgene dyr) eller ikke (knock-out dyr) epitop av interesse. Dette kan gi en annen referanse, og bidra til å optimalisere IHC prosedyren.
En hoved begrensning av IF teknikkene er at de bare kan brukes på fast (død) og / eller permeabilized celler, både prosedyre potensielt indusere gjenstander. Andre begrensninger ved denne tilnærmingen er på grunn av bruk av et mikroskop for observasjon av prøvene. Først som optisk oppløsning på epifluorescens og konfokale mikroskoper er begrenset, sted eller samlokalisering av de oppdagede proteiner bør ikke være over-tolket. Dernest photobleaching, altså. falming av den fluorescens intensitet over tid når de utsettes for lys, er i det vesentlige på grunn av generering av reaktive oksygenarter i prøven etter fluorescenseksitasjon, som i sin tur fører til den fotokjemiske ødeleggelse av fluoroforen. Bleking kan reduseres ved: a) å holde prøvene beskyttet motlys under IF eksperiment og lagring inntil deres observasjon; b) ved hjelp av en antifade middel (reaktive oksygenforbindelser fjernere) i monteringsmedium; c) reduksjon av intensiteten og / eller varigheten av eksitasjonslyset; d) å øke konsentrasjonen av fluoroforer eller ved hjelp av en lav konsentrasjon av en fluorkrom med høyt kvante-effektivitet; og e) ved hjelp av robuste fluoroforer som er mindre utsatt for fotobleking (ie. Alexa Fluors, Seta Fluors eller DyLightFluors). For det tredje er autofluorescens ofte på grunn av tilstedeværelsen av flavin koenzymer (FAD og FMN: absorpsjon, 450 nm, emisjons, 515 nm) og reduserte pyridin nukleotider (NADH: absorpsjon, 340 nm, emisjons, 460 nm) i pattedyrceller. Videre er bruken av aldehyder, spesielt glutaraldehyd, for å feste prøvene, kan føre til høye nivåer av autofluorescens. Dette kan minimaliseres ved å vaske prøven med 0,1% natrium-hydrid i PBS før inkubering antistoff og / eller ved å velge prober og optiske filtre som maximize fluorescens-signalet i forhold til autofluorescens. For det fjerde fluorescens overlapp (også kalt blø gjennom, crossover eller crosstalk) er hovedsakelig på grunn av utslipps spektrale egenskapene til fluoroforene som de viser ofte svært bred båndbredder, annerledes, asymmetriske spektrale profiler, samt ulike rushutslippsbølgelengder og antall maxima. Fluorescens overlapping oppstår når man arbeider med flere fluoroforer (flerfarget merking) og er karakterisert ved emisjonen av en fluorofor i kanalen (filter) av en annen fluoroforen. Blør gjennom gjenstander må minimeres som de ofte komplisere tolkningen av IF resultater, særlig i tilfellet med ko-lokalisering eller kvantitative studier. Som balansering av fluoroforer utslipps bare kan forbedres noe ved IF-prosedyren, kan blø gjennom hovedsakelig bli redusert ved bildeopptak ved hjelp av et fluorescens optimaliserte filtersett og / eller fotomultiplikator detektor for å riktig separspiste de spektrale profiler av fluoroforer. I denne forbindelse er konfokal mikros godt egnet for flerfarget avbildning som gjør det mulig å differensiere fluorescens-emisjonsspektra av de enkelte fluoroforer ved å dirigere hvert signal til en bestemt deteksjonskanal. Videre tillater konfokal mikroskopi for å justere forsterkningen, fotomultiplikatoren spenning, strøm eller laser for de enkelte deteksjonskanalene for den sekvensmessige oppsamlingen (bare en fluorofor om gangen) for merking. Ideelt sett må single-label kontroller utføres for å kvantifisere blø gjennom og til slutt fjerne den beregningsmessig. En kontroll uten sekundære antistoffer (bakgrunnskontroll), kan fremstilles for å angi grensene for signalforsterkning og avviket for hver kanal for optimal bildeopptak. Den kan også brukes for post-oppkjøpet behandling til riktig bilde bakgrunn (autofluorescence).
I konklusjonen, metoden beskrevet en enkel standard protokoll for enkle realizatipå av farging på brystkjerteltumorer seksjoner. Likevel må de viktigste trinnene i en IHC eksperiment optimaliseres for hvert antigen / antistoff-par for å visualisere spesifikk farging, og for å minimere ikke-spesifikke bakgrunnssignaler. Den beskrevne fremgangsmåten omfatter også flere grunnleggende fremgangsmåter for etterbehandling av de fleste av bildene innhentet. Fluorescens-baserte immundeteksjon er en kraftig metode med et bredt spekter av applikasjoner fra den cellulære lokalisering av et antigen til diagnose. Nye fremskritt i disse tilnærmingene vil bli oppnådd med den fremtidige utviklingen av nye fluorophores, oppkjøps enheter og mikroskopi teknikker, til bilde tidligere uobserverte detaljer om biologiske strukturer og prosesser.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Forfatterne hevder at de ikke har noen konkurrerende økonomiske interesser.
Acknowledgments
Forfatterne er takknemlige til INRA MIMA2 bildebehandling kjernefasiliteten (INRA, UMR1198, Jouy-en-Josas) og til de ansatte på IERP enheten (UE 0907, INRA, Jouy-en-Josas) for dyr omsorg og fasiliteter. Vi vil også gjerne takke IH Mather, MC Neville og S. Tooze for å gi oss svært nyttig antilegemer.
Materials
| Name | Company | Catalog Number | Comments |
| Dissection | |||
| Pins | |||
| Ethanol | |||
| Scissors | |||
| Scalpel and adapted blades | |||
| Ice | |||
| Towel paper | |||
| Tissue sample preparation | Company | Catalog Number | Comments/Description |
| Phosphate Buffered Saline (pH7.4) | Sigma | P-3813 | |
| Paraformaldehyde (PFA, 32% EM grade, 100 ml) | Electron Microscopy Sciences | 15714-S | personnal protection equipment required WARNING: this product will expose you to Formaldehyde Gas, a chemical known to cause cancer |
| OCT compound/Tissue Tek | Sakura | 4583 | |
| Sucrose (D-saccharose) | VWR | 27480.294 | |
| Plastic molds | Dominique Dutscher | 39910 | |
| Liquid nitrogen | |||
| Cryostat/sample support | Leica | CM3050S | |
| Razor blades (SEC35) | Thermo Scientific | 152200 | |
| Slide box | |||
| Glass slides Superfrost/Superfrost Ultra Plus | Thermo Scientific | 10143560W90/1014356190 | |
| Brushes | |||
| IHC | Company | Catalog Number | Comments/Description |
| Super Pap Pen | Sigma | Z377821-1EA | |
| Permanent marker (black) | |||
| 50 mM NH4Cl in PBS | Sigma | A-0171 | |
| 0.1 M glycine in PBS | VWR | 24403.367 | |
| Antigen Retrieval solution: Tris 100 mM 5% urea pH9.6 | |||
| Heater (up to 100°C) | |||
| Bovine Serum Albumin (BSA) | Sigma | A7906-100G | |
| Vectashield (anti-fading mounting medium) without DAPI/with DAPI | Vector Laboratories | H-1000/H-1200 | |
| Glass coverslips 22x50mm (microscopy grade) | VWR | CORN2980-225 | |
| Nail polish | |||
| Primary antibodies | Company | Catalog Number | Comments/Description |
| Rabbit anti-mouse caseins (#7781; 1:50 dilution) | generously gifted by M.C. Neville (University of Colorado Health Sciences Center, USA) |
||
| Mouse anti-cytokeratin 8 (CK8, clone 1E8, 1:50 dilution) | Biolegend (Covance) | MMS-162P | |
| Mouse anti-cytokeratin 14 (CK14, cloneLL002, 1:50 dilution) | Thermo Scientific | MS-115-P0/P1 | |
| Rabbit anti-butyrophilin (1:300 dilution) | generously gifted by I.H. Mather (Department of Animal and Avian Sciences University of Maryland College Park, USA) | ||
| Rabbit anti-Stx6 (1:50 dilution) | generously gifted S. Tooze (Cancer Research UK, London Research Institute, London, UK) |
||
| Rabbit anti-VAMP4 (1:50 dilution) | Abcam | ab3348 | |
| Secondary antibodies | Company | Catalog Number | Comments/Description |
| Rhodamine-conjugated goat anti-rabbit IgG (H + L) (1:300 dilution) | Jackson ImmunoResearch Laboratories | 111-025-003 | |
| Counterstains | Company | Catalog Number | Comments/Description |
| Bodipy 493/503 | Life Technologies (Molecular Probes) | D-3922 | |
| DAPI (4-6-diamidino-2-phenylindole) | Life Technologies (Molecular Probes) | D-1306 | |
| Observation/Image capture | Company | Catalog Number | Comments/Description |
| conventional fluorescence microscope | Leica Leitz DMRB microscope |
Standard filters for FITC, Rhodamine and DAPI emissions, ×63 oil-immersion objective (NA 1.3), DP50 imaging camera (Olympus), CellˆF software (Olympus) |
|
| Laser Scanning Microscope (confocal microscopy) | Zeiss LSM 510 microscope |
Plan-Apochromat ×63 oil-immersion objective (NA 1.4), CLSM 510 software, Confocal facilities, MIMA2 Platform, INRA Jouy-en-Josas, France, http://mima2.jouy.inra.fr/mima2) | |
| Image treatment | Company | Catalog Number | Comments/Description |
| ImageJ 1.49k software | Free software |
References
- Watson, C. J., Khaled, W. T. Mammary development in the embryo and adult: a journey of morphogenesis and commitment. Development. , 135-995 (2008).
- Smith, G. H. Experimental mammary epithelial morphogenesis in an in vivo model: evidence for distinct cellular progenitors of the ductal and lobular phenotype. Breast Cancer Res Treat. 39, 21-31 (1996).
- Van Keymeulen, A., et al. Distinct stem cells contribute to mammary gland development and maintenance. Nature. 479, 189-193 (2011).
- Oakes, S. R., Gallego-Ortega, D., Ormandy, C. J. The mammary cellular hierarchy and breast cancer. Cell Mol Life Sci. 71, 4301-4324 (2014).
- Visvader, J. E., Stingl, J. Mammary stem cells and the differentiation hierarchy: current status and perspectives. Genes & development. 28, 1143-1158 (2014).
- Robinson, G. W. Cooperation of signalling pathways in embryonic mammary gland development. Nat Rev Genet. 8, 963-972 (2007).
- Cowin, P., Wysolmerski, J. Molecular mechanisms guiding embryonic mammary gland development. Cold Spring Harb Perspect Biol. 2, a003251 (2010).
- Brisken, C., O'Malley, B. Hormone action in the mammary gland. Cold Spring Harb Perspect Biol. 2, a003178 (2010).
- Gjorevski, N., Nelson, C. M. Integrated morphodynamic signalling of the mammary gland. Nat Rev Mol Cell Biol. 12, 581-593 (2011).
- Daniel, C. W., Smith, G. H. The mammary gland: a model for development. J Mammary Gland Biol Neoplasia. 4, 3-8 (1999).
- Howlett, A. R., Bissell, M. J. The influence of tissue microenvironment (stroma and extracellular matrix) on the development and function of mammary epithelium. Epithelial Cell Biol. 2, 79-89 (1993).
- Edwards, G., Streuli, C. Signalling in extracellular-matrix-mediated control of epithelial cell phenotype. Biochem Soc Trans. 23, 464-468 (1995).
- Hennighausen, L., Robinson, G. W. Think globally, act locally: the making of a mouse mammary gland. Genes & development. 12, 449-455 (1998).
- Topper, Y. J., Freeman, C. S. Multiple hormone interactions in the developmental biology of the mammary gland. Physiol Rev. 60, 1049-1106 (1980).
- Brisken, C., et al. A paracrine role for the epithelial progesterone receptor in mammary gland development. Proc Natl Acad Sci U S A. 95, 5076-5081 (1998).
- Ormandy, C. J., Binart, N., Kelly, P. A. Mammary gland development in prolactin receptor knockout mice. J Mammary Gland Biol Neoplasia. 2, 355-364 (1997).
- Oakes, S. R., Rogers, R. L., Naylor, M. J., Ormandy, C. J. Prolactin regulation of mammary gland development. J Mammary Gland Biol Neoplasia. 13, 13-28 (2008).
- Hennighausen, L., Robinson, G. W. Information networks in the mammary gland. Nat Rev Mol Cell Biol. 6, 715-725 (2005).
- Kouros-Mehr, H., Werb, Z. Candidate regulators of mammary branching morphogenesis identified by genome-wide transcript analysis. Dev Dyn. 235, 3404-3412 (2006).
- Khaled, W. T., et al. The IL-4/IL-13/Stat6 signalling pathway promotes luminal mammary epithelial cell development. Development. 134, 2739-2750 (2007).
- Asselin-Labat, M. L., et al. Gata-3 is an essential regulator of mammary-gland morphogenesis and luminal-cell differentiation. Nat Cell Biol. 9, 201-209 (2007).
- Barcellos-Hoff, M. H., Aggeler, J., Ram, T. G., Bissell, M. J. Functional differentiation and alveolar morphogenesis of primary mammary cultures on reconstituted basement membrane. Development. 105, 223-235 (1989).
- Robinson, G. W., McKnight, R. A., Smith, G. H., Hennighausen, L. Mammary epithelial cells undergo secretory differentiation in cycling virgins but require pregnancy for the establishment of terminal differentiation. Development. 121, 2079-2090 (1995).
- Streuli, C. H., Bissell, M. J. Mammary epithelial cells, extracellular matrix, and gene expression. Cancer Treat Res. 53, 365-381 (1991).
- Streuli, C. H., et al. Laminin mediates tissue-specific gene expression in mammary epithelia. J Cell Biol. 129, 591-603 (1995).
- Boudreau, N., Sympson, C. J., Werb, Z., Bissell, M. J. Suppression of ICE and apoptosis in mammary epithelial cells by extracellular matrix. Science. 267, 891-893 (1995).
- Pullan, S., et al. Requirement of basement membrane for the suppression of programmed cell death in mammary epithelium. J Cell Sci. 109 (Pt 3), 631-642 (1996).
- Schmidhauser, C., Bissell, M. J., Myers, C. A., Casperson, G. F. Extracellular matrix and hormones transcriptionally regulate bovine beta-casein 5' sequences in stably transfected mouse mammary cells. Proc Natl Acad Sci U S A. 87, 9118-9122 (1990).
- Streuli, C. H., et al. Stat5 as a target for regulation by extracellular matrix. J Biol Chem. 270, 21639-21644 (1995).
- Sollner, T., et al. SNAP receptors implicated in vesicle targeting and fusion. Nature. 362, 318-324 (1993).
- Jahn, R., Scheller, R. H. SNAREs--engines for membrane fusion. Nat Rev Mol Cell Biol. 7, 631-643 (2006).
- Weber, T., et al. SNAREpins: minimal machinery for membrane fusion. Cell. 92, 759-772 (1998).
- Sollner, T., Bennett, M. K., Whiteheart, S. W., Scheller, R. H., Rothman, J. E. A protein assembly-disassembly pathway in vitro that may correspond to sequential steps of synaptic vesicle docking, activation, and fusion. Cell. 75, 409-418 (1993).
- McNew, J. A. Regulation of SNARE-mediated membrane fusion during exocytosis. Chem Rev. 108, 1669-1686 (2008).
- Wang, C. C., et al. VAMP8/endobrevin as a general vesicular SNARE for regulated exocytosis of the exocrine system. Mol Biol Cell. 18, 1056-1063 (2007).
- Chat, S., et al. Characterisation of the potential SNARE proteins relevant to milk product release by mouse mammary epithelial cells. Eur J Cell Biol. 90, 401-413 (2011).
- Reinhardt, T. A., Lippolis, J. D. Bovine milk fat globule membrane proteome. J Dairy Res. 73, 406-416 (2006).
- Robenek, H., et al. Butyrophilin controls milk fat globule secretion. Proc Natl Acad Sci U S A. 103, 10385-10390 (2006).
- Fujimoto, T., Ohsaki, Y., Cheng, J., Suzuki, M., Shinohara, Y. Lipid droplets: a classic organelle with new outfits. Histochem Cell Biol. 130, 263-279 (2008).
- Mather, I. H., Keenan, T. W. Origin and secretion of milk lipids. J Mammary Gland Biol Neoplasia. 3, 259-273 (1998).
- Heid, H. W., Keenan, T. W. Intracellular origin and secretion of milk fat globules. Eur J Cell Biol. 84, 245-258 (2005).
- McManaman, J. L., Russell, T. D., Schaack, J., Orlicky, D. J., Robenek, H. Molecular determinants of milk lipid secretion. J Mammary Gland Biol Neoplasia. 12, 259-268 (2007).
- de Assis, S., Warri, A., Cruz, M. I., Hilakivi-Clarke, L. Changes in mammary gland morphology and breast cancer risk in rats. Journal of visualized experiments : JoVE. , (2010).
- Plante, I., Stewart, M. K., Laird, D. W. Evaluation of mammary gland development and function in mouse models. Journal of visualized experiments : JoVE. , (2011).
- Galio, L., et al. MicroRNA in the ovine mammary gland during early pregnancy: spatial and temporal expression of miR-21, miR-205, and miR-200. Physiol Genomics. 45, 151-161 (2013).
- Linzell, J. L., Peaker, M. The effects of oxytocin and milk removal on milk secretion in the goat. J Physiol. 216, 717-734 (1971).
- Knight, C. H., Peaker, M., Wilde, C. J. Local control of mammary development and function. Rev Reprod. 3, 104-112 (1998).
- Walid, M. S., Osborne, T. J., Robinson, J. S. Primary brain sarcoma or metastatic carcinoma? Indian J Cancer. 46, 174-175 (2009).
- Hue-Beauvais, C., et al. Localisation of caveolin in mammary tissue depends on cell type. Cell Tissue Res. 328, 521-536 (2007).
- McManaman, J. L., Neville, M. C. Mammary physiology and milk secretion. Adv Drug Deliv Rev. 55, 629-641 (2003).
- Mather, I. H., Jack, L. J. A review of the molecular and cellular biology of butyrophilin, the major protein of bovine milk fat globule membrane. J Dairy Sci. 76, 3832-3850 (1993).
- Heid, H. W., Winter, S., Bruder, G., Keenan, T. W., Jarasch, E. D. Butyrophilin, an apical plasma membrane-associated glycoprotein characteristic of lactating mammary glands of diverse species. Biochim Biophys Acta. 728, 228-238 (1983).
- Bock, J. B., Klumperman, J., Davanger, S., Scheller, R. H. Syntaxin 6 functions in trans-Golgi network vesicle trafficking. Mol Biol Cell. 8, 1261-1271 (1997).
- Tran, T. H., Zeng, Q., Hong, W. VAMP4 cycles from the cell surface to the trans-Golgi network via sorting and recycling endosomes. J Cell Sci. 120, 1028-1041 (2007).
- Wendler, F., Page, L., Urbe, S., Tooze, S. A. Homotypic fusion of immature secretory granules during maturation requires syntaxin 6. Mol Biol Cell. 12, 1699-1709 (2001).
- Wendler, F., Tooze, S. Syntaxin 6: the promiscuous behaviour of a SNARE protein. Traffic. 2, 606-611 (2001).
- Shitara, A., et al. VAMP4 is required to maintain the ribbon structure of the Golgi apparatus. Mol Cell Biochem. 380, 11-21 (2013).
- Thibault, C., Levasseur, M. C. La reproduction chez les mammifères et l'homme. , INRA Editions. 928 (2001).
- Truchet, S., Wietzerbin, J., Debey, P. Mouse oocytes and preimplantation embryos bear the two sub-units of interferon-gamma receptor. Mol Reprod Dev. 60, 319-330 (2001).



